外周血NLR及LMR在特发性膜性肾病患者病情评估中的价值
高静歌,翟亚玲,窦艳娜,刘栋,肖静,赵占正,刘章锁,程根阳
1郑州大学第一附属医院,郑州450052;2郑州大学肾脏病研究所
近年来,随着人口老龄化、生活方式的改变和环境污染的加剧,特发性膜性肾病(IMN)发病率呈不断上升趋势[1]。IMN是一种抗体介导的自身免疫性疾病。目前,足细胞表面抗原磷脂酶A2受体1(PLA2R1)及含有血小板反应蛋白1型结构域7A(THSD7A)的自身循环抗体被认为在IMN的发展中起重要作用,PLA2R1和THSD7A已作为疾病诊断的生物标志物[2~4]。然而,PLA2R抗体及THSD7A抗体检测目前价格偏高,仅在国内少数医院开展,因此,寻找简单准确的生物标志物显得尤为重要。中性粒细胞-淋巴细胞比值(NLR)和淋巴细胞-单核细胞比值(LMR)是近年来研究较多的反映机体免疫和慢性炎症状态的指标,因其易于检测而备受关注。NLR及LMR在恶性肿瘤、慢性肾脏病、糖尿病肾病、肾癌、血液透析患者中研究较多,与病情进展及预后密切相关,已被认为是疾病鉴别诊断和预测患者预后的可靠指标[5~9]。最近研究表明,异常的NLR水平与系统性红斑狼疮(SLE)、ANCA相关性血管炎、银屑病、原发性干燥综合征、白塞病等自身免疫性疾病有关[10~12]。IMN作为免疫和炎症反应参与的疾病,NLR及LMR水平对其病情评估作用尚不明确。2019年1月,我们探讨了外周血NLR及LMR在IMN患者病情评估中的价值。
1 资料与方法
1.1 临床资料 选取2014年12月~2018年6月收治于郑州大学第一附属医院肾内科、行经皮肾穿刺活检病理确诊为IMN患者902例。病例均结合临床表现及肾组织光镜、电镜、免疫荧光检查,并排除SLE、乙型肝炎病毒感染、恶性肿瘤、原发性干燥综合征、类风湿关节炎、其他自身免疫性疾病和药物、毒物等原因引发的继发性膜性肾病,明确诊断为IMN。收集患者肾穿刺前所完善的人口学资料及实验室检查结果,主要包括性别、年龄、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血肌酐(Scr)、血尿酸(UA)、血尿素氮(BUN)、白蛋白(Alb)、C反应蛋白(CRP)、24 h尿蛋白总量、血抗磷脂酶A2受体(PLA2R)抗体等,根据公式eGFR=175·Scr-1.234·age-0.179·0.79 (如果是女性)[13]计算肾小球滤过率。本研究经郑州大学第一附属医院伦理委员会批准。所有研究对象或其家属知情同意。
1.2 外周血中NLR及LMR测算 根据收集到的临床资料结果计算NLR及LMR,计算公式:NLR=外周血中性粒细胞计数(×109/L)/外周血淋巴细胞计数(×109/L);LMR=外周血淋巴细胞计数(×109/L)/外周血单核细胞计数(×109/L)。
1.3 肾组织病理检查 根据 Ehrenreich-Churg 膜性肾病分期的标准,将IMN分为Ⅰ~Ⅳ期[14]。为便于统计,当介于两个分期之间时,以高分期为最终分期。计算肾小球硬化率;统计肾小管/间质病变程度(0表示未见明显病变,1表示灶状病变,2表示片状病变,3表示弥漫状病变);统计血管损伤程度(0表示未见明显病变,1表示单纯血管管壁增厚,2表示除血管管壁增厚外,还合并其他病变,如纤维素样坏死、玻璃样病变等);统计肾脏组织免疫球蛋白及补体沉积的荧光强度,IgG及IgG4分为“0”组(染色强度≤+)、“1”组(染色强度++)和“2”组(染色强度≥+++);补体沉积的荧光强度0表示染色强度<+,1表示染色强度≥+。
2 结果
2.1 IMN患者不同NLR水平间临床、病理指标对比 根据NLR中位数(1.95)将患者分为NLR高水平组和NLR低水平组各451例。NLR高水平组男性占比64.5%(291/451),年龄50.00(42.00,61.00)岁,BUN水平为5.11(4.00,6.85)mmol/L,Scr水平为70.00(58.00,81.00)μmol/L,UA水平为(313.43±83.51)μmol/L,Alb水平为(25.26±6.60)g/L,CRP水平为0.92(0.20,1.90)mg/L,24 h尿蛋白总量为4.61(2.56,7.51)g,抗PLA2R抗体水平为36.90(10.80,119.15)pU/mL。NLR低水平组男性占比56.1%(253/451),年龄48.00(37.00,58.00)岁,BUN水平为4.60(3.71,5.70)mmol/L,Scr水平为66.00(55.00,78.00)μmol/L,UA水平为(315.97±83.36)μmol/L,Alb水平为(25.76±6.46)g/L,CRP水平为0.90(0.19,2.72)mg/L,24 h尿蛋白总量水平为4.56(2.26,7.45)g,抗PLA2R抗体水平为33.10(9.50,115.10)pU/mL。相较于NLR低水平组,NLR高水平组男性患者居多、年龄偏大、BUN及Scr水平高(P均<0.05);在病理指标方面,相较于NLR低水平组,NLR高水平组C3在肾组织上沉积多、肾小管/间质病变重(P均<0.05),见表1。
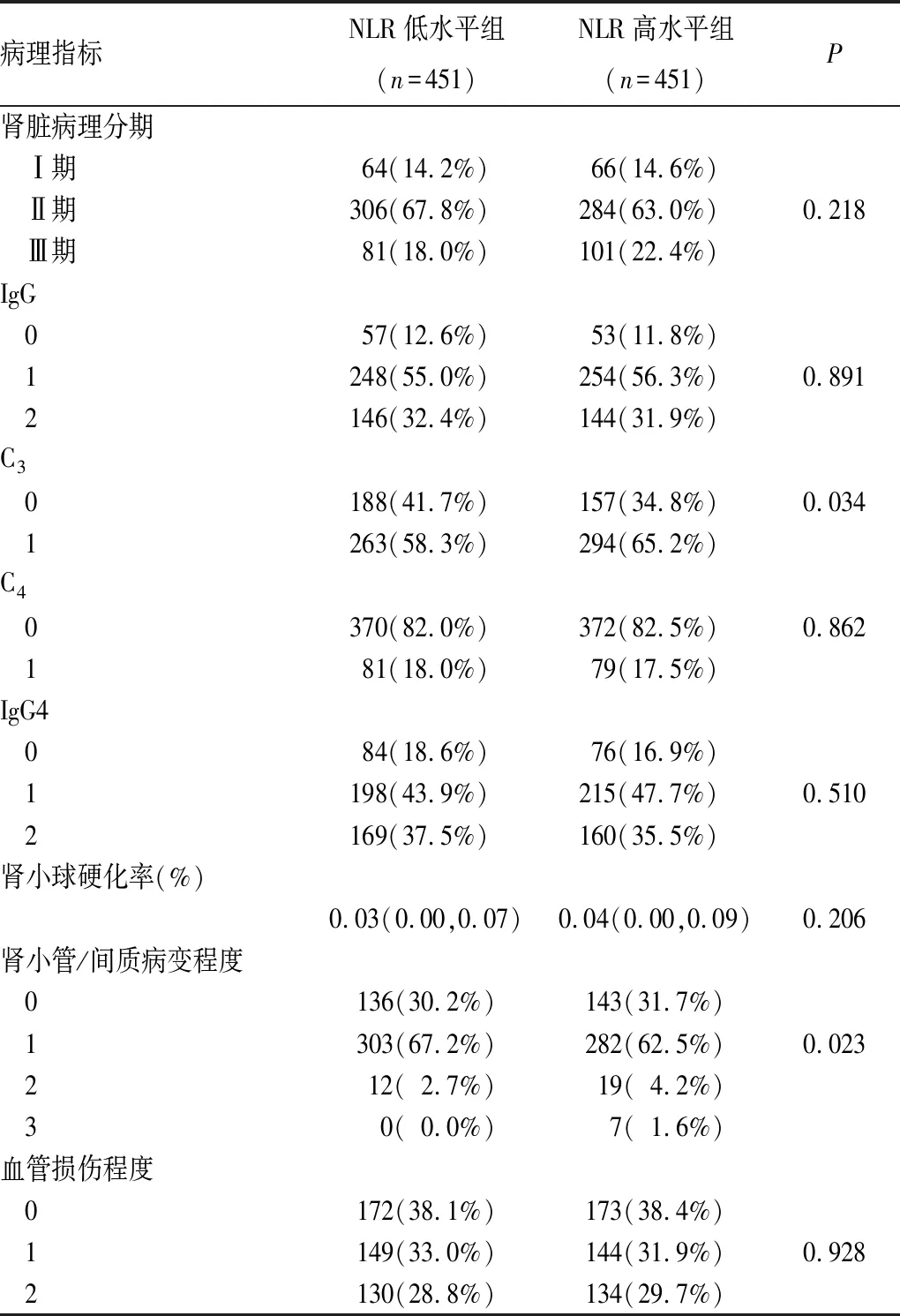
表1 IMN患者NLR不同水平间病理指标对比
2.2 IMN患者不同LMR水平间临床、病理指标对比 根据LMR中位数(4.30)将患者分为LMR高水平组和LMR低水平组各451例,LMR低水平组男性占比65.2%(294/451),年龄50.00(42.00,61.00)岁,BUN水平为5.10(4.00,6.60)mmol/L,Scr水平为71.00(59.00,82.00)μmol/L,UA水平为(310.55±84.27)μmol/L,Alb水平为(25.16±6.59)g/L,CRP水平为0.90(0.19,2.00)mg/L,24 h尿蛋白总量为4.62(2.52,7.60)g,抗PLA2R抗体水平为34.10(11.50,113.70)pU/mL。LMR高水平组男性占比55.4%(250/451),年龄47.00(37.00,58.00)岁,BUN水平为4.60(3.70,5.88)mmol/L,Scr水平为65.00(55.00,77.00)μmol/L,UA水平为(318.78±85.45)μmol/L,Alb水平为(25.85±6.46)g/L,CRP水平为0.95(0.20,2.53)mg/L,24 h尿蛋白总量为4.56(2.41,7.41)g,抗PLA2R抗体水平为37.20(9.05,130.80)pU/mL。相较于LMR高水平组,LMR低水平组男性患者居多、年龄较大、BUN及Scr水平高(P均<0.05);病理指标方面,两组间未见统计学差异,见表2。
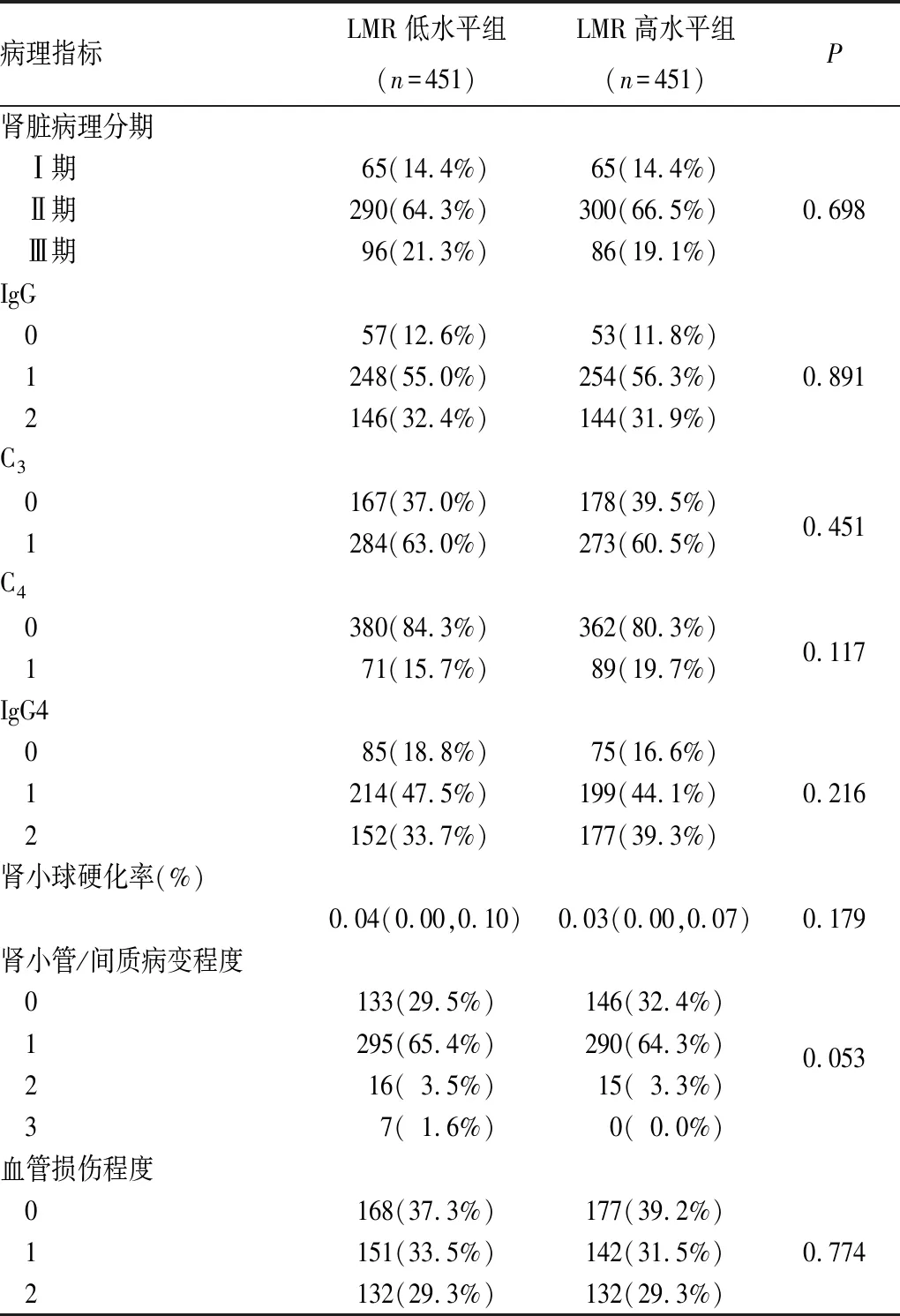
表2 IMN患者LMR不同水平之间病理指标对比
2.3 IMN患者NLR、LMR与肾小球滤过率的相关性 NLR与肾小球滤过率呈负相关(r=-0.112,P<0.01),LMR与肾小球滤过率呈正相关(r=0.176,P<0.01)。
3 讨论
中性粒细胞是宿主防御的重要介质,可产生诸多炎症介质和细胞因子,并介导自身免疫性疾病的先天和适应性免疫反应[15]。而淋巴细胞作为免疫细胞,参与机体主要的免疫活动。T淋巴细胞通过分泌白细胞介素等多种细胞因子刺激B淋巴细胞增殖和激活,B淋巴细胞则通过介导体液免疫、形成免疫复合物沉积于肾小球上皮细胞下,导致肾小球滤过屏障损伤,参与疾病发生[16]。NLR是一种亚临床炎症标志物,已与其他炎症标志物联用于自身和非自身免疫性疾病的炎症检测[8,10,12]。SLE患者的NLR水平高于正常对照组[9],NLR水平异常与糖尿病肾病、慢性肾脏病、ANCA相关性血管炎、干燥综合征等的发生发展有关[5,6,8,11]。有文献[17]指出,在糖尿病肾病中,C3沉积与肾小球滤过屏障受损有关,肾脏损害重、蛋白尿多的患者,可伴随更多的C3漏出,并沉积于肾脏局部继发免疫防御反应,进一步加重肾脏损伤;Abe等[18]证实,IgA肾病患者的肾小球固有细胞(系膜细胞、上皮细胞等)可合成C3及其活化产物,并与病理严重程度相关。本研究结果显示,在IMN患者中,NLR高水平组C3在肾组织上沉积更多,肾小管/间质病变更重,NLR水平越高,肾小球滤过率越低,NLR与IMN疾病严重程度相关,与以往在其他自身免疫性疾病中的结果相似。
在多发性骨髓瘤中,LMR是患者总生存率(OS)和无进展生存率(PFS)的独立预测指标,LMR≤4.20的患者OS和PFS均低于LMR>4.20患者;此外,LMR≤4.20患者的血清乳酸脱氢酶、肌酐、钙和β2微球蛋白水平明显升高,复发率较高[19]。本研究结果显示,IMN患者LMR低水平组的BUN及Scr水平高;同时,LMR水平低,肾小球滤过率低。
IMN是一种器官特异性自身免疫性疾病,由自身循环抗体与足细胞表面的自身抗原结合而致病[20];PLA2R1和THSD7A是目前已被公认的两大靶标抗原[3,4]。但本研究中,并未发现NLR和LMR水平与PLA2R抗体滴度的相关性。作为一种自身免疫性疾病,IMN患者的免疫功能处于紊乱状态,多种因素参与其中,可能涉及更多机制。
与检测其他细胞因子相比,NLR和LMR计算方便,成本低。此外,与单个白细胞参数相比,NLR和LMR相对稳定,不容易受到脱水/过量水化、血液样本稀释和血液规格的影响,同时被证实可反映IMN患者的病情。本研究存在一定局限性。首先,患者均来自同一个中心。其次,本研究是一项缺乏纵向观察的回顾性研究,可能受其他因素影响。此外,本研究缺乏预后方面的观察。
综上所述,NLR和LMR可作为反映IMN患者病情严重程度的参考指标。

