可栽培食用菌子实体发育相关的调控基因研究进展*
袁鹏宇,崔凤仙,周国平,安 霜,周 雪,李宗菊
(云南大学生命科学学院,云南 昆明 650091)
可培养食用菌子实体的生长发育受到外在因素和内在因素的共同调控,外在环境因素如湿度、光照、CO2浓度以及温度等。内在因素主要是遗传基因。而遗传基因等的调控也是近年来研究的热点,比如吴小梅等[1]利用高通量测序技术对双孢蘑菇(Agaricus bisporus)原基期、采收期和开伞后期等不同发育时期进行了RNA-Seq分析,其结果表明采收期_vs_原基期的差异基因以及开伞后期_vs_原基期的差异基因主要参氨基酸代谢、核苷酸代谢、碳水化合物代谢、脂类代谢、能量代谢这五大代谢通路中。Wang等[2]利用转录组测序技术对香菇子实体的候选基因和信号通路等进行了研究,研究结果表明候选基因不仅参与子实体生长发育过程中的嘌呤和脂肪酸等代谢,其也可用作商业和医药上相关食用菌分子鉴定的依据。谢宝贵等[3-5],系统地分析了金针菇完整生活史过程中调控其生长发育的不同影响因子,对与之调控相关基因的表达情况以及功能等进行了比较全面的研究,这些相关的调控基因在其完整生活史过程中的不同生长发育阶段都分别扮演着至关重要的角色。本文通过对裂褶菌(Schizophyllum commune)、糙皮侧耳(Pleurotus ostreatus)、香菇(Lentinus edodes)、双孢蘑菇(Agaricus bisporus)、金针菇(Flammulina velutipes)、草菇(Volvariella volvacea)等食用菌的几大类子实体调控基因进行综述,为野生食用菌基因功能相关方面的研究提供借鉴和一定的理论基础。
1 可培养食用菌子实体相关调控基因代表类型
1.1 疏水蛋白编码基因
疏水蛋白(hydrophobin) 涉及真菌的多个发育过程,并且可能在真菌生态学中起重要作用,包括孢子传播,发病机理和外生菌根的形成[6-7]等。
Wessels等[8]、Wetter等[9]研究发现当裂褶菌的疏水蛋白编码基因SC3表达受阻时,裂褶菌在封闭的培养环境中不会形成气生菌丝,在未封闭的环境中会形成与野生型相反的亲水性气生菌丝,气生菌丝的形成是裂褶菌生长发育过程中的重要阶段,其参与裂褶菌空气中成熟子实体的形态发生以及生殖结构的生长分化,有助于无性或有性孢子的传播。
Groot等[10-11]在双孢蘑菇中发现2条编码疏水蛋白的基因hypA和hypB,在未分化的白色菌丝中可检测到hypA高表达,而在成熟的子实体中hypB基因高表达。Lugones等[12-13]研究发现编码疏水蛋白基因ABH3对双孢蘑菇气生菌丝的生长具有诱导作用,而另一编码疏水蛋白基因ABH1与其子实体表面的疏水性和内部结构的形成有关。
徐珍等[14]研究结果显示,金针菇疏水蛋白编码基因fvh1在双核菌株中菌丝阶段的表达量相比于其他阶段高;基因fv-hyd1在双核菌株、单核菌株中,原基阶段的表达量相比于子实体阶段都要低。Ando等[15]研究发现在诱导金针菇子实体之前,fvh1基因在菌丝中不表达,而在诱导子实体之后或之间,该基因特异性表达。Maria等[16]研究表明在糙皮侧耳中,疏水蛋白编码基因fbh1只在子实体阶段表达,而在其它阶段均不表达。Zhang等[17]的研究发现在低温条件下生长发育的白灵菇(Pleurotus nebrodensis),其子实体中疏水蛋白编码基因PN1的表达水平显著降低,并在这个过程中白灵菇菌盖的表面容易受到病菌的侵染,由此推测该基因在白灵菇的生长发育过程中,对其子实体起到一定的保护作用。
1.2 凝集素编码基因
凝集素(lectin) 是一类天然蛋白质,在大型食用真菌中,凝集素在其休眠、生长发育、形态发生和菌根化初期的分子识别中发挥着重要作用[18]。
Nagata等[19]研究表明灰树花(Grifola frondosa)子实体中的凝集素GFL(分子大小为24 kDa,由181个氨基酸组成),在灰树花的子实体阶段活性最高,而在菌丝和原基阶段活性较低,由此推测灰树花子实体的生长发育过程受到GFL的调控。Sun等[20]研究发现凝集素AAL能够促进茶树菇(Agrocybe aegerita) 和黑木耳(Auricularia polytricha) 子实体原基的分化。Tsivileva等[21]的研究发现在香菇原基形成前,外源凝集素与香菇褐色菌丝的聚集有关。Oguri等[22-23]从平菇(Pleurotus cornucopiae) 中分离出分子大小为16.5 kDa和40.0 kDa的凝集素PCL,前一种凝集素可以通过控制某些蛋白质的合成来调控菌丝体的生长发育,这是一种间接性的调控方式,后一种与平菇子实体的形成有关。Kumaran等[24]从药用灵芝 (Ganoderma lucidum) 中分离和鉴定凝集素时,在菌丝生长至第5天时凝集素的活性可被检测,菌丝体生长至第15天后,活性最高。苏文英等[25]在进行烟草种子低温胁迫试验时,发现转化了糙皮侧耳凝集素基因polectin2的烟草种子萌发率明显高于野生型,由此可推测凝集素基因polectin2可提高食用菌的耐低温性。
1.3 转录因子编码基因
转录因子(transcription factor) 协调细胞中基因的表达控制,其结构和组成决定着细胞的寿命和功能。在生物的生长发育过程中,转录因子可增强临近启动子区域基因表达,与基础的转录调节有关[26]。Shelest[27]的报告中阐述了6个真菌特有的转录因子家族,具体信息见表1[28-33]。
Ohm等[34-35]发现裂褶菌中基因fst3和fst4编码的转录因子分别对子实体的发育具有明显的抑制和促进作用,其 fst3和fst4编码的转录因子属于Zn2/Cys6 DNA-binding domain家族。而后的一年,该团队对裂褶菌中另外的5个基因:gat1、c2h2、bril、hom2、hom1进行了研究;其中gat1编码的转录因子属于GATA zinc finger家族,c2h2编码的转录因子属于C2HC zinc finger超家族,bril编码的转录因子属于DNA-binding BRIGHT domain家族[36],基因沉默研究发现,当敲除bril和hom2基因后子实体未发育;敲除hom1和gat1的情况下,只能形成数量较多但体型较小的子实体;hom2和fst4敲除后,影响表达谱中一些基因的表达量;c2h2和hom1敲除后表达量呈明显下降的趋势。此外,敲除hom2和bril这两个基因后,还会显著影响裂褶菌的菌落形态,野生型的裂褶菌菌落形态为非对称型,而将这两个基因沉默后的菌落形状则变成对称型。琼洁等[37]基于金针菇的基因组,研究发现GATA Zinc finger转录因子在很大程度上与冷刺激金针菇诱导原基的形成过程相关。吴塔菊[38]采用RNA干扰和过表达技术,探究了HMG-box转录因子编码基因pdd1在金针菇菌丝生长和子实体发育中的功能,试验研究表明pdd1基因的表达量越低,菌丝的生长越缓慢,pdd1过表达的菌株相比于野生型提前1 d产生原基。陈炳智等[39]研究发现MADS-box转录因子编码基因Vvrin1在草菇子实体伸长期菌柄中的表达量出现高峰,由此推测该基因参与调控草菇菌柄的伸长以及菌盖的开伞。

表1 真菌特有的转录因子家族Tab.1 Specific transcription factors in fungus families
1.4 蛋白激酶编码基因
蛋白激酶(protein kinases,PK),通过与磷酸酶共同作用实现蛋白磷酸化,在调节酶的活性和细胞内信号传导过程中起着关键作用。其在大型真菌发育的各个阶段对细胞内的信号传导机制起到了严格的调控[40-41]。
李琼洁等[32]基于基因敲除的方法研究发现,组氨酸蛋白激酶基因(HK1和HK2)在冷诱导金针菇原基扭结过程中起着重要作用。Stajich等[42]通过转录组分析和隐马尔可夫模型(HMM) 从灰盖鬼伞(Coprinopsis cinerea) 子实体发育的过程中筛选了380个可能起调控作用的蛋白激酶,其中最大的激酶家族是FunK1,其在菌丝期表达显著增加。根据王建等[43]的研究,其结果表明编码SPK蛋白激酶的vv-SPK基因表达量与草菇菌柄的伸长有关。Szeto等[44]通过构建香菇的cDNA文库,分析研究发现组氨酸蛋白激酶基因Le.nik1在香菇原基和子实体成熟时,有较高的表达量,由此推测该基因在香菇原基和子实体生长阶段起着关键的调控作用。Kameshita等[45]研究发现钙调依赖性蛋白激酶(CaM) 在灰盖鬼伞的菌丝阶段高表达,当在培养基中添加CaM抑制剂时,菌丝的生长受到抑制,由此表明CaM在灰盖鬼伞的菌丝生长中起到关键作用。Kaneko等[46]研究发现蛋白激酶CoPK32在灰盖鬼伞的菌丝生长阶段有较高的表达,当菌丝处于高渗透压力的环境下,而导致生长受到严重的抑制时,CoPK32被明显激活,由此可推测CoPK32参与了灰盖鬼伞对环境胁迫的应激反应途径。
1.5 漆酶基因
漆酶(laccase),普遍分布于植物、细菌及真菌中[47]。可催化多种有机和无机底物的氧化反应,包括二酚、多酚、二胺、抗坏血酸盐等[48-49]。在真菌中,漆酶基因大多数发现于多种担子真菌和子囊真菌,常成簇排列[50-51]。
目前在鸡油菌(Cantharellus cibarius)、灵芝属(Ganoderma)、侧耳属(Pleurotus)、大白口蘑(Tricholoma giganteum Massee)、灰盖鬼伞(Coprinopsis cinerea)和草菇等大型真菌中,漆酶基因的表达情况比较相似,其活性只有在子实体形成时才可被检测,持续到成熟期。陈建军[52]等发现在平菇的固体栽培中,漆酶的活性在菌丝生长到40 nm左右酶活性最高,而在出菇后最低。Chen等[53]研究表明漆酶基因lac4草菇子实体的形态发生相关。Zhao[54]和Yildirim等[55]分别探究了香菇、杏鲍菇(Pleurotus eryngii)不同生长发育阶段漆酶的活性变化,发现在香菇和杏鲍菇成熟子实体的菌盖中,漆酶的活性最高;根据后续的研究结果表明,漆酶在食用真菌子实体的形态发生过程中起到重要作用。Tan等[56]在商业化栽培凤尾侧耳(Pleurotus sajor-caju)过程中发现漆酶的活性与其子实体的形态发生有关,随着菌丝体的生长漆酶的活性逐渐增加,达到一定的峰值后,又逐渐降低。随着相关研究的报道,漆酶调控大型食用真菌生长发育的机制受到越来越多的关注,在商业化栽培大型食用菌过程中,改变一些漆酶的浓度或调控方式,可一定程度增加出菇量[57-58]。
1.6 其他
张磊[59]、韩星[60]、仝宗军[61]等分别研究了小G蛋白Ran编码基因FvRan1、寡肽转运蛋白编码基因fvopt1和fvopt2、转运蛋白编码基因fv-msf1等基因在金针菇的菌丝、原基以及子实体不同生长阶段中的调控作用。卢园萍[62]、谢斌[63]、汪健芳[64]、林楠[65]、Yang[66]、严俊杰[67]等发现高速泳动蛋白编码基因vv-exp、依赖性氧合酶编码基因vv-2ogo、钙调磷酸酶催化亚基编码基因Vv-CAN、聚酮合酶编码基因vv-alb、外切-β-1,3-葡萄糖酶编码基因exg2、胱甘肽S-转移酶编码基因vv-gto1等基因在草菇的菌丝、原基以及子实体等不同生长阶段中的重要调控作用。Sakamoto[68]、陶永新等[69]分别在香菇和金针菇中研究发现,基因exg2与香菇的菌褶生长发育具有密切的关系,在香菇成熟时期的菌褶中低表达,而在出菇后,在菌褶中的表达量显著升高,由此推测该基因与香菇的菌褶生长发育具有密切的关系,在金针菇菌柄及菌盖的发育中起着关键的调控作用。Liu等[70]使灰盖鬼伞(Coprinopsis cinerea) 子实体中的cfs1基因沉默后,会造成其营养菌丝纽结停止发育,而在正常cfs1的调控下原基则可形成,由此推测该基因对灰盖鬼伞原基的形成起着关键的调控作用。
因研究者各自命名所研究的基因,略显混乱,所以对文中所述部分基因的结构及其序列进行了总结见表2。
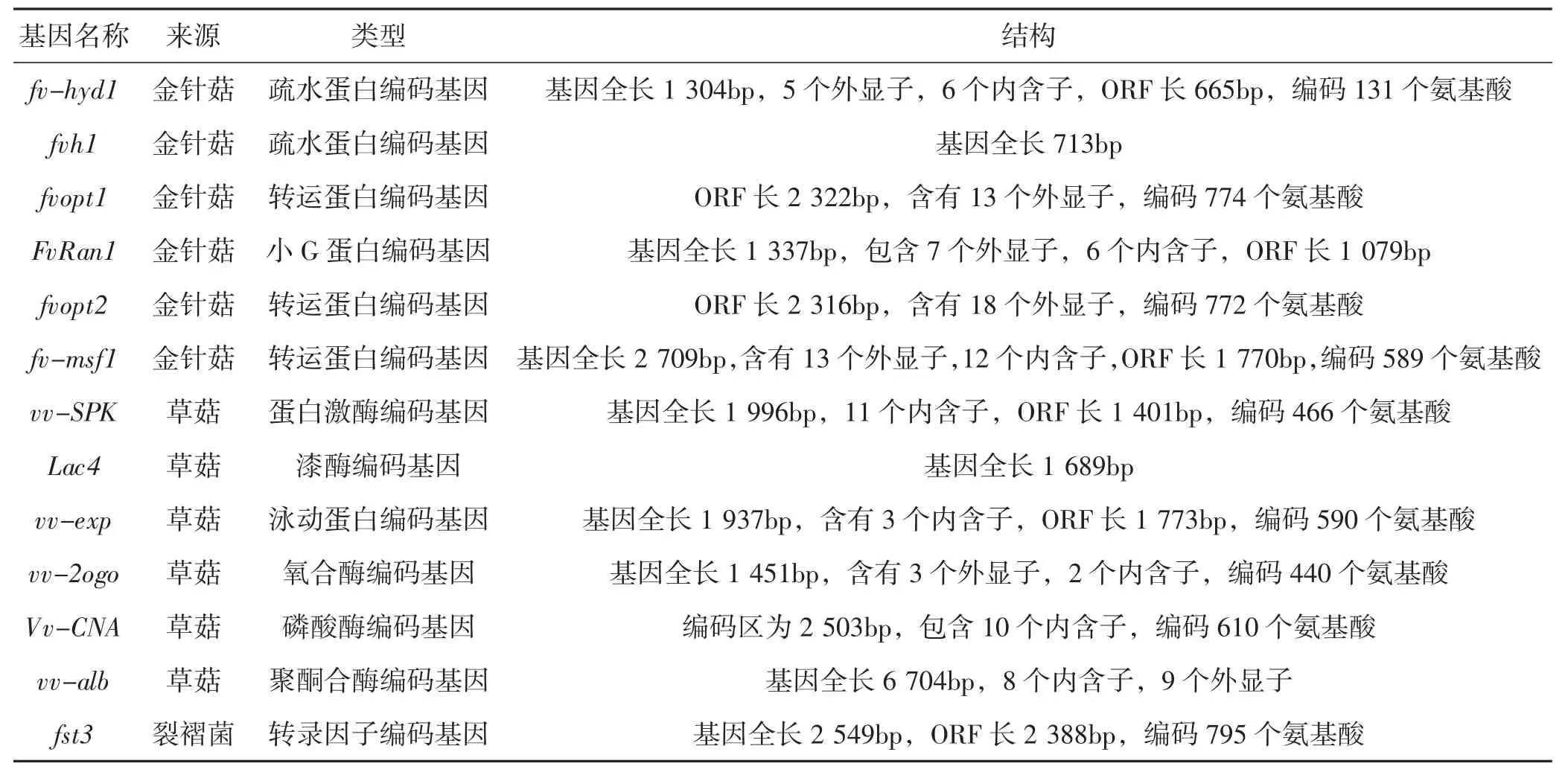
表2 调控基因的信息Tab.2 Regulation genes and their information
2 小结
综上所述,目前关于大型食用真菌子实体生长发育的调控基因研究较多,但来源于不同物种的同一家族基因的同源性高低不一,如凝集素基因约为50%~70%。另外,目前的研究大多数仅停留于基因在子实体生长发育各时期的表达与否,及表达量高低等内容,至于各基因调控机制的研究尚较为薄弱。今后应结合代谢组学等技术,深入研究这些基因的调控机制及代谢通路。

