白细胞介素-1β siRNA联合骨髓间充质干细胞对大鼠类风湿性关节炎治疗效果的研究
周天胜,董轩,潘士锋,刘宗平*,邢华*
(1. 扬州大学兽医学院,江苏 扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3. 苏州药明康德新药开发有限公司,江苏 苏州 215104;4. 上海药明康德新药开发有限公司,上海 200131)
类风湿性关节炎(rheumatoid arthritis, RA)是一种系统性的自身免疫性疾病[1],严重影响患者的生活质量,同时也给社会带来极大的负担,然而目前在临床上仍缺少对这种慢性炎症性疾病的根治性疗法。以往研究表明,抑制白细胞介素1β的表达,可明显改善大鼠RA临床症状[2],因此,IL-1β有可能成为治疗RA的潜在靶点。骨髓间充质干细胞(BMSCs)生物学特性独特,可参与多环节的免疫调节,具有促进组织损伤修复的作用[3-4],因而被广泛应用于免疫性疾病的细胞治疗。本试验利用Ⅱ型胶原蛋白诱导方法制备RA大鼠模型,初步探讨IL-1β在RA等自身免疫病发病机制中的作用。然后对模型大鼠分别进行PBS,IL-1β-siRNA以及IL-1β-siRNA联合BMSCs协同治疗,检测大鼠形态学、行为学、组织病理学和免疫学等变化情况,综合分析治疗效果,为基因联合细胞治疗RA开辟了新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雌性Wistar大鼠(8-10周龄,200-250 g)由扬州大学比较医学中心提供,试验动物使用许可证号为SYXK(苏)2017-0044。实验过程中大鼠饲喂标准化商品鼠粮,饲养在常规饲养环境,温度:(24±2)℃,湿度:(60±10)%。
1.1.2 主要试剂
鸡Ⅱ型胶原蛋白、弗氏完全佐剂、DEPC、戊巴比妥钠,来自Sigma公司;TRIZOL来自Invitrogen;EntransterTM-in vivo和siRNA来自Engreen Biosystem公司;反转录试剂盒、SYBR®Premix ExTaqTM Ⅱ、大鼠IL-1β ELISA Kit,均购买于TaKaRa公司。
1.2 试验方法
1.2.1 大鼠关节炎模型的建立
将40只大鼠随机分成正常对照组(n=10)和Ⅱ型胶原蛋白诱导关节炎(CIA)模型组(n=30)。初次免疫时,CIA模型组用含有鸡Ⅱ型胶原蛋白的乳化液1 mL背部皮内分点注射,正常对照组注射等量生理盐水。初次免疫7 d后加强免疫一次,CIA模型组腹腔注射含有鸡Ⅱ型胶原蛋白的乳化液0.5 mL,正常对照组注射等量生理盐水。免疫后,每周测定一次动物体重以及足趾肿胀值。
1.2.2 行为学检测
采用强迫游泳试验检测治疗前后大鼠的行为学变化。强迫游泳试验前将大鼠放入实验室适应30 min,强迫游泳实验的时间为白天3 h,夜间2 h。实验前1 d,训练大鼠,将其放入透明有机玻璃缸中-缸周围用黑色有机玻璃隔离。大鼠在缸中游泳15 min,使其适应游泳环境;试验时对大鼠在缸中游泳情况进行连续摄像6 min。试验结束后观察并记录大鼠的累计不动时间(大鼠在水中停止挣扎呈漂浮状态,或者仅有细小的肢体运动以保持头部在水面下)和挣扎时间。
1.2.3 血清IL-1β浓度的检测
分别于造模后和治疗后第2周和第4周从眼眶后静脉丛取血,并制备血清,使用ELISA试剂盒检测血清IL-1β水平。
1.2.4 Foxp3和TGF-β1 mRNA表达的检测
分别采集正常组和CIA模型组动物的脾脏组织,使用Trizol总RNA提取试剂盒提取总RNA,使用TaRaKa反转录试剂盒将1 μg RNA反转录成cDNA,荧光定量PCR检测TGF-β1和Foxp3的mRNA表达,TGF-β1上游引物为5′-TGCTGCCGCTTCTGCTCCCACTC-3′,下游引物为5′-ATAGATTGCGTTGTTGCGGTCCAC-3′;Foxp3上游引物5′-GCTTGTTTGCTGTGCGGAGAC-3′,下游引物5′-ATAGATTGCGTTGTTGCGGTCCAC-3′;以β-actin作为内参。移植治疗2周和4周后对脾脏组织中Foxp3和TGF-β1表达检测,步骤同上。
1.2.5 关节的组织病理学检查
建模4周后,采集大鼠膝关节,固定于10%中性福尔马林溶液中,经脱钙、取材、脱水、包埋、切片、HE染色和镜检。
1.2.6 IL-1β-siRNA及IL-1β-siRNA联合BMSCs协同治疗RA效果
采集大鼠股骨骨髓间充质干细胞,贴壁增殖培养3代用于后续细胞移植治疗试验。成功CIA模型大鼠被随机分为PBS治疗组、IL-1β-siRNA治疗组、IL-1β-siRNA联合BMSCs治疗组3组,分别进行尾静脉注射等量PBS、IL-1β siRNA转染试剂混合液(用5%葡萄糖配制2.5 mg/kg的IL-1β-siRNA(由Invitrogen公司提供),与等体积的转染试剂混合,静置15 min用于尾静脉注射)以及IL-1β-siRNA体内转染试剂混合液(同IL-1β-siRNA治疗组)和BMSCs,BMSCs的注射浓度为1×107个/kg大鼠体重。每组的给药频率为每周一次。
1.3 数据的统计学分析
采用SPSS20.0统计软件对数据进行分析,每个试验重复3次,数据用平均数±标准误(x±SE)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 类风湿性关节炎大鼠模型的建立
造模期间动物无死亡,正常对照组大鼠随着饲养时间的延长,体重逐渐增加,精神状态良好。CIA模型组大鼠在首次免疫后第1周开始,体重增长缓慢,在造模1-4周内,模型组体重增长均显著小于对照组大鼠(图1A)。
此外,对照组大鼠足趾均未见肿胀,而CIA模型组大鼠在初次免疫后第1周部分大鼠足趾表面发红,第2周开始出现后足爪明显肿胀,关节僵硬,活动受限,足趾肿胀在第3周达到病程的最高峰,之后趋于稳定,持续至第4周(图1B)。关节肿胀度提示CIA模型大鼠关节病变从第1周开始,持续至第4周,且第2至第3周关节病变最明显。
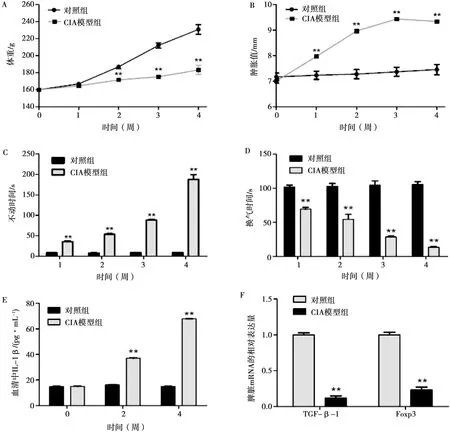
A.大鼠体重;B.足趾肿胀值;C.不动时间;D.挣扎时间;E.血清中IL-1β浓度;F.脾脏中TGF-β1和Foxp3mRNA相对表达量
对建模前后大鼠每周进行一次强迫游泳试验,并进行行为学检测。结果发现,与正常对照组大鼠相比,随着造模时间的延长,CIA模型组大鼠强迫游泳不动时间(图1C)随病程发展越来越长,而大鼠强迫游泳的挣扎时间(图1D)逐渐减少,说明建模后模型大鼠后肢运动障碍严重。建模后每两周检测血清中IL-1β浓度,发现模型组大鼠血清中IL-1β水平随着病程的发展逐渐上升,2周和4周时均极显著高于正常对照组大鼠(图1E)。荧光定量PCR结果显示,造模4周后,与正常对照组大鼠相比,CIA模型大鼠脾脏组织中TGF-β1以及Foxp3 mRNA表达量均极显著低于对照组(图1F)。
2.2 关节组织病理形态学变化
造模4周后对膝关节进行组织病理学检查,镜检发现正常对照组大鼠关节软骨表面光滑、滑膜组织细胞排列整齐规则(图2A),而CIA模型大鼠呈现典型的关节炎症状,关节软骨有明显的糜烂或溃疡,滑膜、关节软骨及关节腔内有重度的炎性细胞浸润,包括中性粒细胞,淋巴细胞,巨噬细胞,伴有轻微出血和纤维素性渗出(图2B)。
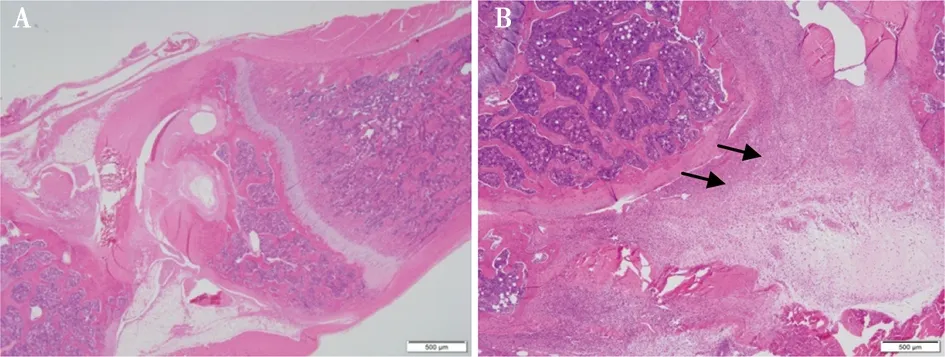
A.正常大鼠关节;B.CIA模型大呈现重度的关节炎(箭头所示炎性细胞浸润)
图2 关节组织病理学变化
2.3 IL-1β-siRNA体内转染联合BMSCs协同治疗RA的效果
与PBS假治疗组大鼠相比,IL-1β-siRNA治疗组和IL-1β-siRNA联合BMSCs治疗组大鼠体重增长均极显著升高,IL-1β-siRNA联合BMSCs治疗组大鼠体重增长更加明显(图3A);此外,IL-1β-siRNA治疗组和IL-1β-siRNA联合BMSCs治疗组大鼠足趾肿胀值均显著降低,且IL-1β-siRNA联合BMSCs治疗组大鼠足趾肿胀值降低的更加明显(图3B)。
在强迫游泳试验中,IL-1β-siRNA治疗组和IL-1β-siRNA联合BMSCs治疗组大鼠不动时间均极显著低于PBS对照组,且在治疗1周和2周后IL-1β-siRNA联合BMSCs治疗组大鼠不动时间极显著低于IL-1β-siRNA单独治疗组(图3C);大鼠强迫游泳的挣扎时间在治疗后均极显著高于PBS对照组,治疗后1、2、3周IL-1β-siRNA联合BMSCs治疗组大鼠挣扎时间极显著高于IL-1β-siRNA单独治疗组(图3D);治疗2周和4周后,治疗组大鼠血清中IL-1β的表达量均极显著低于PBS对照组,且IL-1β-siRNA联合BMSCs治疗组大鼠血清中IL-1β水平极显著低于IL-1β-siRNA单独治疗组(图3E);此外,大鼠脾脏组织中TGF-β1和Foxp3的mRNA相对表达量在治疗组均极显著升高,且IL-1β-siRNA联合BMSCs治疗组大鼠脾脏组织中TGF-β1和Foxp3的mRNA表达极显著高于IL-1β-siRNA治疗组(图3F)。
3 讨论
类风湿性关节炎是一种常见的慢性、系统性的自身免疫性疾病,被认为是危害人类健康的五大疾病之一,病因尚未明确。动物模型在研究RA发病机制中起着非常重要的作用。目前用于制备RA模型的方法和试剂有很多[5-8],其中Trentham等于1977年首次建立了Ⅱ型胶原诱导性关节炎动物模型。在前人研究的基础上,在本研究对CIA造模方法进行了改良,选取了Ⅱ型胶原和完全弗氏佐剂的联合乳化液以及重复注射一次混合抗原,在保证了模型成功率(80%)的同时也使得模型的病理变化及免疫学特性更加稳定、与人类RA更为相似,为后续深入研究RA治疗方法提供了更加理想的动物模型。
RA关节损伤相关的最重要的细胞因子就是IL-1,它可以刺激内皮细胞,促进淋巴细胞、中性粒细胞以及巨噬细胞的大量聚集,提高中性粒细胞对前列腺素的分泌,从而增加滑膜细胞胶原酶、软骨细胞以及成纤维细胞的表达量,蛋白激酶分泌增加导致关节局部炎症反应的发生[9]。在众多细胞因子中IL-1β在RA的发病中起着重要的作用,它在滑膜炎症反应发生发展的循环网络中起着调控作用,可以作为判断RA病情的严重程度以及评价RA临床疗效的重要指标。本试验结果表明,与正常对照组大鼠相比,模型组大鼠呈现典型的关节炎症状,且血清中IL-1β含量极显著升高,结合行为学、组织病理学和免疫学的变化情况,提示RA模型制备成功,并且IL-1β可能在RA的发病机制中发挥关键作用,很可能作为治疗RA的重要靶点。说明可通过对IL-1β进行阻断,降低动物机体IL-1β的水平,从而阻止滑膜炎的产生、发展,从而对RA的治疗起到积极作用。
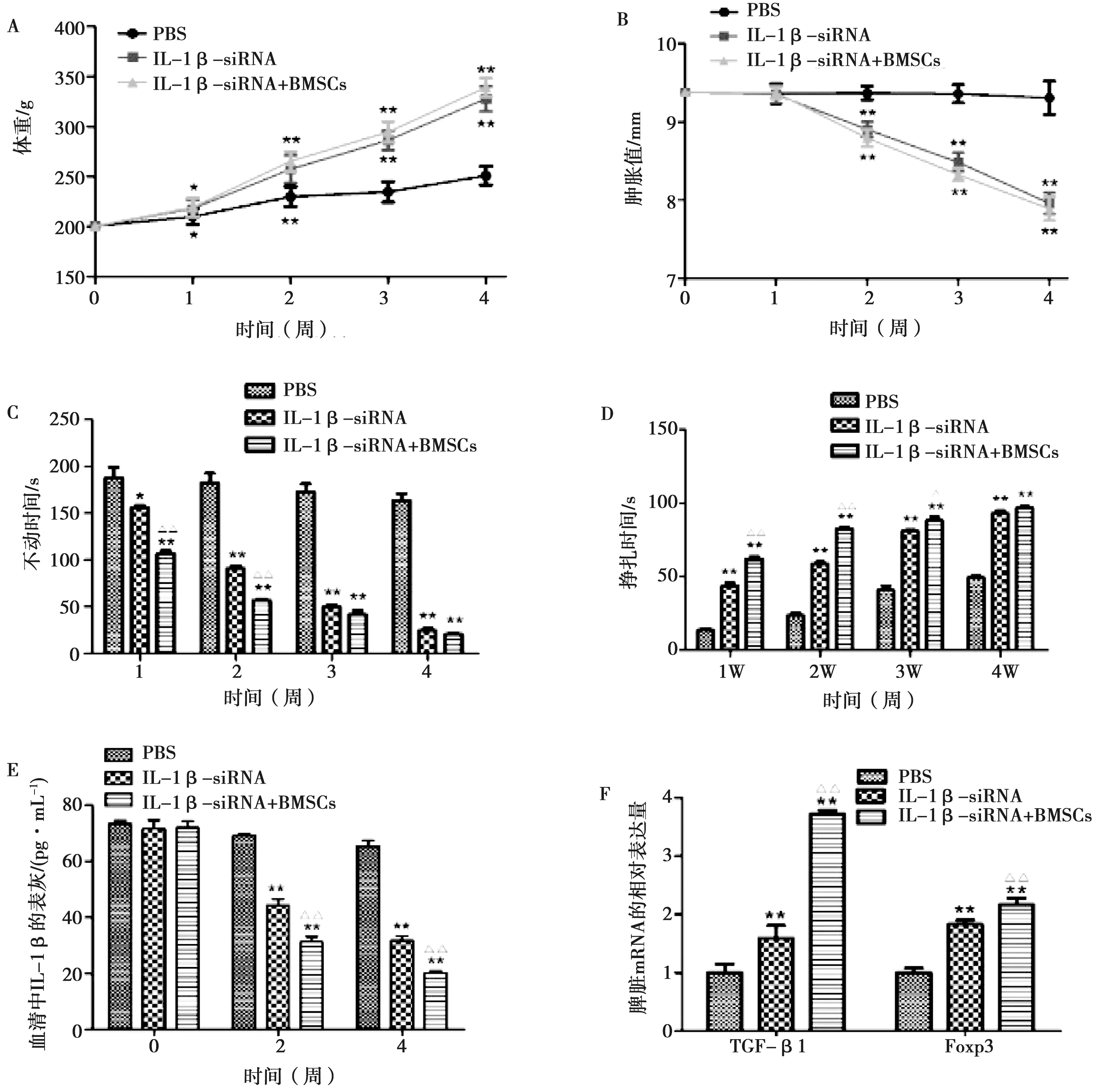
A.体重增长;B.足趾肿胀值;C.不动时间;D.挣扎时间;E.血清中IL-1β浓度;F.脾脏中TGF-β1以及Foxp3 mRNA相对表达量
图3 治疗后各组大鼠试验项目
siRNA是目前一种有效的用于沉默基因表达的技术,并且siRNA的疗法在减少实验性关节炎炎症方面已被证实很有前景[10-14]。BMSCs作为一种基质干细胞,它能够促进多种组织的修复和再生[15],在一定的诱导条件下BMSCs不仅能多向分化为多种组织细胞,还能通过分泌多种基质分子来促进损伤组织的修复[15-18]。本试验选用干扰siRNA体内转染方法来治疗RA模型大鼠,并基于BMSCs的独特优越性,使用干扰siRNA体内转染结合BMSCs移植来治疗RA模型大鼠,以期得到更优的治疗效果。比较各组治疗效果,发现IL-1β-siRNA治疗组和IL-1β-siRNA联合BMSCs治疗组在形态学、行为学、组织病理学以及免疫学水平对RA模型大鼠都具有较好的治疗效果,且IL-1β-siRNA联合BMSCs治疗组对RA模型大鼠的症状缓解具有更显著的效果,说明IL-1β-siRNA联合BMSCs可以增强RA的治疗效果。
转录因子Foxp3在CD4+CD25+Treg上特异性大量表达,对其功能的发挥和发育中都起着非常重要的作用[19-20]。CD4+CD25+T细胞如果缺失了Foxp3的表达,就行使不了细胞功能。自从发现CD4+CD25+调节性T细胞上特异性大量分泌Foxp3以来,已有多项研究证明在Treg上Foxp3的表达量变化直接显现CD4+CD25+T细胞水平的功能活性和变化[21-22]。表达于细胞表面或者分泌至细胞外的TGF-β1是CD4+CD25+调节性T细胞发挥免疫抑制作用的机制之一[23]。TGF-β1是一种主要介导细胞接触免疫并且对细胞分化具有双重调节作用的多肽因子,它可以增强细胞外基质合成以及炎症细胞趋化,抑制免疫反应等。本实验结果发现,CIA模型大鼠脾脏组织中TGF-β1的mRNA表达量极显著低于正常对照组大鼠,提示模型大鼠体内TGF-β1分泌减少可能不足以抑制自身免疫炎症的发展,这可能也是实验性关节炎发病的重要原因之一。在Ⅱ型胶原的刺激下,T淋巴细胞过度增生、活化,可能与调节性T细胞数量的减少或者功能缺失有关,模型大鼠脾脏中Foxp3mRNA表达显著下降,Foxp3mRNA的下调也促使CD4+CD25+调节性T细胞对TGF-β1分泌降低。而在治疗实验中,IL-1β-siRNA治疗组以及IL-1β-siRNA联合BMSCs治疗组大鼠脾脏组织中TGF-β1和Foxp3mRNA表达量均显著上调,表明RA机体CD4+CD25+调节性T细胞的数量和功能都有所改善,说明了RA关节炎症状的改善可能与Treg功能和数量的改变有关。
综上,本研究结果表明,Ⅱ型胶原可成功诱导大鼠关节炎模型,IL-1β可能在RA的发病机制中发挥关键作用,IL-1β-siRNA联合BMSCs可以增强RA的治疗效果,从而为基因联合细胞治疗RA提供了理论基础。

