丙戊酸通过GSK3β/β-catenin信号轴抑制胃癌细胞的增殖和迁移
孙 洁,朴俊杰,2,秦云植,任香善,2,王馨悦,林贞花,2
(1. 延边大学医学院病理学教研室,2. 吉林省科技厅重点实验室,3. 延边大学附属医院麻醉科,吉林 延吉 133002)
胃癌是导致肿瘤患者死亡的第三大常见病因[1]。近几年,随着分子靶向治疗和免疫治疗的发展,我国胃癌患者的5年生存率虽有所提高(约为36%),但与日、韩等其他胃癌高发国相比仍存在较大差距(日、韩胃癌患者的5年生存率均超过60%)[2]。转移和复发是影响胃癌患者病死率的主要原因。因此,有效抑制转移将有助于改善胃癌患者的预后。丙戊酸(valproic acid,VPA)是一种临床上广泛应用的抗癫痫药,也是一种组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂。研究显示,VPA参与多种肿瘤(如恶性胶质瘤[3]、非小细胞肺癌[4]、前列腺癌[5]等)的转录调控,可诱导细胞周期阻滞、凋亡的发生[5],同时,对于血管形成和转移也具有一定的抑制作用。在肿瘤治疗方面,目前的热点主要是将VPA与化疗药物联用来提高化疗的抗肿瘤效果[6]。但是,将VPA与何种化疗药物联用能够更加有效地抑制肿瘤的演进则缺乏相关研究。因此,本研究旨在探究VPA对胃癌细胞增殖、迁移能力的影响及可能涉及的分子机制,从而为VPA的联合用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株 人胃癌细胞株AGS、SGC-7901、MGC-803和BGC-823均由延边大学肿瘤研究中心提供。
1.1.2试剂 胎牛血清(10100147)、RPMI1640(C11875500BT)、青霉素/链霉素(15140-122)均购自美国Gibco公司。二甲基亚砜(dimethyl sulfoxide,DMSO)(D8371)、四甲基偶氮唑盐[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT ](M8180)均购自北京索莱宝生物科技有限公司。低熔点琼脂糖(M0815)购自美国Amresco公司。BCA蛋白定量试剂盒(CW0014)购自北京康为世纪生物科技有限公司。VPA(PHR1061)购自美国Sigma Aldrich公司。兔抗上皮钙黏素(E-cadherin)(3195)、兔抗锌指转录因子(Snail)(3879)、兔抗β联蛋白(β-catenin)(8480)、兔抗磷酸化糖原合成酶激酶3(p-GSK3βser9)(5558)等抗体均购自美国Cell Signaling Techology公司。小鼠抗波形蛋白(Vimentin)(ab8978)抗体购自美国Abcam公司。小鼠抗β肌动蛋白(β-actin)(TA-09)抗体、HRP 标记的山羊抗兔二抗(ZB-2301)和HRP 标记的山羊抗小鼠二抗(ZB-2305)均购自北京中杉金桥生物技术有限公司。山羊抗兔荧光二抗Alexa Fluor® 488(A-11034)、山羊抗小鼠荧光二抗Alexa Fluor® 568(A-11004)均购自美国Thermo Fisher Scientific公司。
1.1.3仪器 CO2恒温培养箱(美国Thermo 公司);全波长多功能酶标仪( 瑞士Tecan 公司) ;光学倒置显微镜(日本Olympus 公司);ChemiDoc 成像系统(美国Bio-Rad 公司);荧光显微镜(日本Olympus 公司)。
1.2 方法
1.2.1细胞培养 将AGS、SGC-7901、MGC-803和BGC-823细胞置于含100 mL·L-1胎牛血清、100 IU·mL-1青霉素和100 μg·mL-1链霉素的RPMI1640培养基中,在37 ℃、5% CO2的培养箱中培养。
1.2.2MTT实验 将细胞消化、离心并以每孔5×103个/100 μL的细胞数接种于96孔板。培养8 h后,加入终浓度为0、2、4、6和8 mmol·L-1的VPA,每个药物浓度设置5个平行复孔。分别培养24 h、48 h和72 h后,每孔内加5 g·L-1的MTT溶液20 μL。随后,培养4 h弃去上清液,每孔内加100 μL 的DMSO, 震荡10 min之后,使用全波长酶标仪于570 nm波长测定各培养孔的吸光值(A)。根据公式计算细胞生存率:细胞生存率/%=(用药组吸光值/对照组吸光值)×100%。
1.2.3软琼脂克隆形成实验 于6孔板中制备双层琼脂糖凝胶(含100 mL·L-1胎牛血清):下层浓度为12 g·L-1,待凝固后,将5×103个细胞与浓度为7 g·L-1的琼脂糖凝胶混合均匀并注于下层胶上。在37 ℃、5% CO2的培养箱中培养2周后,观察细胞克隆数并拍照、计数。
1.2.4划痕愈合实验 将细胞等量接种于6孔板中,待融合度达到90%时,用200 μL的枪头在单层细胞上划痕。用PBS清洗漂浮的细胞。分别加入终浓度为0和3.5 mmol·L-1的VPA/RPMI1640培养基。分别于培养0、24和48 h后观察、拍照。
1.2.5Transwell迁移实验 将细胞以5×104个/100 μL 的浓度接种于Transwell上室。贴壁后,上室分别加入终浓度为0 mmol·L-1和3.5 mmol·L-1的VPA/RPMI1640无血清培养基,下室加入800 μL RPMI-1640完全培养基, 37 ℃、5% CO2的培养箱中培养24 h,终止培养。依次进行多聚甲醛固定、结晶紫染色、脱色、取膜、封片后于显微镜下观察、拍照计数。
1.2.6免疫印迹实验 用药处理结束后,经PBS洗涤、收集细胞,加入裂解液提取总蛋白。使用BCA蛋白定量试剂盒测定各组蛋白的浓度。各组蛋白取40 μg样本进行凝胶电泳、转膜、5 g·L-1脱脂牛奶封闭1 h后,以1 ∶1 000的比例稀释兔抗E-cadherin抗体、小鼠抗Vimentin抗体、兔抗Snail抗体、兔抗β-catenin抗体、兔抗p-GSK3βser9抗体和小鼠抗β-actin抗体。一抗4 ℃孵育过夜。次日,用TBS-T洗膜,以1 ∶3 000的比例稀释山羊抗兔二抗或山羊抗小鼠二抗,室温孵育2 h后,用ECL法显影、曝光,以β-actin为内参。
1.2.7免疫荧光染色 于6孔板中分组爬片用药,培养48 h后,依次进行PBS洗涤、多聚甲醛固定、Triton-100透化、胎牛血清封闭后,以1 ∶500的比例稀释兔抗E-cadherin抗体和小鼠抗Vimentin抗体。一抗4 ℃孵育过夜。次日,PBS洗涤后,以1 ∶400的比例稀释山羊抗兔荧光二抗或山羊抗小鼠荧光二抗,室温避光孵育2 h。PBS洗涤后,滴入含DAPI的封片剂封片,于荧光显微镜下观察、拍照。
1.2.8生物信息学分析 通过STITCH在线数据库筛选VPA的靶向基因;利用STRING在线数据库对VPA的靶向基因进行蛋白互作网络分析;应用Enrichr数据库对VPA的靶向基因进行分子功能分析(GO)和相关通路分析(KEGG)。
2 结果
2.1 VPA抑制AGS、SGC-7901、MGC-803和BGC-823细胞的增殖活性并呈剂量和时间依赖性分别以0、2、4、6和8 mmol·L-1的VPA处理AGS、SGC-7901、MGC-803和BGC-823细胞24 h、48 h和72 h后,MTT实验结果显示,VPA可抑制这4种胃癌细胞的增殖活性,且随着用药浓度的升高、用药时间的延长,细胞活性逐渐降低,呈剂量和时间依赖性(P<0.05,P<0.01,Fig 1)。根据MTT的结果,选取AGS和SGC-7901细胞,3.5 mmol·L-1用药浓度和48 h用药时间进行后续实验(VPA处理48 h时,AGS细胞的IC50为3.25 mmol·L-1,SGC-7901细胞的IC50为3.65 mmol·L-1)。根据这一结果,将3.5 mmol·L-1作为后续实验的用药浓度。
2.2 VPA抑制AGS和SGC-7901细胞的锚定非依赖性增殖能力软琼脂克隆形成实验的结果显示:与对照组相比,VPA用药组的克隆形成数量明显减少,且差异具有统计学意义(P<0.01,Fig 2),提示VPA可抑制AGS和SGC-7901细胞的锚定非依赖性增殖能力。
2.3 VPA抑制AGS和SGC-7901细胞的迁移能力划痕愈合实验和Transwell迁移实验的结果均显示,与对照组相比,VPA用药组细胞的横向迁移能力和纵向迁移能力均受到了明显抑制(P<0.01,Fig 3),提示VPA可有效抑制AGS和SGC-7901细胞的迁移能力。
2.4 VPA抑制AGS和SGC-7901细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT)进程Western blot实验结果显示,与对照组相比,VPA用药组其上皮标志物E-cadherin表达上调,间质标志物Vimentin、Snail表达下调,且差异具有统计学意义(P<0.01)。免疫荧光实验结果也证实,与对照组相比,VPA用药组的E-cadherin表达水平明显上调, Vimentin的表达水平明显下调(Fig 4)。
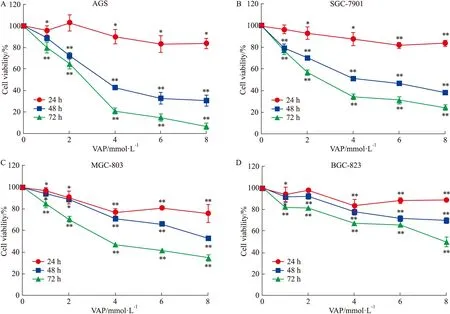
Fig 1 Effect of VPA treatment on proliferation of AGS, SGC-7901, MGC-803 and BGC-823 cells in
Cell viability of AGS, SGC-7901, MGC-803 and BGC-823 cells treated by VPA for 0、 2、 4、 6 and 8 mmol·L-1was measured by MTT assay.*P<0.05,**P<0.01vscontrol group.
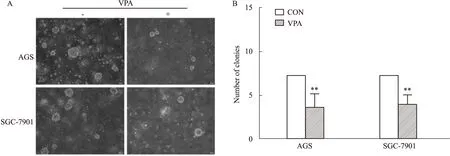
Fig 2 Effect of VPA treatment on anchorage-independent growth of AGS and SGC-7901 cells in
A:Soft agar colony formation assay(×40); B:Quantification of results.**P<0.01vscontrol group.
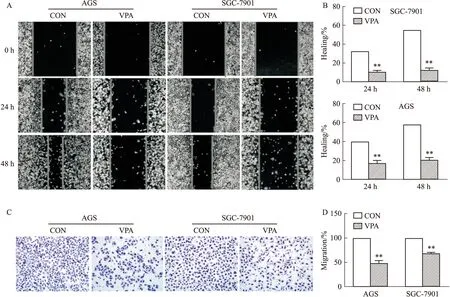
Fig 3 Effect of treatment with VPA on migration of AGS and SGC-7901 cells determined by
A:Scratch wound-healing assay(×40); B:Quantification of results; C:Transwell assay(×200); D:Quantification of results.**P<0.01vscontrol group.
2.5 VPA抑制GSK3β/β-catenin信号轴的激活通过STITCH数据库筛选出与VPA存在靶向关系的蛋白(Fig 5),其中包括影响肿瘤细胞分化、增殖及转移的关键蛋白——GSK3β。通过STRING和Enrichr数据库对GSK3β进行了GO分析和KEGG通路分析,结果显示GSK3β在胃癌中主要与Wnt信号通路存在信号转导关系,同时与Wnt信号通路的关键蛋白β-catenin存在结合关系。Western blot实验结果显示,与对照组相比,VPA用药组其p-GSK3βser9和β-catenin均明显下调,且差异具有统计学意义(P<0.01),提示VPA抑制GSK3β/β-catenin信号轴的激活。
3 讨论
人体内组蛋白的乙酰化和去乙酰化平衡动态调节着基因的稳定性[7]。目前的研究显示,组蛋白乙酰化的失衡与肿瘤的发生发展密切相关[8]。当组蛋白呈过度去乙酰化态时,可下调抑癌基因的表达、激活/上调原癌基因的过表达,从而推进肿瘤的发生发展。因此,增强组蛋白乙酰化酶(histone acetylene transferase,HAT)的作用和(或)降低HDACs的作用一直是表观遗传学抗肿瘤研究的重要方向之一。本研究中使用的VPA为Ⅰ类和Ⅱ类HDAC(HDAC6和HDAC10除外)的抑制剂[9],可使诱导组蛋白H3 和H4的氨基末端发生超乙酰化,从而发挥抗肿瘤作用[10-11]。
在本研究中,我们通过MTT法检测了VPA对胃癌细胞AGS、SGC-7901、MGC-803和BGC-823增殖活性的影响。结果显示,VPA可以显著抑制这4种细胞的增殖活性,且呈剂量和时间依赖性,表明VPA对于胃癌细胞的药物作用具有较强的广谱性。选用对VPA较为敏感的AGS和SGC-7901细胞作为实验对象后,进一步的软琼脂克隆形成实验的结果显示,VPA可以抑制AGS和SGC-7901细胞的锚定非依赖性增殖能力,提示VPA可以从细胞活性和细胞数量这两个方面抑制胃癌细胞的增殖能力。这一结果与Zhang等[12]的研究结果相一致。
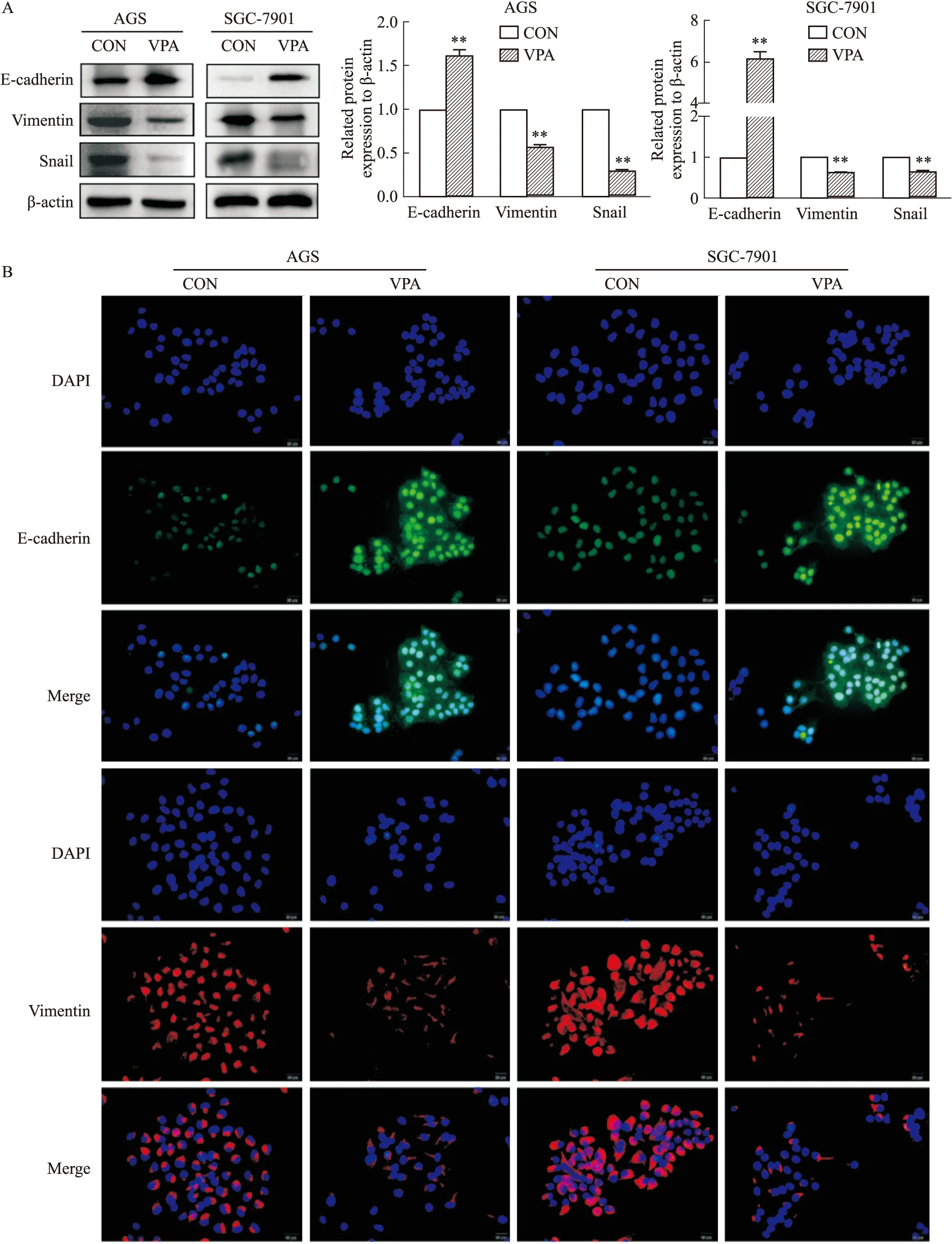
Fig 4 EMT progression of AGS and SGC-7901 cells suppressed
A:Expression of E-cadherin, Vimentin and Snail was detected in VPA-treated AGS and SGC-7901 cells by Western blot. β-actin was set as loading control; B:Expression of E-cadherin and Vimentin in VPA-treated AGS and SGC-7901 cells was detected by immunofluorescence staining(×400).**P<0.01vscontrol group.

Fig 5 Blockade of GSK3β/β-catenin signal axis by VPA in AGS and SGC-7901
A-C:Network of VPA-GSK3β/β-catenin interactions in STITCH database, STRING database and Enrichr database; B:Expression of p-GSK3βser9and β-catenin was detected in VPA-treated AGS and SGC-7901 cells by Western blot. β-actin was set as loading control.**P<0.01vscontrol group.
大量研究证实,Wnt/β-catenin信号通路的激活不仅参与肿瘤的形成,也参与EMT进程的启动。GSK3β作为β-catenin上游重要的负性调控因子,其失活与β-catenin的表达呈正相关。而GSK3β的活性主要受磷酸化位点的调控。当GSK3β的N-端丝氨酸9位点(Ser9)发生磷酸化时,其活性受到抑制;当GSK3β的N-端酪氨酸216位点(Tyr 216)发生磷酸化,则可增强GSK3β的活性。在本研究中,通过STITCH、STRING和Enrichr数据库发现,VPA与GSK3β/β-catenin信号轴存在显著相关性。Western blot实验结果也证实,VPA可以抑制GSK3β/β-catenin信号轴的激活,提示GSK3β/β-catenin信号轴参与了VPA对胃癌细胞增殖和迁移功能的调控。
综上,VPA可有效抑制胃癌细胞的增殖和迁移,其机制可能与抑制GSK3β/β-catenin信号轴的激活及逆转EMT的进程有关。
(致谢:本实验是在吉林省科技厅重点实验室、延边大学肿瘤研究中心分子病理实验室完成,感谢实验室各位老师的指导与帮助。)

