柚皮苷改善CCL2所致大鼠学习记忆障碍及其机制
龙江宜,陈健民,廖苑君,周怡俊,梁冰玉,周 燕
(广西医科大学1.药学院、2. 广西艾滋病防治研究重点实验室,广西 南宁 530021)
CC类趋化因子配体2(chemokine CC motif ligand 2,CCL2),又称为单核细胞趋化蛋白-1 (monocyte chemoattractant protein -1,MCP-1) ,是CC类趋化因子家族的重要成员。CCL2作为趋化作用最强的因子之一,对单核吞噬细胞、活化的T细胞和B细胞具有强大的激活和募集作用。此外,研究发现,CCL2在中枢神经系统(central nervous system,CNS)中扮演着重要的角色。生理条件下,CCL2能维持神经元的正常活性,并参与神经元通讯交流等生理功能[1]。然而,过表达的CCL2参与了多种CNS疾病发生的病理生理过程。研究发现,在阿尔茨海默症(Alzheimer’s disease,AD)、血管性痴呆(vascular dementia,VD)和艾滋性认知功能障碍(HIV-associatedneurocognitive disorder,HAND)等患者的脑脊液中均检测到CCL2的高水平表达,而这些患者均伴随有不同程度的认知功能障碍[1, 2],表明CCL2与中枢神经系统疾病的发生密切相关。
氧化应激、炎症反应、兴奋性毒性以及细胞凋亡是中枢神经系统疾病的主要发病机制,我们的前期研究发现CCL2通过过度激活N-甲基-D-天冬酰胺受体(N-methyl-D-aspartate receptors, NMDAR)能损伤大鼠的学习记忆和认知功能,其机制与上述四条途径均有联系。因此,我们认为CCL2作为诱导认知功能障碍等神经退行性疾病的重要致病因子,针对CCL2触发认知障碍的机制有抑制或者阻断作用的药物将在治疗认知功能障碍或者提高学习记忆力方面展现出良好的临床运用前景,但目前在神经药理领域关于对抗CCL2效应及作用的药物研究还十分有限。
柚皮苷(naringin)是一种存在于葡萄柚和其他柑橘类水果中的黄酮类化合物,具有抗炎、抗氧化应激、调节糖脂代谢和保护心肌等多种生物学保护作用,能通过调节氧化应激和炎症反应对心血管疾病、糖尿病的治疗及神经变性的预防起到良好作用[3, 4]。有研究发现,柚皮苷能下调动脉粥样硬化和炎症反应中CCL2的表达,起到抗动脉粥样硬化和抗炎作用[5]。此外,柚皮苷能够增强人类免疫缺陷病毒(human immunodeficiency virus,HIV)膜糖蛋白120(glycoprotein 120,gp120)诱导艾滋性认知功能障碍的大鼠学习记忆能力,改善其认知功能障碍[6]。而关于柚皮苷是否能对抗CCL2诱发的认知功能障碍还尚未可知,故本文通过脑部立体注射将CCL2注射至双侧海马脑区,制作认知功能障碍大鼠模型,预防性3 d给予柚皮苷,利用Morris水迷宫(Morris water maze,MWM)评价柚皮苷对CCL2诱发的认知功能障碍模型大鼠学习记忆能力的影响,并从形态学、氧化应激、细胞凋亡三个方面评价其保护机制。
1 材料与方法
1.1 试剂与仪器CCL2(R&D systems,批号:279-MC/CF),柚皮苷(Sigma公司;批号BCBT3477),美金刚(memantine,批号:M9292),caspase-8、caspase-3、Bax、Bcl-2、GAPDH引物(上海捷瑞生物工程有限公司);AxyPrep总RNA制备试剂盒(康宁生命科学有限公司,批号:07418KD1);逆转录试剂盒(TaKaRa,批号:RR047A);SYBR荧光染料扩增试剂盒(TaKaRa,批号:RR820A);超氧化物歧化酶(superoxide dismutas,SOD)试剂盒(南京建成生物工程所,批号:20181121);丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程所,批号:20181029);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒(南京建成生物工程所,批号:20181116)BCA蛋白浓度测定试剂盒(碧云天,批号:P0010S)。脑立体定位仪(深圳瑞沃德生命科技有限公司,型号C9S02-003);手型颅骨钻(深圳瑞沃德生命科技有限公司,型号68605);10 μL Hamilton微量注射器(Hamilton公司,型号:701N);Morris水迷宫实验装置及分析系统(淮北正华生物仪器设备有限公司)
1.2 实验动物分组及处理56只SPF级♂SD大鼠,体质量(180±20)g,购自于广西医科大学实验动物中心,实验动物生产许可证:SCXK桂2014-0002,实验动物使用许可证:SCXK桂2014-0003。适应性喂养1周,允许自由摄食饮水。SD大鼠随机分为7组:空白对照组(control)、假手术组(sham)、模型组(5 ng CCL2)组、阳性药组(5 ng CCL2+10 mg·kg-1memantine)、柚皮苷低剂量组(5 ng CCL2+25 mg·kg-1柚皮苷)、柚皮苷中剂量组(5 ng CCL2+50 mg·kg-1柚皮苷)和柚皮苷高剂量组(5 ng CCL2+100 mg·kg-1柚皮苷),每组8只。除空白对照组外,其余各组均进行双侧海马内注射制作动物模型,阳性药美金刚(memantine)及各剂量柚皮苷组于造模前3 d腹腔注射(ip),d 3药物注射后的30 min后进行脑部立体定位手术。
1.3 模型制备配制1%的戊巴比妥钠溶液,按45 mg·kg-1剂量腹腔注射麻醉。待动物麻醉后,颅顶区常规备皮,碘伏消毒。参照大鼠脑立体定位图谱,以前囟为原点,按AP=-3.7 mm、ML=±3.0 mm、DV=-3.0 mm的坐标位置进行海马区注射,注射速度为0.3 μL·min-1,每侧注射体积为2.5 μL,注射完成后停针5 min避免药物外漏,随后缓慢提针。注射完成后缝合皮肤,并注射青霉素(30万单位·kg-1)防止感染。假手术组给予等量无菌生理盐水。
1.4 Morris水迷宫实验Morris水迷宫试验主要通过Morris水迷宫分析系统完成,包括一个圆形水池、视频采集系统、软件分析系统。水池直径160 cm,高60 cm,实验时在水池内注入自来水,水深42 cm,水温(22±1) ℃。将水池池壁分为四等份,分别记为E、S、W及N四个象限,在每个象限的池壁部分中心放置大小相近,不同形状的白色标记物,用于帮助大鼠空间定位。在象限S的中心处放置一个位于水下2 cm、直径为12 cm、高40 cm的水下平台。在实验过程中平台位置不变。
大鼠术后3 d开始进行Morris水迷宫实验,通过Morris水迷宫试验评测SD大鼠学习和空间记忆能力。参照以往方法[7]进行。Morris水迷宫试验包括定位航行试验(D4~D8)和空间探索试验(D9)两部分。在定位航行试验前1 d(D3)即术后d 3对大鼠进行适应性训练。即将大鼠从任一入水点放入水中,自由游泳1 min。定位航行试验着重检测大鼠的学习能力,其评价指标包括逃避潜伏期、游泳速度及游泳距离;空间探索试验在定位航行试验后24 h进行,主要用于评价大鼠的空间记忆力,其评价指标为大鼠穿过原水下平台位置的次数,即穿越次数。
1.5 HE染色水迷宫实验后,每组4只大鼠心脏灌注后取全脑石蜡包埋切片进行HE染色,以探究CCL2是否对大鼠海马神经元CA1区造成损伤。HE按照常规方案进行,5~7 μm纵切片,二甲苯脱蜡苏木素-伊红染色。后用中性树脂密封,使用Olympus BX53显微镜拍摄。
1.6 SOD、GSH-Px活力以及MDA含量检测Morris水迷宫实验后将各组大鼠于冰上迅速断头取脑,分离海马组织。取每组4只大鼠的一侧海马用于氧化应激指标检测。冰上研磨海马组织制备10%的海马匀浆,BCA法检测各样本蛋白总浓度,试剂盒检测SOD、GSH-PX活力以及MDA含量。
1.7 凋亡基因caspase-8、caspase-3、Bax以及Bcl-2基因表达检测上述大鼠的另一侧海马用于凋亡相关基因检测。按柱式RNA提取试剂盒的说明提取总RNA,微量核酸蛋白浓度测定仪检测各样本RNA的浓度及吸光度。按逆转录试剂盒的说明将RNA逆转录成cDNA,按扩增试剂盒的说明对目的基因进行扩增,获得各目的基因的扩增曲线和熔解曲线,记录各基因的Ct值,以GAPDH为内参基因,2-ΔΔCt法计算结果,引物序列见Tab 1。


Tab 1 Primers’ sequence of target genes
2 结果
2.1 柚皮苷对大鼠学习能力的保护作用结果如Tab 2,Fig 2和Fig 3,Fig 4所示,各组大鼠平均游泳速度差异均无统计学意义,说明各组大鼠运动能力一致,并且脑部立体定位手术对大鼠运动能力没有明显影响。与假手术组相比,模型组大鼠逃避潜伏期增加(P<0.01);与模型组大鼠相比,柚皮苷给药组大鼠逃避潜伏期及游泳总路程均缩短(P<0.01)。Fig 1显示的是定位航行实验d 5各组大鼠的游泳轨迹。

Tab 2 Results of swimming speed, escape time and swimming distance of rats in each group
**P<0.01vsmodel;##P<0.01vssham
2.2 柚皮苷对大鼠空间记忆的保护作用结果如Tab 3,Fig 5所示,与假手术组相比,模型组大鼠组穿越平台次数减少(P<0.01);与模型组相比,柚皮苷给药组大鼠穿越平台次数增加(P<0.05)。
2.3 柚皮苷对大鼠的海马CA1区神经元结构的保护作用结果如Fig 6所示,与空白组和假手术组相比,模型组大鼠海马组织CA1区神经元排列松散,胞体固缩,细胞核深染,出现大量鬼影细胞;与模型组相比,各柚皮苷给药组,尤其是中、高剂量组大鼠海马组织CA1区神经元排列相对紧密,核深染和固缩的细胞数目较少。
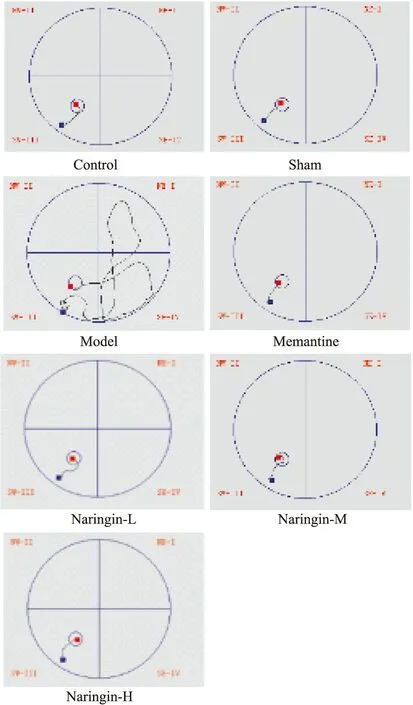
Fig 1 Typical swimming path of rats in navigation test on 5th training day
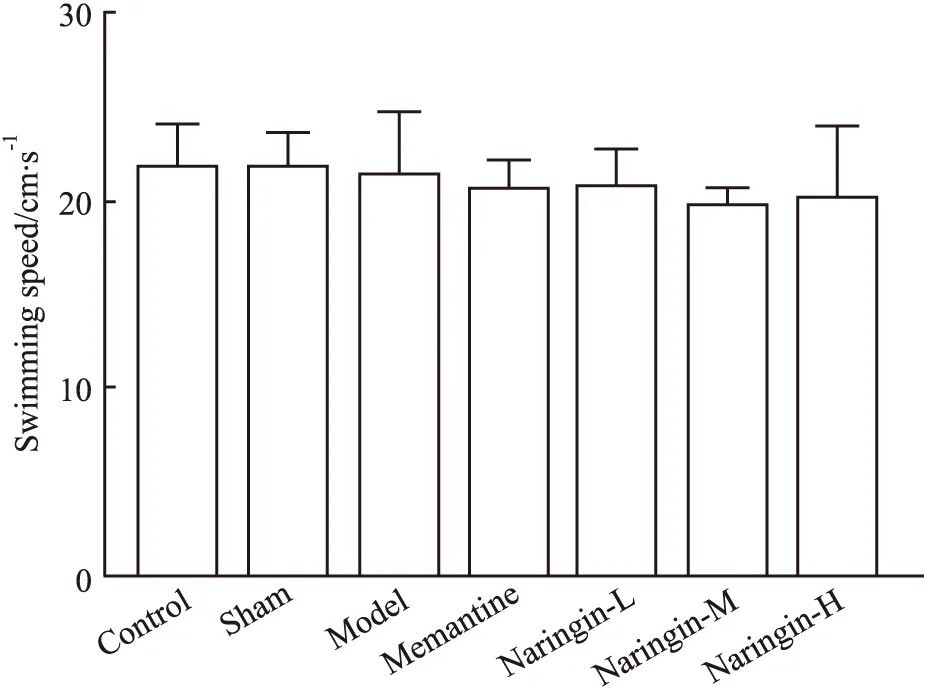
Fig 2 Swimming speed of rats in each

Tab 3 Results of crossing times of rats in each group
*P<0.05,**P<0.01vsmodel;#P<0.05vssham
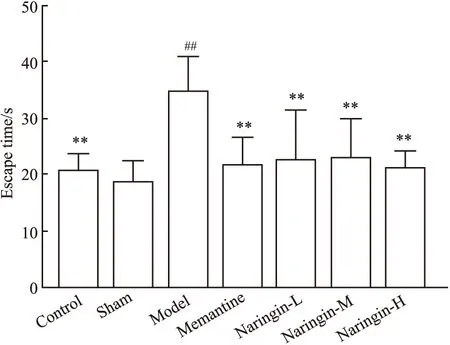
Fig 3 Escape latency of rats in each
**P<0.01vsmodel;##P<0.01vssham
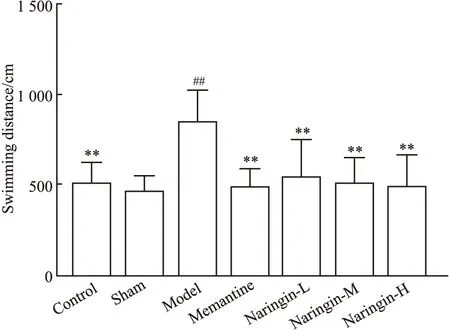
Fig 4 Swimming distance of rats in each
**P<0.01vsmodel;##P<0.01vssham
*P<0.05,**P<0.01vsmodel;#P<0.05vssham
2.4 柚皮苷对大鼠海马组织SOD、MDA、GSH-PX的影响结果如Tab 4,Fig 7所示,与假手术相比,模型组大鼠海马组织SOD、GSH-PX活力均降低,MDA含量增加(P<0.05);与模型组相比,柚皮苷给药组海马组织SOD、GSH-PX活力均升高,MDA含量降低(P<0.05)。
Fig 6 Neuronal structure of hippocampal CA1 area in rats among groups(×20)
2.5 柚皮苷对大鼠海马组织caspase-3、caspase-8、Bax、Bcl-2 mRNA表达的影响结果如Table 5,Fig 8所示,与假手术组相比,模型组大鼠海马组织caspase-3、caspase-8、Bax mRNA相对表达量增加(P<0.05),Bcl-2mRNA表达量降低(P<0.05);与模型组相比,柚皮苷给药组大鼠海马组织caspase-3、caspase-8、Bax mRNA的相对表达量降低(P<0.05),Bcl-2相对表达量升高(P<0.05)。
3 讨论
趋化因子CCL2,也称为MCP-1,属于CC类趋化因子家族,是趋化活性最强的趋化因子之一[8]。
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vssham
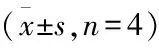
Tab 4 Results of SOD activity, MDA content, GSH-PX activity in hippocampus of rats in each group
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vssham
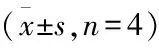
Tab 5 Relative expression of caspase-8, caspase-3, Bcl-2 and Bax mRNA in rat hippocampus
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vssham
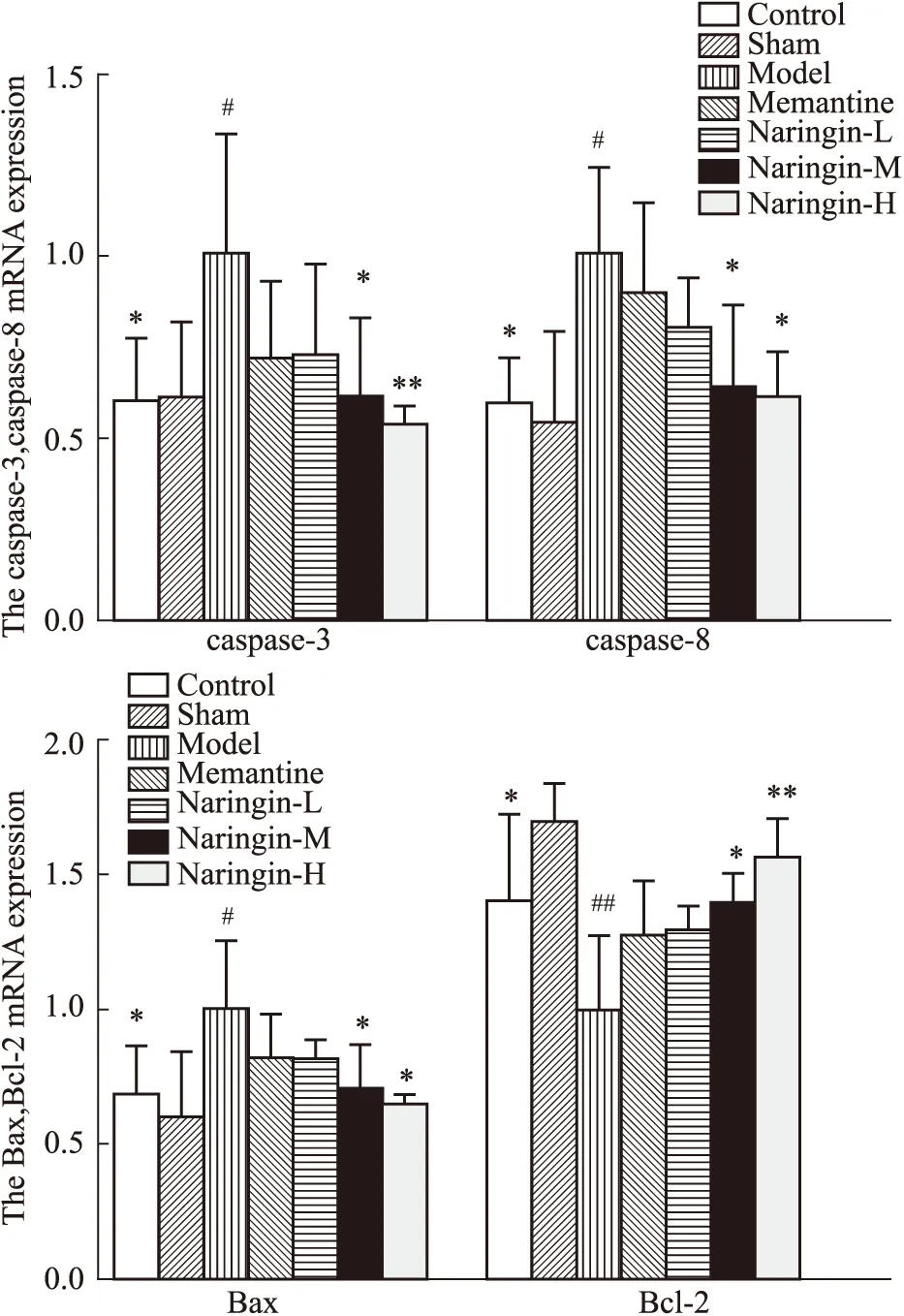
Fig 8 Relative expression of caspase-3, caspase-8, Bax and Bcl-2mRNA in rat hippocampus
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vssham
研究发现,异常高表达的CCL2参与多种神经系统疾病如缺血性脑卒中,创伤性脑外伤以及神经退行性疾病的病理生理过程。大脑中激活状态的小胶质细胞和星型胶质细胞能释放CCL2,通过促炎性反应上调炎症介质IL-1β、TNF-α的表达,从而介导炎症反应,损伤神经元[8]。除参与炎症反应外,课题组前期研究发现,CCL2能通过诱导海马区氧化应激和兴奋性毒性,并最终促进海马区细胞凋亡,导致大鼠学习记忆和认知功能的减退,这一现象与临床数据相吻合。研究人员从AD、VD以及HAND等疾病[4]患者的脑脊液中检测到高水平表达的CCL2,且其表达水平与患者出现的认知障碍程度呈现正相关性[1, 2, 9],表明CCL2在中枢神经系统疾病的发病过程中扮演了十分重要的角色。
目前针对CCL2为治疗靶点的中枢神经系统治疗药物的研究十分有限。因此本课题组拟在前期对CCL2中枢致病机制研究的基础上以期寻找一些能对抗CCL2的潜在治疗药物。柚皮苷(naringin)是一种天然存在于葡萄柚和其他柑橘类水果中的黄酮类化合物,被证明具有抗炎、抗氧化、调查糖脂代谢和保护心肌等多种生物学功效[4, 6, 10]。此外,研究发现柚皮苷能下调动脉粥样硬化中炎症因子CCL2的表达[5],起到血管内皮细胞保护作用。因此,我们设计实验研究柚皮苷是否能在神经系统对CCL2诱导的学习记忆损伤有保护作用。
Morris水迷宫实验是行为神经科学研究中最长用的研究工具之一,常用于验证啮齿类动物神经认知疾病模型,评估神经认知功能治疗的可行性。我们的前期研究已经证实:CCL2双侧海马注射能成功制作认知功能障碍大鼠模型,通过Morris水迷宫实验可以确定模型组大鼠的学习记忆能力受到显著损伤[7],本研究进一步在此认知功能障碍大鼠模型上,探究柚皮苷能否改善大鼠的学习记忆力。经典的Morris水迷宫实验由定位航行实验和空间探索实验两部分组成,前者着重检测啮齿动物的学习能力,后者主要用于检测动物记忆的维持能力。我们的研究结果表明:(1)在定位航行试验中,各组大鼠游泳速度均无明显差异,表明我们的手术未对大鼠的运动能力造成影响。在预防性给予柚皮苷给药3 d后,柚皮苷给药组大鼠逃避潜伏期和游泳路程较模型组均显著降低,表明柚皮苷能够对CCL2损伤大鼠的学习能力起到保护作用。(2)在空间探索实验中各柚皮苷给药组穿越次数显著高于模型组,显示出良好的对大鼠空间记忆保护能力。两部分实验结果具有高度一致性,表明柚皮苷能很好的保护由CCL2海马注射诱发的大鼠学习记忆力损伤。
海马是与学习记忆密切相关的脑区之一,主要参与近期陈述性记忆和情景记忆的形成,其功能的完整性依赖于海马神经元结构和功能的完整。故在上述行为学实验结束后,我们利用HE染色观察各组大鼠海马区神经元结构。HE结果显示模型组大鼠海马组织CA1区神经元条带浅薄且排列松散,出现神经元胞质深染,胞体缩小变形;柚皮苷给药后,各组大鼠,尤其是中高剂量大鼠海马组织CA1区神经元排列相对整齐,细胞结构相对清晰,表明柚皮苷对CCL2诱导的海马神经元结构损伤具有良好保护作用,与上述行为学结果一致。
氧化应激是导致学习记忆和认知障碍的原因之一,在痴呆发生的早期扮演重要的作用[11]。正常情况下,机体内的氧化-抗氧化系统维持相对动态平衡的状态,过多的反应活性氧簇(reactive oxygen species,ROS)会被自身的抗氧化酶SOD、GSH-PX清除,但当氧化程度超过自身清除能力的时候,氧化平衡将被打破,导致神经组织氧化应激损伤最终引起学习记忆和认知功能受损。SOD是一种内源性抗氧化酶,是机体清除超氧阴离子等自由基的重要物质,超氧阴离子存在机体多个组织中,性质活波,与羟基结合后可形成损害细胞的物质,SOD可阻断并对抗氧自由基对组织细胞的损害。此外,GSH-PX是机体广泛存在的另一种重要的催化过氧化氢分解的酶。它特异性的催化还原性谷胱甘肽(glutathione,GSH)对过氧化氢的还原反应,清除体内自由基、脂质过氧化物并能防止血红蛋白及其他辅因子受氧化损伤。MDA是脂质过氧化物的主要代谢产物,主要是由于ROS攻击细胞膜产生,能间接反映神经细胞的损伤程度。我们前期研究发现CCL2能降低海马区SOD活力并升高MDA含量,表明CCL2能诱导海马发生氧化应激[7]。据报道,柚皮苷通过抗氧化应激改善2型糖尿病大鼠认知缺陷[4],说明柚皮苷具有一定的抗氧化作用。但是,柚皮苷是否能对抗中枢神经系统CCL2引起的氧化应激反应尚未可知。本研究表明,柚皮苷能提高中枢海马组织SOD和GSH-PX两种抗氧化酶的活性,并减低脂质过氧化物产物MDA的含量,起到明显抗氧化作用,说明在CCL2诱导的认知功能障碍模型大鼠上,柚皮苷的神经保护作用与抗氧化效应密切相关。
细胞凋亡是机体内清除老化、坏死的细胞结构,为维持内环境稳态的细胞的程序性死亡,有利于保证机体的正常生理功能。然而,在如氧化应激等条件刺激下,凋亡的异常发生往往参与了神经退行性疾病的病理生理过程[12]。本研究中,我们发现在模型组大鼠海马CA1区神经元出现明显的细胞死亡现象,而用柚皮苷干预后能明显改善其神经元的形态结构损伤,显示出了一定的神经保护作用。课题组前期研究发现CCL2能通过诱导海马区氧化应激上调促凋亡基因caspase-8、caspase-3、Bax的表达,下调抗凋亡基因Bcl-2的表达诱导海马神经元凋亡[7]。本研究在前期研究基础上,进一步探讨柚皮苷的抗凋亡作用。我们的实验结果显示,柚皮苷能通过下调促凋亡基因caspase-8、caspase-3以及Bax的表达,上调抗凋亡基因Bcl-2的表达,在CCL2诱导的认知功能障碍模型大鼠上发挥良好的抗凋亡效应。
综上,本研究发现柚皮苷能对抗CCL2引起的神经元结构损伤,改善CCL2诱导的学习记忆损害和认知障碍,其神经保护机制主要是通过降低CCL2诱导的海马氧化应激反应,抑制caspase-8,caspase-3凋亡通路,并下调促凋亡基因Bax,上调抗凋亡基因Bcl-2而发挥抗凋亡效应,保护神经元,并最终改善学习记忆力。
(致谢:本文中水迷宫实验在广西医科大学公共卫生学院完成,试剂盒、RT-PCR在广西医科大学医学实验中心细胞与免疫实验室完成。感谢各位老师和同学给予的帮助。)

