白细胞介素-12抗NK/T细胞淋巴瘤的活性及其机制研究
王 媛,惠 双,张成辉,郭宏强,李 敏,郑芝欣
(1.南阳市中心医院肿瘤内科,河南 南阳 473000; 2.郑州大学第一附属医院肿瘤综合病区,河南 郑州 450000;3. 南阳市中心医院药学室,河南 南阳 473000)
NK/T细胞淋巴瘤属于非霍奇金淋巴瘤,多起源于结节外部位。结节外NK/T细胞淋巴瘤在亚洲、尤其是中国南方及东南亚地区发病率较高[1]。NK/T细胞淋巴瘤的具有浸润性生长的特征,病灶内肿瘤细胞增殖、凋亡及细胞周期的异常与该病理特征密切相关[2-3],但具体的发病机制尚未完全阐明。传统治疗侵袭性非霍奇金淋巴瘤的CHOP方案用于NK/T细胞淋巴瘤治疗的效果较差,即使能够获得短暂缓解、随后的复发率也较高,目前临床上仍缺乏有效的靶向治疗NK/T细胞淋巴瘤的手段[4]。
白细胞介素-12(interleukin-12,IL-12)是体内重要的免疫活性细胞因子,能够促进Th1细胞、NK细胞等免疫细胞的分化及相应细胞因子的分泌,已经在肺癌、乳腺癌、肝癌等恶性肿瘤细胞中被证实具有抗癌作用[5-7]。在不同类型的淋巴瘤患者中,血清IL-12含量的改变与预后不佳密切相关[8]。为了明确IL-12在NK/T细胞淋巴瘤中的治疗价值,本实验以NK/T细胞淋巴瘤细胞株YTS为对象,通过细胞实验及移植瘤动物实验分析了IL-12调控YTS细胞的细胞活力、细胞周期、细胞凋亡的作用及机制。
1 材料与方法
1.1 材料
1.1.1细胞株 NK/T细胞淋巴瘤细胞株YTS,购自中科院上海细胞资源中心。
1.1.2动物 SPF级的C57小鼠、♂、(18~20) g购自上海杰思捷实验动物有限公司,许可证号:生产许可SCXK(沪)2018-0004。饲养环境温度(18~23) ℃、适度45%~55%、自由饮水摄食。
1.1.3试剂 IL-12(批号:SRP3204)购自Sigma公司,DMEM培养基、胰蛋白酶、胎牛血清购自Gibco公司,阴性对照(NC)siRNA、JAK2 siRNA购自上海吉玛公司,空白的pcDNA3.1质粒、表达JAK2的pcDNA3.1质粒购自上海生工公司,MTS细胞活力检测试剂盒(批号:G3580)购自Promega公司,Annexin V/PI凋亡试剂盒(批号:C1062)、RIPA裂解液(批号:P0013)购自上海碧云天公司,结晶紫购自Sigma公司,JAK2(批号:3230)、p-JAK2(批号:3771)、STAT3(批号:9139)、p-STAT3(批号:9145)的单克隆抗体购自CST公司,β-actin(批号:ab179467)的单克隆抗体购自Abcam公司。
1.1.4仪器 细胞培养基购自Thermo公司,正置显微镜及倒置显微镜购自Olympus公司,电泳系统及化学显影仪购自上海天能公司。
1.2 方法
1.2.1细胞培养及分组 YTS细胞用含有10%胎牛血清的DMEM贴壁培养,细胞铺满90%后用胰蛋白酶进行消化、传代,传代后的细胞继续扩增培养,得到足够数量的细胞后进行分组。对照组用不含药物的DMEM处理,IL-12组用含有不同浓度IL-12(0.625、1.25、2.5、5.0、10.0、20.0 ng·mL-1)的DMEM处理,NC siRNA组转染NC siRNA,JAK2 siRNA组转染JAK2 siRNA,空白质粒组转染空白的pcDNA3.1质粒,20.0 μg·L-1IL-12+空白质粒组用含有20.0 μg·L-1IL-12的DMEM处理并转染空白的pcDNA3.1质粒,20.0 μg·L-1IL-12+JAK2表达质粒组用含有20.0 μg·L-1IL-12的DMEM处理并转染表达JAK2的pcDNA3.1质粒。连续处理24小时。
1.2.2移植瘤小鼠模型建立及分组 取传代的YTS细胞、制备浓度为5×107个/mL的细胞悬液,将0.2 mL细胞悬液接种在右侧腋窝皮下,7天后扪及米粒大小的肿瘤、提示移植瘤小鼠制备成功,共12只小鼠进行移植瘤制备、制备成功率100%。移植瘤小鼠随机分为对照组、IL-12组,每组各6只。参照Chi[9]的研究,皮下注射YTS细胞后d 7、9、12、15、19、25时,IL-12组分别给予1 500 U重组人IL-12瘤内注射,第35天时处死、解剖移植瘤并称重,而后将移植瘤用液氮冷冻、-80 ℃保存。
1.2.3细胞活力检测 在96孔板内接种YTS细胞,按照分组及给药方法分为对照组、IL-12组、NC siRNA组、JAK2 siRNA组、空白质粒组、20.0 μg·L-1IL-12+空白质粒组、20.0 μg·L-1IL-12+JAK2表达质粒组并进行处理,处理24 h后,向每个培养孔内加入20 μL MTS试剂盒的检测液,培养箱中继续孵育4 h后取出培养板,震荡后在酶标仪上测定570 nm波长的吸光值、记为OD570。
1.2.4细胞周期检测 在6孔板内接种YTS细胞,按照分组及给药方法分为对照组、IL-12组、NC siRNA组、JAK2 siRNA组、空白质粒组、20.0 μg·L-1IL-12+空白质粒组、20.0 μg·L-1IL-12+JAK2表达质粒组并进行处理,处理24 h后,用70%乙醇固定细胞过夜,第二天用50 mg·L-1的碘化丙啶、0.1% Triton X-100避光孵育细胞30 min,最后在流式细胞仪上检测细胞周期。
1.2.5细胞凋亡检测 按照1.2.3的方法收集细胞并固定过夜,用Annexin V/PI凋亡试剂盒中的检测液避光孵育15 min,在流式细胞仪上检测细胞凋亡率。
1.2.6Western blot检测 在12孔板内接种YTS细胞并分组处理24 h,收集细胞并加入RIPA裂解液提取蛋白,在SDS-PAGE凝胶中进行电泳、电转移至NC膜,5%脱脂牛奶室温封闭2 h后加入1 ∶1 000稀释的p-JAK2、JAK2、p-STAT3、STAT3一抗或1 ∶5 000稀释的β-actin一抗,4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的二抗并在室温孵育1 h,洗膜后加入显影液、在化学显影仪中曝光得到蛋白条带,用ImageJ软件扫描条带灰度值,以β-actin为内参、计算蛋白表达水平。
1.2.7统计学方法 数据以均数±标准差表示,采用SPSS20.0软件对组间数据进行方差分析。
2 结果
2.1 IL-12对YTS细胞活力、细胞周期及细胞凋亡的影响为了研究IL-12的抗NK/T细胞淋巴瘤活性,本实验培养了YTS细胞并用不同浓度的IL-12进行干预。如Fig 1A所示,与对照组比较,0.625 μg·L-1、1.25 μg·L-1IL-12干预后的细胞活力OD570值无显著变化(P>0.05),2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1IL-12干预后的细胞活力OD570值显著减低(P<0.05),说明2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1的IL-12能够抑制YTS细胞的生长,后续选用2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1的IL-12继续进行实验。
细胞周期和细胞凋亡是与细胞生长活力密切相关的生物学环节,YTS细胞的细胞周期及细胞凋亡检测如Fig 1B和1C所示:2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1IL-12干预后,YTS细胞中G0/G1期比例以及凋亡率均显著升高(P<0.05)、S期比例显著降低(P<0.05)、G2/M期比例无显著变化(P>0.05),说明IL-12能够使YTS细胞的细胞周期停滞、促进YTS细胞的凋亡。
2.2 IL-12对YTS细胞中JAK2/STAT3通路的影响JAK2/STAT3通路是调节细胞活力、细胞周期、细胞凋亡的重要信号通路,为了明确IL-12发挥生物学效应的机制,本实验在不同浓度IL-12干预后、通过Western blot检测了p-JAK2、p-STAT3的表达,结果如Fig 2所示,2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、20.0 μg·L-1IL-12干预后,YTS细胞中p-JAK2、p-STAT3的表达量显著降低(P<0.05),说明IL-12能够抑制YTS细胞中JAK2/STAT3通路的激活。
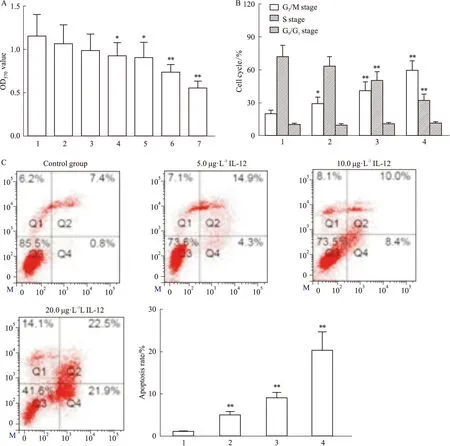
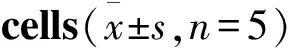
A: IL-12 inhibited the viability of YTS cells(1:Control group; 2: 0.625 μg·L-1IL-12; 3: 1.25 μg·L-1IL-12; 4: 2.5 μg·L-1IL-12; 5: 5.0 μg·L-1IL-12; 6: 10.0 μg·L-1IL-12; 7: 20.0 μg·L-1IL-12); B: IL-12 inhibited the cell cycle of YTS cells(1:Control group; 2: 5.0 μg·L-1IL-12; 3: 10.0 μg·L-1IL-12; 4: 20.0 μg·L-1IL-12); C: IL-12 induced the apoptosis of YTS cells.*P<0.05,**P<0.01vscontrol group
2.3 转染JAK2 siRNA对YTS细胞活力、细胞周期及细胞凋亡的影响IL-12能够抑制YTS细胞中JAK2/STAT3通路的激活,为了验证JAK2/STAT3通路受抑制后是否影响YTS细胞的细胞活力、细胞周期及细胞凋亡,本使用通过转染JAK2 siRNA的方式来抑制JAK2的表达,结果如Fig 3A及3B所示,转染JAK2 siRNA后YTS细胞中JAK2、STAT3、p-JAK2、p-STAT3。
在转染JAK2 siRNA、抑制JAK2及STAT3的表达后,本实验检测了细胞活力、细胞周期及细胞凋亡,结果如Fig 3C、3D所示,与对照组及NC siRNA组比较,JAK2 siRNA组的细胞活力OD570值、S期比例显著减低(P<0.05),G0/G1期比例、凋亡率均显著升高(P<0.05),G2/M期比例无显著变化(P>0.05),说明抑制JAK2的表达能够使YTS细胞的细胞活力降低、细胞周期停滞、细胞凋亡增强。
2.4 转染JAK2表达质粒对IL-12调节YTS细胞活力、细胞周期及细胞凋亡的影响为了验证JAK2/STAT3通路在IL-12调节YTS细胞活力、细胞周期及细胞凋亡中的作用,本实验在用20.0 μg·L-1IL-12干预的同时转染了JAK2表达质粒。与空白质粒组比较,20.0 μg·L-1IL-12+空白质粒组的p-JAK2、p-STAT3表达量及细胞活力OD570值、S期比例显著减低(P<0.05),G0/G1期比例、凋亡率均显著升高(P<0.05),G2/M期比例无显著变化(P>0.05);与20.0 μg·L-1IL-12+空白质粒组比较,20.0 μg·L-1IL-12+JAK2表达质粒组的p-JAK2、p-STAT3表达量及细胞活力OD570值、S期比例、G2/M期比例显著增加(P<0.05),G0/G1期比例、凋亡率均显著降低(P<0.05)。说明IL-12对YTS细胞活力、细胞周期及细胞凋亡调节作用部分由JAK2/STAT3通路介导。见Fig 4。

Fig 2 Effect of IL-12 on f p-JAK2, p-STAT3 expression in YTS
*P<0.05,**P<0.01vscontrol group
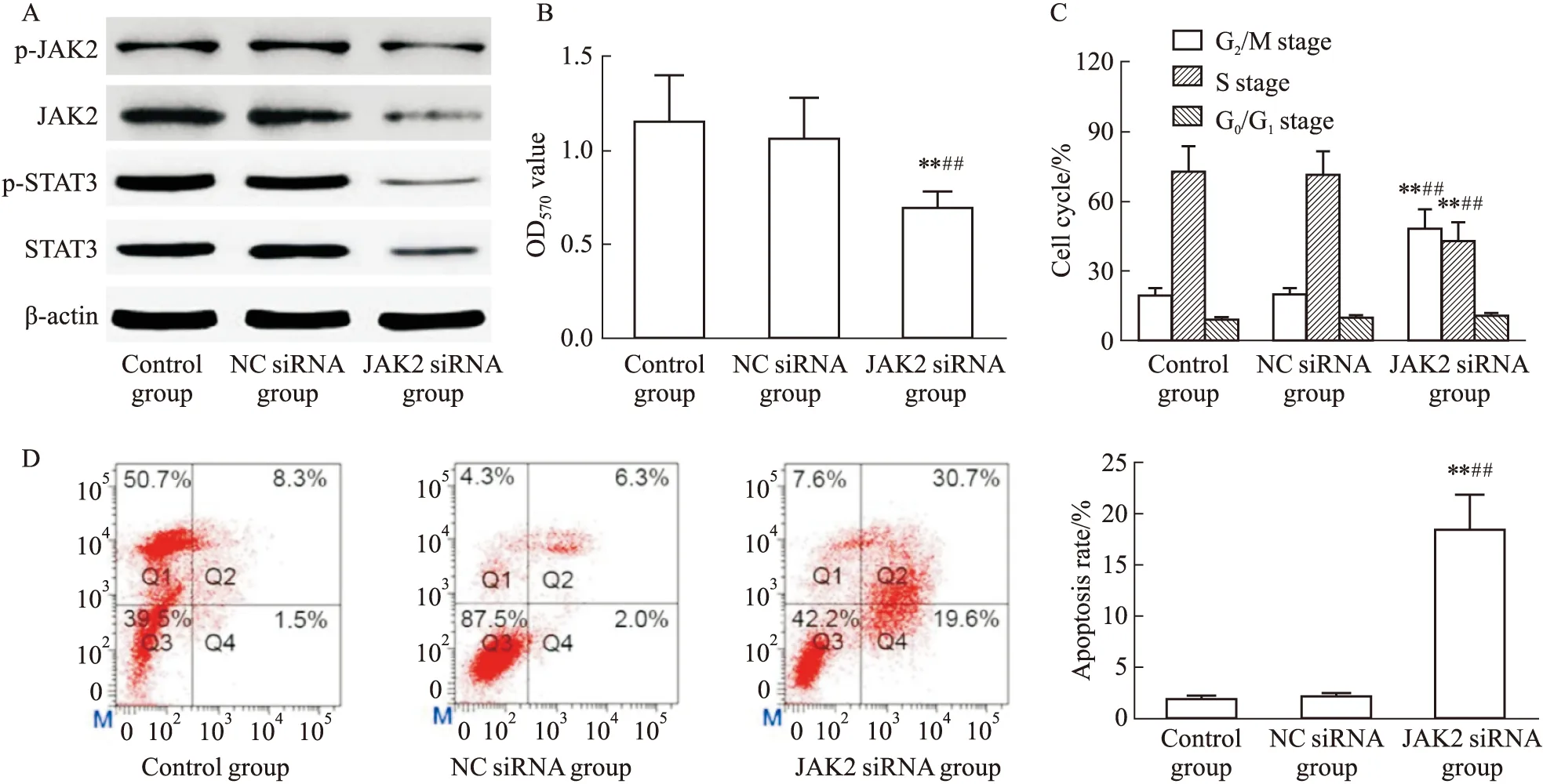
Fig 3 Effect of JAK2 siRNA on viability, cell cycle, apoptosis of YTS
A: Transfection of JAK2 siRNA inhibited the expression of JAK2 and STAT3 in YTS cells; B: Transfection of JAK2 siRNA inhibited the viability of YTS cells; C: Transfection of JAK2 siRNA inhibited the cell cycle of YTS cells; D: Transfection of JAK2 siRNA induced the apoptosis of YTS cells.**P<0.01vscontrol group.##P<0.01vsNC siRNA group
2.5 IL-12对YTS细胞移植瘤生长及JAK2/STAT3通路的影响经细胞实验明确IL-12通过JAK2/STAT3通路调节YTS细胞的细胞活力、细胞周期及细胞凋亡后,本实验通过YTS细胞移植瘤验证了IL-12的抗NK/T细胞淋巴瘤活性。在建立YTS细胞移植瘤小鼠模型后给予IL-12干预,移植瘤质量明显减轻(P<0.05,Fig 5A),移植瘤中p-JAK2、p-STAT3的表达明显减少(P<0.05,Fig 5B)。

Fig 4 Effect of JAK2 expressed plasmid on IL-12 regulating viability, cell cycle, apoptosis of YTS
A: Transfection of JAK2 expressed plasmid attenuated the effect of IL-12 on p-JAK2, p-STAT3 expression in YTS cells; B: Transfection of JAK2 expressed plasmid attenuated the effect of IL-12 on viability of YTS cells; C: Transfection of JAK2 expressed plasmid attenuated the effect of IL-12 on cell cycle of YTS cells; D: Transfection of JAK2 expressed plasmid attenuated the effect of IL-12 on apoptosis of YTS cells.**P<0.01vsblank plasmid group,##P<0.01vs20 μg·L-1IL-12+blank plasmid group.
Fig 5 Effect of IL-12 on weight and JAK2/STAT3 of xenotransplanted
A: IL-12 decreased the weight of xenotransplanted tumor. B: IL-12 inhibited the expression of p-JAK2, p-STAT3 in xenotransplanted tumor.**P<0.01vscontrol group
3 讨论
NK/T细胞淋巴瘤是我国常见的非霍奇金淋巴瘤类型,近年来的发病率呈升高趋势且对传统CHOP化疗方案不敏感,临床治疗效果不佳、预后差[10-11]。近年来,免疫活性细胞因子在恶性肿瘤治疗中的作用受到了越来越多的关注,包括IL-12在内的多种细胞因子不仅能够通过免疫调节作用来增强机体的抗肿瘤免疫应答、发挥抗肿瘤作用,还能直接作用于肿瘤细胞并影响凋亡、增殖、迁移、侵袭等恶性生物学行为,进而发挥抗肿瘤作用。在本实验中,IL-12被用于NK-T细胞淋巴瘤细胞株YTS的干预,0.625、1.25的IL-12干预后,YTS细胞的活力无显著变化;2.5、5.0、10.0、20.0 μg·L-1的IL-12干预后,YTS细胞的活力明显降低且随着IL-12浓度的增加,细胞活力的下降更加明显,说明IL-12能够在一定范围内以浓度依赖性的方式降低YTS细胞的细胞活力、具有抗NK-T细胞淋巴瘤的作用。
为了明确IL-12影响NK-T细胞淋巴瘤细胞活力的可能机制,本实验进一步对IL-12干预后的细胞周期、细胞凋亡等生物学行为进行了分析。细胞周期失控会使细胞大量进入有丝分裂阶段、细胞凋亡受阻则会影响异常分裂细胞的清除,最终引起细胞过度增殖、表现为细胞活力增加;本实验的分析显示,5.0、10.0、20.0 μg·L-1的IL-12干预能够诱导YTS细胞发生凋亡并使细胞周期大量停滞于G0/G1期且IL-12浓度越大,诱导凋亡及细胞周期停滞的效应越显著,说明诱导细胞周期停滞、细胞凋亡是IL-12发挥抗NK-T细胞淋巴瘤作用的可能机制。
JAK2/STAT3通路是参与细胞凋亡、细胞周期调控的信号通路,生长因子是该信号通路重要的上游激活分子,刺激JAK2发生磷酸化后p-JAK2能够引起STAT3发生磷酸化,p-STAT3能够形成二聚体并进入细胞核,进而调节c-myc、CyclinD1、Bcl-2等基因的表达并起到加速细胞周期、抑制细胞凋亡、促进细胞迁移和侵袭[12]。已有研究报道,淋巴瘤组织中JAK2/STAT3通路呈过度活化的状态,p-JAK2及p-STAT3均呈显著高表达的状态[13-14];而使用JAK2/STAT3通路抑制剂AG490处理淋巴瘤细胞后,细胞周期及细胞迁移、侵袭均受到抑制,细胞凋亡则明显增强[15]。本实验在IL-12处理YTS细胞后观察到:IL-12能够以浓度依赖性的方式降低细胞中p-JAK2、p-STAT3的表达,说明IL-12对YTS细胞中JAK2/STAT3通路的活化具有抑制作用。
在此基础上,为了明确IL-12的抗NK-T细胞淋巴瘤作用是否与抑制JAK2/STAT3通路的激活有关,本实验首先通过转染JAK2 siRNA的方式抑制JAK2的表达,在转染JAK2 siRNA后,细胞中p-JAK2、p-STAT3的表达均减少,说明转染JAK2 siRNA能够抑制JAK2/STAT3通路的激活;在抑制JAK2/STAT3通路的激活后,细胞活力、细胞周期均受到抑制,而细胞凋亡明显增强,说明JAK2/STAT3直接参与YTS细胞的细胞活力、细胞周期、细胞凋亡的调控。而后,通过转染JAK2表达质粒的方式增加JAK2的表达,在20 μg·L-1IL-12干预的同时转染JAK2表达质粒能够使IL-12减少p-JAK2、p-STAT3表达的作用发生逆转,同时也能使IL-12调节细胞活力、细胞周期、细胞凋亡的作用也发生逆转。由此证实IL-12的抗NK-T细胞淋巴瘤作用与抑制JAK2/STAT3通路有关。
最后,本实验还通过移植瘤动物实验来验证IL-12的NK-T细胞淋巴瘤作用,通过皮下注射YTS细胞的方式建立移植瘤小鼠模型,给予IL-12干预后观察到移植瘤的质量及移植瘤中p-JAK2、p-STAT3的表达均明显下降,这与IL-12在细胞实验中通过JAK2/STAT3通路抑制细胞活力、细胞周期及诱导细胞凋亡的作用吻合,进一步证实IL-12具有抗NK-T细胞淋巴瘤作用且该作用与抑制JAK2/STAT3通路有关。
综上所述,本实验报道了IL-12的抗NK-T细胞淋巴瘤的作用,IL-12能够以剂量依赖性的方式降低细胞活力、诱导细胞周期阻滞及细胞凋亡,抑制JAK2/STAT3可能是IL-12发挥抗NK-T细胞淋巴瘤的分子机制,未来IL-12有望成为治疗抗NK-T细胞淋巴瘤的新药物。
——一道江苏高考题的奥秘解读和拓展

