东钱湖水体异养细菌的时空分布及其与环境影响因素和有机质的关系
王海丽,刁俊睿,钱文杰,邢雅丽,谢煜,金茅,沈钧亮
浙江万里学院生物与环境学院,宁波 315100
0 前言
东钱湖是浙江省最大的天然淡水湖,是宁波市重要的水利工程,其功能以农业灌溉为主,兼顾水产养殖、城市供水、风光旅游、航运交通等。但是随着开发力度的不断加大,湖区水体和底泥中的污染物不断累积,部分监测结果表明东钱湖水体已不能满足III类水的水功能区划要求,东钱湖的水环境保护问题已十分迫切[1-4]。异养细菌是湖泊等水生生态系统中的重要组成部分,是湖泊中有机质降解和转化的主要驱动者,在湖泊水体微食物网中扮演重要角色,其丰度能较为直观地指示水体质量的高低[5-10]。水体中的可溶性有机质(the dissolved organic matter,DOM) 是碳水化合物、蛋白质、游离氨基酸、腐殖质等有机分子的混合物,在水生系统的生物地球化学循环与生态环境中起着重要作用,水体中有机质的降解与转化机制是近年来研究的热点[7-10]。本文首次对东钱湖水体中异养细菌丰度的时空分布特征和溶解性有机质进行调查,并结合多元统计分析方法,分析了东钱湖表层水体中异养细菌的丰度及其环境影响因素与DOM的关系,以期为东钱湖自然环境保护及其生源要素有机质的生物地球化学循环研究提供理论依据。
1 材料与方法
1.1 研究区简介及站位设置
东钱湖(29°52'N,121°34'E)位于宁波市区东南约15 km处,由谷子湖、北湖和南湖3个部分组成,东西宽约 6.5 km,南北长约 8.5 km,湖面面积 19.9 km2,湖容4.4×107m3,平均水深2.0 m,换水周期约为280 d,是典型的盆状浅水湖泊[11]。因湖泊水体中大部分污染物来源于陆地,为进一步研究人类活动对宁波东钱湖水体中异养细菌丰度的影响,在河流入口及码头等人类活动密集区集中设置17个站点,分别命名为 L1—L17,其中 L1—L2、L16、L17 站点位于谷子湖,L3—L11位于南湖,L12—15位于北湖。具体站点如图1所示。
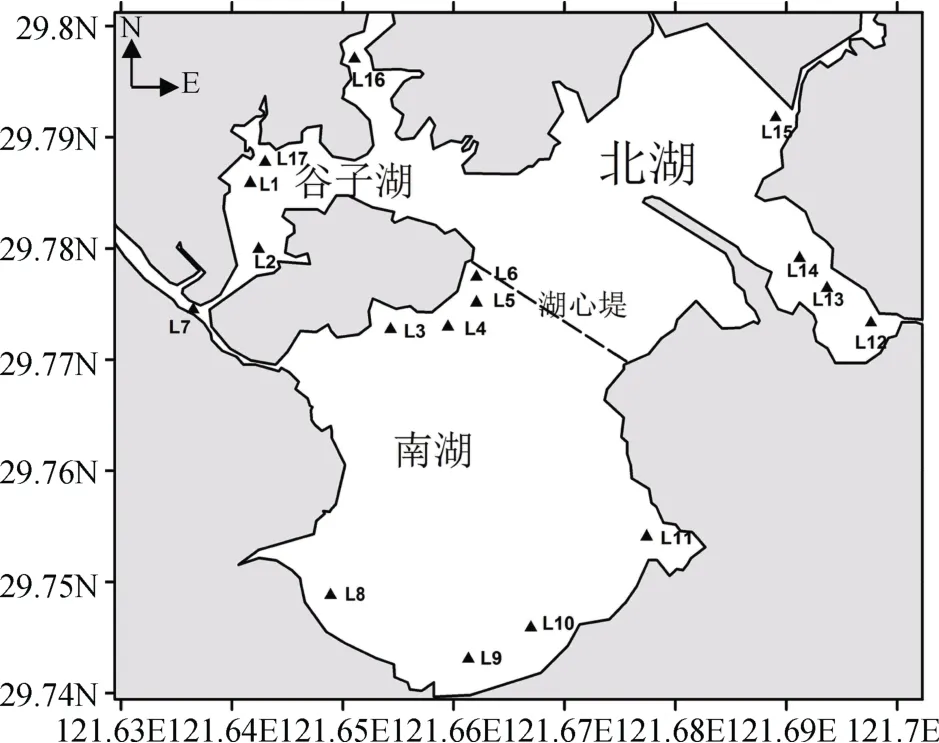
图1 监测站位示意Figure 1 Map of station
1.2 样品的采集及分析方法
根据湖泊及水质调查规范,分别于2015年冬(1月22日)、春(5月 10日)以及夏季(7月19日),采用直立式有机玻璃采水器采集17个站点的水面下0.5 m处表层水体,避光冷藏迅速带回实验室进行分析[12-13]。
采用平板菌落计数法检测异养细菌丰度,异养细菌培养采用营养琼脂培养基[14]。根据水环境监测规范,同期测定以下水质指标:采用重铬酸盐法测定COD,采用分光光度法测定Chla。样品采集时采用便携式水质测定仪实时测定DO、 pH、 ST的值[13]。水体的DOM采用三维荧光光谱法测定[15]。以灭菌超纯水为空白对照,水样测定前用0.70 μm的滤膜过滤,DOM的测定采用日立荧光分光光度计(F-4500)进行三维荧光光谱扫描。测量参数设置如下:光源为150 W氙灯;PTM电压为700 v;激发波长为200—650 nm,发射波长为250—700 nm;狭缝宽度均为10 nm,间隔波长均为5 nm;扫描速度为30000 nm·min-1。采用FRI法进行荧光光谱数据分析[16],同时计算水体的荧光指数FI、生物源指数(BIX)和新鲜度指数(β:α)[17]。FI是370 nm处激发,发射波长为450 nm与500 nm荧光强度的比值;BIX是310 nm激发,380 nm发射波长处荧光强度与420 nm—435 nm区间最大荧光强度的比值;新鲜度指数(β:α)是 310 nm 激发,380 nm 发射处的荧光强度与420 nm—435 nm 发射区间最大荧光强度的比值[17]。
1.3 数据处理
所有数据均为实测数据,采用SPSS19.0软件分析研究影响异养细菌时空分布的环境因素与DOM的关系[18]。同时采用 sufer8.0软件绘制异养细菌丰度的水平空间分布图;采用Origin8.5软件绘制水体DOM的三维荧光光谱图
2 结果与分析
2.1 调查期间东钱湖表层水体的异养细菌丰度的季节分布
由表1可知,调查期间东钱湖表层水体的异养细菌丰度分别在 1.9×102—1.5×103CFU·mL-1、1.7×103—9.2×105CFU·mL-1、1.2×104—4.1×106CFU·mL-1。这与已报道的武汉东湖异养细菌丰度研究结果相近[19-20]。调查期间宁波东钱湖表层水体的异养细菌丰度在不同季节间差异显著(P<0.05),其中春季的异养细菌丰度显著高于冬季;除 L7号站点外,夏季的异养细菌丰度显著高于春季,即宁波东钱湖表层水体的异养细菌丰度的基本变化规律为夏季>春季>冬季,这与已有报道湖泊水体异养细菌丰度的季节变化规律一致[19-20]。
2.2 调查期间东钱湖表层水体的异养细菌丰度的空间分布
调查期间东钱湖表层水体中异养细菌丰度空间分布如图2所示。
冬季东钱湖各站点间水体中异养细菌丰度无显著差异(p> 0.05),但北湖支流汇入口处水体中异养细菌丰度随离岸越远,数值越低;位于游船码头附近的L3、L4站点及谷子湖的支流汇入口处L16站点水体中异养细菌丰度相对较高,这与人类活动带来的陆源污染密切相关。春季东钱湖表层水体的异养细菌丰度在各站点间差异显著(p< 0.05);谷子湖和北湖支流汇入口处的L7、L16、L12—L14水体中异养细菌的丰度显著高于其他站点(P< 0.05),而其他站点间无显著差异,说明陆源输入的污染增加了水体中异养细菌丰度;春季异养细菌丰度的峰值出现于东钱湖支流的桥上的L7站点(p< 0.05),这与当时L7站点附近施工改造等人类活动较多密切相关。夏季东钱湖表层水体的异养细菌丰度在各站点间差异显著(p< 0.05);北湖支流汇入口处异养细菌丰度随离岸越远,数值越低,位于游船码头附近的L3站点水体中异养细菌丰度出现较高值,这与人类活动带来的陆源污染输入及游船活动带来的污染均密切相关。异养细菌丰度的峰值是位于渔船码头附近的L8站点,该站点水体交换不畅,厌氧菌大量繁殖,导致水质状况不佳;另外,该处位于东钱湖水上乐园附近,夏季人类大量的戏水、乘游船游玩等活动也是造成此处异养细菌丰度较高的直接原因。
综合以上,调查期间东钱湖水体异养细菌丰度峰值基本上位于人类活动较多的区域——支流汇入口、码头或水上乐园,陆源污染是造成此分布的主要原因。

表1 调查期间东钱湖表层水体异养细菌丰度检测结果(×103 CFU·mL-1)Table 2 The abundance of heterotrophic bacteria in surface water from Dongqian Lake in Ningbo during investigation(×103 CFU·mL-1)
2.3 影响异养细菌分布的环境因素与有机质的关系
2.3.1 调查期间东钱湖表层水体的理化指标调查结果
调查期间东钱湖水体中的理化因子监测结果如表2所示。水质调查部分结果已与另文发表[4]。

图2 调查期间东钱湖表层水体异养细菌丰度的空间分布(×103 CFU·mL-1)Figure 2 Distribution of heterotrophic bacteria in the surface water from Dongqian Lake(×103 CFU·mL-1)
调查期间东钱湖表层水体中的ST、COD、Chla的含量以在不同季节间差异显著(P< 0.05),基本变化规律为夏季显著高于春季,春季显著高于冬季,且COD、Chla含量以及异养细菌丰度在不同站点间差异显著(p< 0.05);相关性分析表明DO与其他指标均呈极显著负相关性(P< 0.01),Chla与其余指标均呈显著正相关性(p< 0.01);根据地表水环境质量标准,调查期间东钱湖表层水体的水质在1月(冬季)和5月(春季)均符合III级标准,在7月(夏季)部分站点符合V级标准,进一步说明了水温以及人为活动显著影响东钱湖表层水体水质[4]。
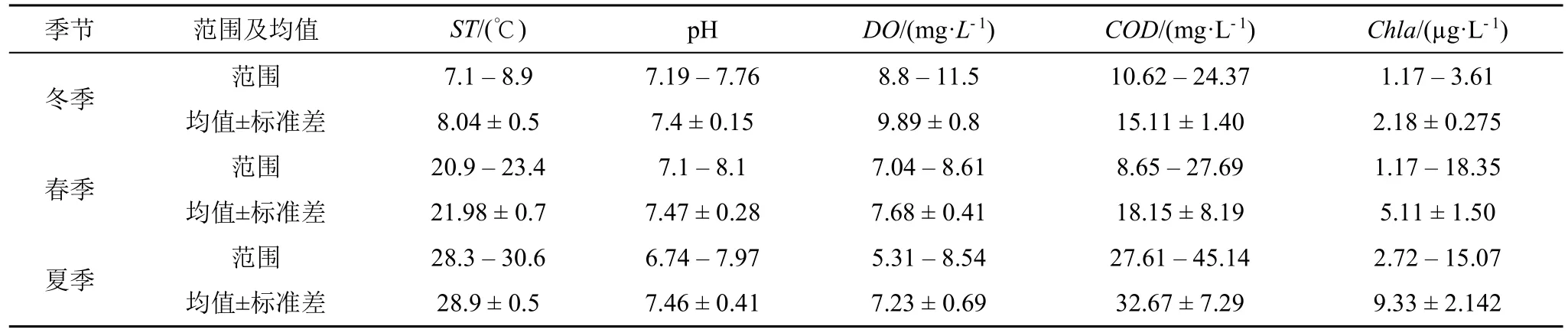
表2 调查期间东钱湖表层水体理化指标调查结果Table 2 The physicochemical parameters in surface water from Dongqian Lake during investigation
2.3.2 调查期间东钱湖表层水体的DOM分布
调查期间东钱湖表层水体的DOM三维荧光光谱图如图3所示。
由图3可知,调查期间东钱湖表层水体的DOM三维荧光光谱主要存在Ⅰ—Ⅴ五个荧光峰的区域,这五个荧光峰区域的中心位置分别位于:Ⅰ区,λEx/λEm= 220 — 250 nm / 280 —330 nm;Ⅱ区,λEx/λEm= 220 — 250 nm / 330 — 380 nm;Ⅲ区,λEx/ λEm=220 —250 nm / 380 — 500 nm;Ⅳ区,λEx/ λEm=250—280 nm / 280 — 380 nm;Ⅴ区,λEx/ λEm= 250— 400 nm / 380 — 500 nm;对应的主要荧光性有机物分别为类芳香族蛋白质Ⅰ类、类芳香族蛋白质Ⅱ类、类富里酸物质III类、类溶解性微生物代谢产物IV及类腐殖酸物质 V。这与已有报道类似相似[15,16,21-24]。
调查期间东钱湖表层水体的DOM荧光区域积分体积如表3所示。由图3和表3可知,调查期间东钱湖表层水体中类芳香族蛋白质(类芳香族蛋白质Ⅰ、Ⅱ)含量最高,其次为类富里酸浓度,二者含量之和占总DOM的65%—80%之间,类溶解性微生物代谢产物IV、类腐殖酸物质V含量相对较低,这与已有报道类似[16,23,24]。因类蛋白荧光很少在洁净水体中出现,可用类蛋白荧光来指示水体的有机质的污染程度[25]。由表3可知,调查期间东钱湖表层水体有不同程度的污染,而DOM具体的来源解析另文报道。调查期间东钱湖表层水体DOM的荧光特征参数如表4。

图3 调查期间东钱湖表层水体冬、春、夏三季的DOM三维荧光光谱特征图Figure 3 Three-dimensional excitation-emission matrix fluorescence spectra for five DOM fractions in the surface water samples collected from the Dongqian Lake in winter, spring and summer, respectively
FI常用来表征DOM来源:FI>1.9时DOM主要来源于水体自身微生物活动,自生源特征明显;FI<1.3时DOM以外源输入为主,水体自身生产力贡献点对较低[17,23,26]。调查期间东钱湖水体DOM的FI均值 1.45,更接近 1.3,说明东钱湖水体中DOM由内源(微生物活动产生)与外源(陆源产生)两个来源,陆源输入为主。自生源指标BIX值反映了水体中DOM自生来源的相对贡献:BIX在 0.8~1.0 之间,表示样本中存在新生的自生源DOM较多;而0.6~0.8 之间表示自生源贡献较少[17,23,27]。调查期间东钱湖水体DOM的荧光指数BIX均值为0.78,说明宁波东钱湖水体DOM有中等新近自生源特征,存在微生物活动的内源输入和陆源的外源两种输入,且自生源贡献少。新鲜度指数(β:α)反映了新产生的DOM在整体DOM中所占的比例[17,23,27]。调查期间东钱湖水体DOM的β:α值均值为 0.55,说明水体DOM中新生的DOM高于50%。以上荧光参数的分析结果进一步阐明东钱湖水体中有机质的污染越来越多地受到陆源输入的影响,而周边不断增加的人为土地利用率,可能提高了水体中DOM的生物可利用性,增强了水体微生物的活性[23]。
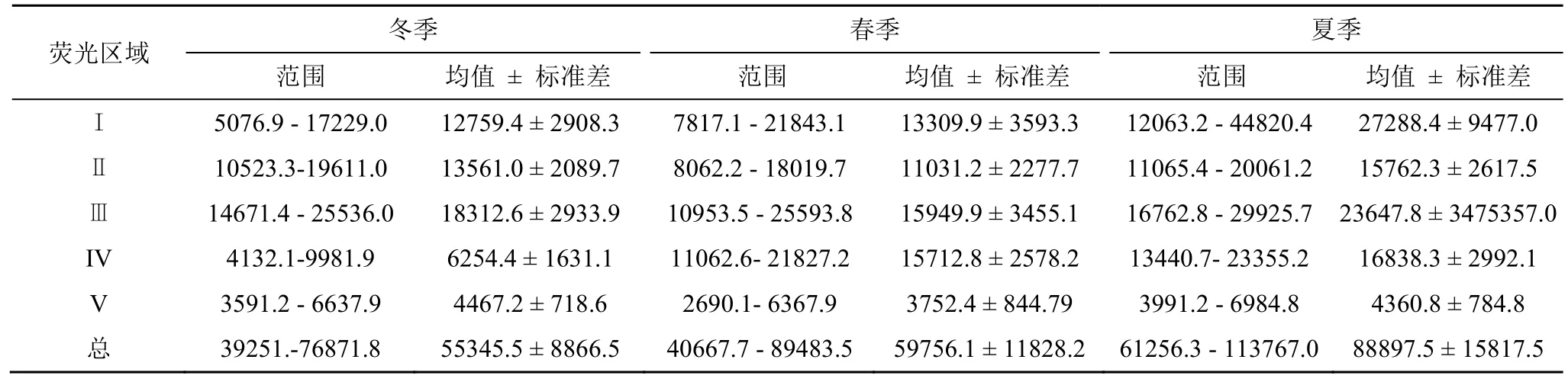
表3 调查期间东钱湖表层水体的DOM荧光区域积分体积Table 3 The fluorescence excitation-emission matrix regional integration of the five DOM fractions in the surface water samples collected from the Dongqian Lake during the investigation

表4 DOM的荧光特征参数统计Table 4 Statistics of parameters characterized DOM fluorescence
2.4 影响东钱湖水体异养细菌丰度的环境因素与有机质的关系
2.4.1 异养细菌丰度与环境因素的关系
采用主成分分析及多元线性逐步回归法分析异养细菌丰度与环境因素的关系,经方差极大反转后得出的东钱湖表层水体中3个主成分的因子载荷及各因子与主成分的相关性如表5所示,东钱湖表层水体异养细菌丰度(HBA)与PCAs进行多元逐步回归分析结果如表6所示。

表5 宁波东钱湖表层水体环境因子主成分分析结果——因子载荷和解释方差Table 5 Results of principal component analysis of environmental factors-various factors loading and explained variance
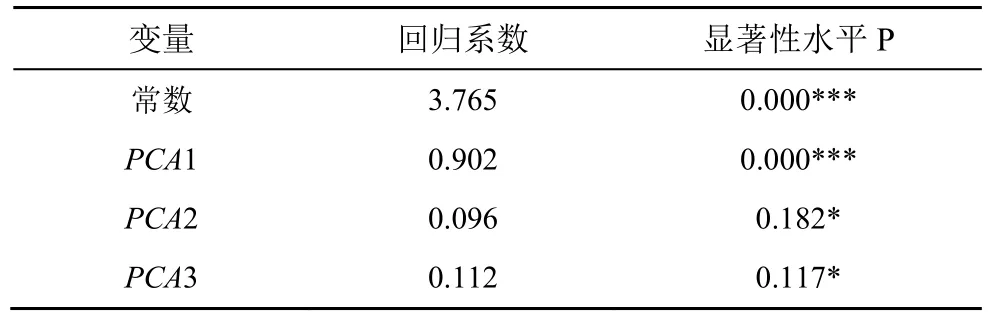
表6 东钱湖表层水体异养细菌丰度与主成分逐步回归分析结果Table 6 Result of stepwise regression between the heterotrophic bacteria abundance of surface water and PCAs
表5为利用SPSS进行方差极大反转后得出的东钱湖湖水的3个主成分的因子载荷、各因子与主成分的相关性。东钱湖湖水的11个因子中提取出的3个主成分(PCAs)的方差贡献率能达到82.328%,能较全面的反映出11个因子所包含的信息。其中第1主成分(PCA1)的方差贡献率最高,达到了47.911%。从各因子的载荷矩阵中可以看出,ST、DO、COD、Chla、类芳香族蛋白质荧光Ⅰ、类溶解性微生物代谢产物荧光IV在第1主成分(PCA1)内载荷较高(0.949、—0.870、0.712、0.713、0.788、0.714),相关系数均高于 0.700,其中水温相关系数高达 0.949;类芳香族蛋白质荧光Ⅱ、类富里酸物质荧光III、类腐殖酸物质荧光V、总DOM在第2主成分(PCA2)内载荷较高(0.953、0.961、0.799、0.804),相关系数高于 0.790;类芳香族蛋白质荧光Ⅱ高达0.953;pH在第3主成分(PCA3)内载荷较高(0.965)。
东钱湖表层水体异养细菌丰度(log10)与PCAs进行多元逐步回归分析,结果见表6,经逐步回归分析后1个主成分PCA1进入回归模型,线性关系极显著(p< 0.000)。回归方程为HBA(log10)= 3.765 +0.902 ×PCA1(p< 0.000),其中PCA1 与该方程有极显著相关性(P<0.000),该模型的决定系数为 0.823。通过该回归方程和 PCA1的环境因子载荷量(ST,0.949;DO,—0.870;COD,0.712;Chla,0.713;类芳香族蛋白质荧光Ⅰ,0.788;类溶解性微生物代谢产物荧光 IV,0.714)分析表明:调查期间东钱湖表层水体中异养细菌丰度与 PCA1呈极显著正相关,与PCA2、PCA3呈正相关。ST、DO、COD、Chla、DOM中的类芳香族蛋白质Ⅰ及类溶解性微生物代谢产物IV是影响东钱湖表层水体中异养细菌丰度的主要因素;且COD与异养细菌丰度呈显著正相关(P< 0.05);ST、pH、Chla、DOM中的类芳香族蛋白质Ⅰ及类溶解性微生物代谢产物 IV与异养细菌丰度呈极显著正相关(P< 0.01);DO与异养细菌丰度呈极显著负相关(P< 0.01)。
2.4.2 调查期间东钱湖水体异养细菌丰度及环境因素与有机质的相关性
调查期间东钱湖水体中异养细菌丰度及环境因素与DOM的相关性如表7所示。
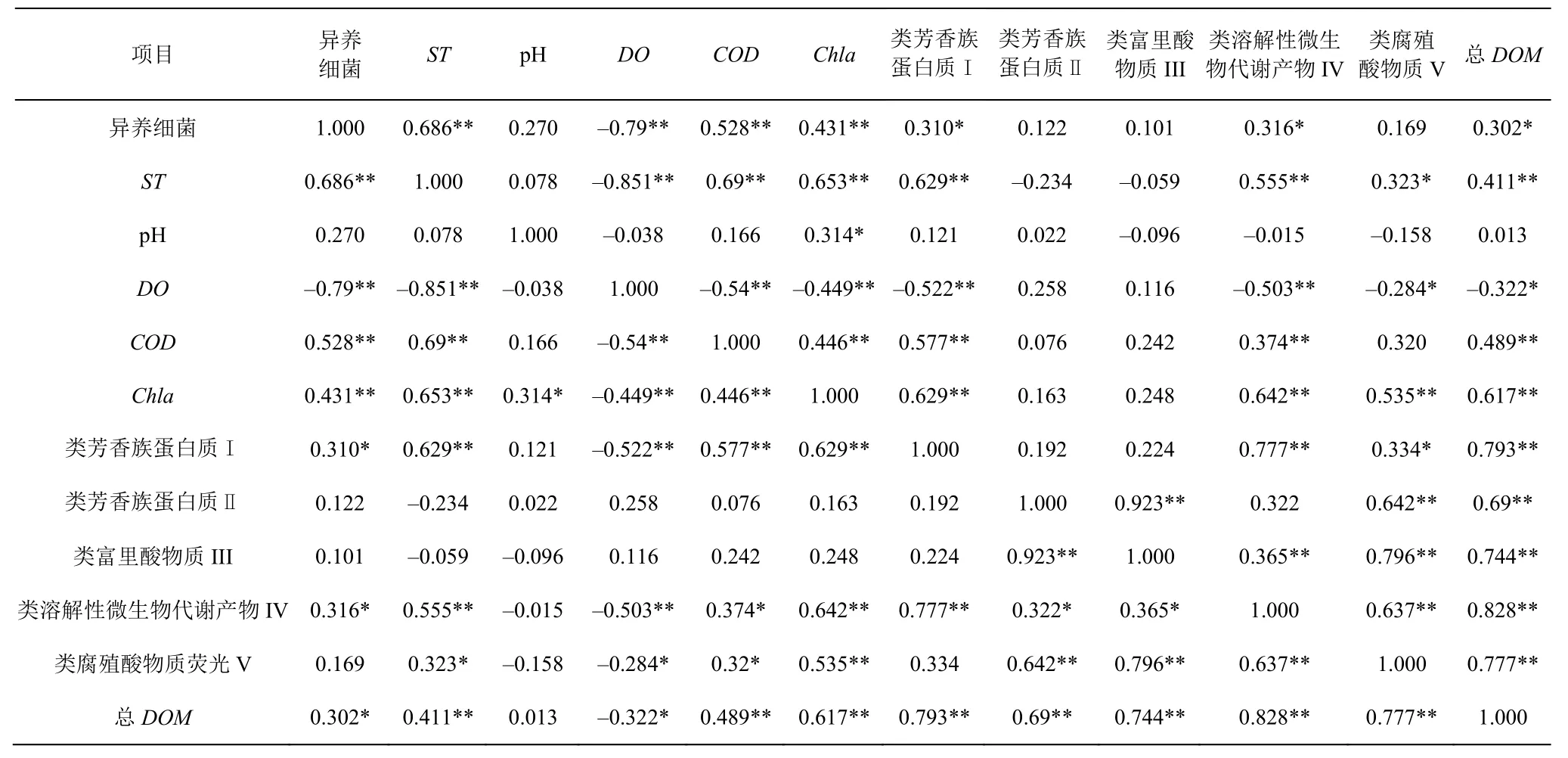
表7 异养细菌丰度及环境因子与可溶性有机质的相关性分析结果Table 7 Result of the correlation analysis of the abundance of the heterotrophic bacteria and environmental factors with DOM
3 讨论
通过回归方程HBAlog10 = 3.765 + 0.902 ×PCA1(P< 0.000)及PCA1(ST,0.949;DO,-0.870;COD,0.712;Chla,0.713;类芳香族蛋白质荧光Ⅰ,0.788;类溶解性微生物代谢产物荧光 IV,0.714;总DOM,0.558;类腐殖酸物质 V,0.379)环境因子的载荷量及表7可知,DOM中的类芳香族蛋白质Ⅰ及类溶解性微生物代谢产物 IV与异养细菌丰度呈极显著正相关(P<0.01),总DOM因为包括类芳香族蛋白质Ⅱ及类溶解性微生物代谢产物 IV,也与异养细菌丰度呈显著正相关(P<0.05);而类腐殖酸物质 V 虽然也呈显著正相关,相关系数不是很高;以上结果说明东钱湖水体中的异养细菌丰度是溶解性有机质的显著影响因素。
叶绿素浓度的高低反映着水体中浮游植物现存量的高低,初级生产者如藻类及浮游植物是水体内DOM的主要内源贡献者[28]。东钱湖表层水体DOM中的类芳香族蛋白质Ⅰ及类溶解性微生物代谢产物 IV与Chla含量呈极显著正相关(P<0.01)的结果表明,调查期间东钱湖水体中水生植物产生的DOM可能是东钱湖水体可溶性有机质的主要来源之一。
COD是衡量水体中有机质含量的重要指标,一定程度上指示水体中所有的有机质(颗粒有机质和溶解性有机质)的含量。异养细菌丰度与COD、DOM均呈显著正相关的结果共同佐证东钱湖水体异养细菌在利用有机质生长繁殖的同时,与有机质相互作用,其丰度极显著影响水体中DOM的赋存量,这与已有结果类似[5-6]。异养细菌将DOM转化为颗粒有机物(即细菌自身生物量),进入水体微食物环[8-10],从而影响DOM在水体中的赋存量。
异养细菌对DOM的利用主要基于生理需求,但也受到环境因子的影响[29-33]。与此类似,调查期间除异养细菌外,ST、DO、pH、Chla、COD等环境因子与DOM也显著相关性(见表7),进一步佐证了异养细菌与环境因子共同影响水体中DOM的降解与转化,从而影响DOM在水体中的含量和赋存形态。
一般认为腐殖质类物质不容易被细菌分解利用[29],而异养细菌降解与转化的组分主要为生物可利用性高的DOM组分[29-34]。结合调查期间东钱湖水体DOM中类腐殖酸物质V含量最低、异养细菌丰度与DOM中的类芳香族蛋白质Ⅰ及类溶解性微生物代谢产物IV呈极显著正相关以及DOM荧光参数的分析结果可知,异养细菌等微生物的代谢转化活动和陆源输入共同决定DOM的来源与特性,周边不断增加的陆源输入是水体中DOM生物可利用性提高的可能原因,但异养细菌驱动下东钱湖水体DOM的转化过程中,微生物的群落结构变化与DOM转化的具体激发响应机制有待于进一步的研究。

