过表达SCN4B对前列腺癌增殖和侵袭的影响
韦卓利 陶露 武世伍 宋早智项平
蚌埠医学院第一附属医院中心实验室病理科(安徽蚌埠233004)
据全球癌症统计数据估计,2018年全世界有近130万前列腺癌新发病例和359 000例相关死亡病例,是男性中第二大癌症和第五大癌症死亡原因[1],五年生存率为72.6%[2]。目前前列腺癌临床预后风险分级使用术前PSA 值,cTNM和Gleason评分是公认的,然而,有研究发现,即使患者具有相同的PSA,Gleason 评分和T 分期,其预后也可能完全不同[3-5]。因此,需要探索更好的预后指标来帮助预测不同前列腺癌患者。电压门控钠离子通道β4 亚基(SCN4B)作为α亚基的辅助亚基,不仅在细胞兴奋中发挥重要的作用,还可以作为黏附分子,影响肿瘤细胞的黏附及迁移活动,定位于人染色体11q23.3 上的β4 亚基,有5个外显子,编码228个氨基酸残基[6-7]。SCN4B在乳头状甲状腺癌、乳腺癌、宫颈癌等肿瘤中[8-10]常表现为低表达,但有关SCN4B蛋白在前列腺癌中的表达与机制尚不清楚。本研究通过免疫组织化学Elivision TM plus 法检测90例前列腺癌患者肿瘤组织中SCN4B蛋白的表达,并分析其与前列腺癌患者临床参数之间的相互关系以及对患者生存期的影响。通过构建SCN4B 过表达载体探讨SCN4B对前列腺癌细胞增殖和侵袭的影响。
1 材料与方法
1.1 组织标本及细胞株收集蚌埠医学院第一附属医院病理科2011年12月至2015年12月前列腺癌患者的存档石蜡包埋组织标本90例,前列腺癌旁组织标本30例作为对照。前列腺癌组织标本按照Gleason 评分方法进行病理分级;采用AJCC 第八版的TNM 分期系统。所有患者术前均未行放化疗以及其他抗肿瘤治疗,均有完整的临床病理资料及随访资料,随访截止日期至2018年12月。本研究经过蚌埠医学院第一附属医院伦理委员会的批准及患者的知情同意。前列腺癌细胞株(LNCAP、PC-3、DU145)购自上海中国科学院细胞库。
1.2 主要试剂兔抗人多克隆抗体SCN4B(1∶100)购买于affinity公司(货号DF6877),ElivisonTMPlus试剂盒和DAB 显色试剂盒(福州迈新)。qPCR 引物购自上海生工,试剂盒购自TaKaRa,含有SCN4B的过表达质粒和空白对照质粒委托上海吉玛公司构建完成。CCK8 试剂盒购自福州迈新,Transwell小室购自corning公司。
1.3 检测方法
1.3.1 免疫组化染色方法活检组织标本用4%甲醛溶液固定,石蜡包埋。石蜡标本以4 μm/片连续切片,按照试剂说明书进行免疫组化染色。以PBS 代替一抗作阴性对照。 SCN4B蛋白主要定位于细胞质,呈黄褐色。每张切片随机选择3个不同的视野在高倍镜下观察,判断阳性表达强度和阳性率。采用半定量分析方法对免疫组化结果进行评分[11],染色强度计分:0 分(无明显着色),1 分(弱染色),2 分(中度染色),3 分(强染色)[12]。每个视野阳性细胞所占的比例计分:1 分(<25%),2 分(25%~50%),3 分(51%~75%)和4 分(>75%)。最终得分为染色强度与阳性细胞数的乘积(0~12 分),得分≤6为低表达,>6为高表达。
1.3.2 qRT-PCRTrizol 法提取3 种前列腺癌细胞株总RNA,并逆转录成cDNA。按照试剂盒说明书操作,以β-actin为内参,分别检测LNCAP、PC-3、DU145细胞中mRNA表达。
引物如下:ACTB:上游:5′-GTGGCCGAGGACTTTGATTG-3′,下游:5′-AGGATCTCCGTGCCATTGAC-3′;SCN4B:上游:5′-ACTGGGCTTTTGGGCCTCTT-3′,下游:5′-AGGATCTCCGTGCCATTGAC-3′。反应条件:95℃、3 min,95℃、12 s,62℃、40 s,重复40个循环。每个样品设置3个复孔,采用2-△△CT法比较基因表达差异。
1.3.3 细胞转染取对数期生长的DU145细胞为转染对象,按1×106细胞/孔的浓度接种6孔板中。培养至70%融合时,根据LipofectamineTM2000 试剂说明书分别转染空白对照质粒和过表达质粒。细胞根据转染质粒不同分为空白对照组(PCDH 组)和过表达组(PCDH-SCN4B 组)。用qRT-PCR检测转染是否成功。
1.3.4 CCK-8取空白对照组(PCDH组)和过表达组(PCDH-SCN4B组)细胞消化后计数,1×103个/孔接种于96孔板中,在培养箱中分别培养24、48、72、96 h。在每个时间点更换培养基后加入10 μL CCK8/孔,并将细胞在37℃孵育2 h。取出后使用酶标仪检测450 nm(OD450)的吸光度。
1.3.5 Transwell取PCDH 组和PCDH-SCN4B 组细胞消化后用无血清培养基调整细胞密度,按2×104/孔接种到铺好基质胶的上室中,每孔200 μL;600 μL 含10%FBS的培养基加入下室。培养24 h后,取出上室,甲醇固定20 min,结晶紫染色20 min后用PBS 洗两遍。选取4个高倍视野,计数后取平均值。
1.4 统计学方法采用SPSS 18.0 统计分析软件,计数资料比较采用χ2检验,生存分析采用Kaplan-Meier 法,组间计量资料比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌和前列腺癌旁组织中SCN4B蛋白的表达情况90例前列腺癌组织中44例SCN4B蛋白高表达,30例癌旁组织中有3例低表达,差异有统计学意义(χ2= 15.740,P<0.01)。在前列腺癌组织中,SCN4B的表达与前列腺癌的Gleason 分级、临床分期、远处转移有关(P<0.05),与患者的年龄、术前PSA 水平无关(P>0.05)(表1、图1)。SCN4B 高表达患者的总生存率高于SCN4B 低表达的患者(P<0.05),差异有统计学意义(图2)。
2.2 3种前列腺癌细胞株中SCN4B的表达以高转移性细胞DU145为参考对象,PC-3和LNCAP细胞株中SCN4B表达均增强(P<0.05,图3)。
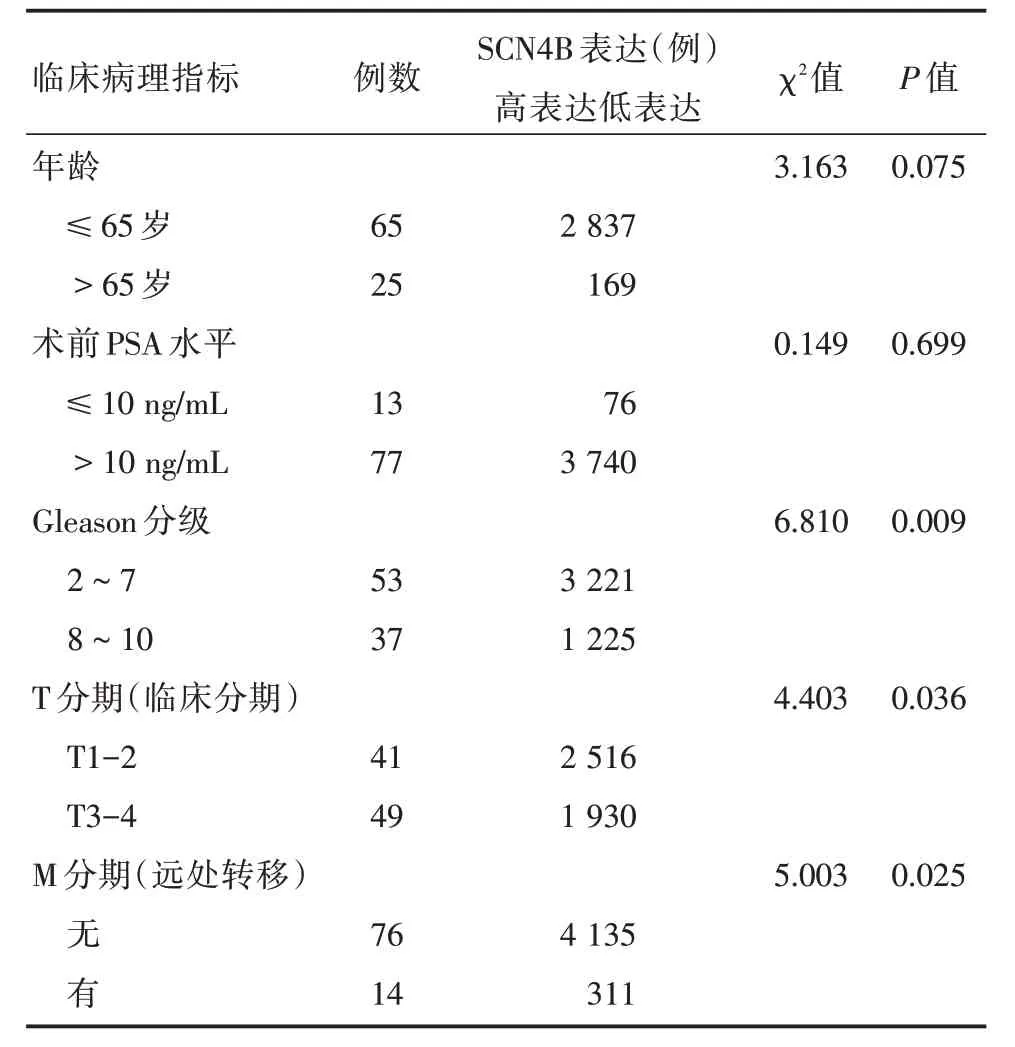
表1 各临床病理指标与前列腺癌组织中SCN4B蛋白质的表达关系Tab.1 Relationship between clinical pathological parameters and expression of SCN4B protein in prostate cancer tissues
2.3 SCN4B 质粒的转染验证提取PCDH 组和PCDH-SCN4B 组细胞总RNA,通过qRT-PCR检测转染后SCN4B表达情况,结果发现,PCDH-SCN4B组SCN4B表达显著高于PCDH 组(P<0.01),证明转染成功(图4)。
2.4 过表达SCN4B对细胞增殖的影响CCK8 增殖实验检测结果说明:与PCDH 组相比,PCDHSCN4B 组的DU145细胞从第72 h 开始,增殖能力显著降低(P<0.05,图5)。
2.5 过表达SCN4B对细胞侵袭的影响Transwell侵袭实验说明:SCN4B 过表达显著抑制DU145的侵袭能力(P<0.05,图6)。

图1 不同病理分期SCN4B 免疫组化结果(×400)Fig.1 Results of different pathological stages of SCNB4 immunohistochemistry(×400)

图2 Kaplan-Meier 生存曲线分析显示90例SCN4B表达的前列腺癌患者的预后Fig.2 Kaplan-Meier survival curve analysis showing the prognosis of 90 patients with SCN4B expressing prostate cancer

图3 SCN4B在3 种前列腺癌细胞株的表达Fig.3 Expression of SCN4B in three prostate cancer cell lines
3 讨论

图4 转染后DU145细胞中SCN4B的相对表达量Fig.4 Relative expression of SCN4B in DU145 cells after transfection
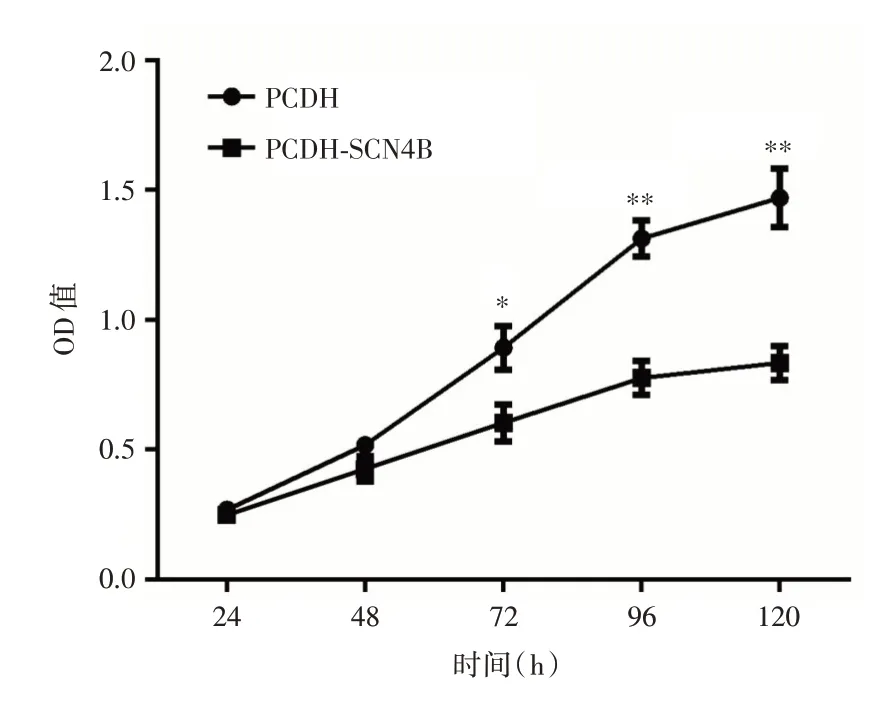
图5 SCN4B对细胞增殖的影响Fig.5 The effect of SCN4B on cell proliferation
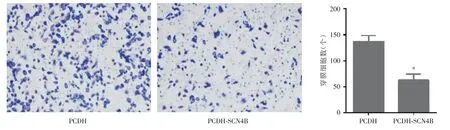
图6 SCN4B对细胞侵袭的影响Fig.6 The effect of SCN4B on cell invasion
SCN4B是新发现肿瘤转移抑制基因,来自于电压门控钠离子通道,可调节钠离子通道,诱导产生复苏电流,也可影响钠通道对动物毒液分子的敏感性。电压门控钠离子通道(VGSC)常在神经、肌肉、神经内分泌细胞中表达,近来发现VGSC 也在某些转移的癌细胞中表达[13-14],研究[15-18]表明,它在癌细胞中的表达增加了癌细胞的侵袭转移。VGSC在肿瘤的转移中有着重要的作用,其肿瘤机制复杂多变,目前的研究发现主要与以下因素有关[19-20]:(1)作为黏附分子,改变细胞形态,影响癌细胞的侵袭迁移;(2)调节α亚基的活性;(3)调节相互作用蛋白的表达量。
本研究证实了SCN4B蛋白在前列腺癌组织中存在表达,且SCN4B的阳性表达率显著低于癌旁组织(P<0.01),并随着病理分期(T 分期)和Gleason 分级的增高SCN4B蛋白表达水平逐渐降低(P<0.05),而与患者的年龄、术前PSA 水平间差异无统计学意义(P>0.05),通过K-M 生存分析表明SCN4B 低表达的患者相对于SCN4B 高表达的患者有着较差的预后,说明SCN4B蛋白可能参与了前列腺癌的发生发展。然后本研究通过qRT-PCR检测SCN4B在人前列腺癌细胞株(LNCaP,DU145和PC-3)中的表达高低,结果表明SCN4B在DU145细胞株中表达最低。选择DU145细胞株进行转染,与空白组进行对照,验证了过表达SCN4B可抑制前列腺癌细胞的增殖和侵袭。
电压门控钠通道β亚基(由SCN1B至SCN4B 基因编码)已被证明是调节细胞过程如细胞黏附和细胞迁移的重要多功能信号分子。HERNANDEZPLATA 等[10]和其他研究表明β4 亚基在一些细胞,肿瘤组织,和正常组织中表达有差异。SCN4B/β4亚基在宫颈癌细胞中的表达水平比正常的细胞表达水平低,但在活检中结果却相反,可能与其黏附功能在体内和体外条件不同有关。BON 等[9]的研究证明SCN4B/β4 亚单位在正常的乳腺癌上皮细胞和组织中表达,但在侵略性癌细胞和肿瘤中表达下降。SCN4B/β4的缺失通过RhoA 依赖性信号传导途径增强癌细胞迁移和转移形成,独立于成孔NaV 亚基。SCN4B 过表达减少了癌细胞侵袭和肿瘤进展,表明SCN4B/β4 代表抑制基因。GONG等[8]采用回顾性研究,通过生物信息学分析癌症基因组图谱(TCGA)表明:SCN4B的表达是乳头状甲状腺癌无复发存活的独立指标,同时还发现它的表达可能被DNA 高甲基化抑制,但不太可能受DNA 拷贝数改变/突变的影响。本研究与此相符,由此,笔者推测SCN4B的低表达影响了肿瘤的侵袭与转移。
本文通过研究分析表明,SCN4B在前列腺癌中通过抑制肿瘤的增殖和侵袭发挥抑癌基因的作用,并对其诊断有重要意义。但是,这项研究也存在一些不足。首先,临床标本样本量相对较小。其次,SCN4B通过何种信号通路参与PCa的调控机制未涉及,以及裸鼠成瘤体内实验的验证。接下来将通过进一步的实验探讨SCN4B 与前列腺癌转移之间的分子机制以及体内实验的验证。总之,本研究发现SCN4B在前列腺癌组织中低表达,而且,相对于SCN4B 高表达患者总体五年生存率降低。通过细胞功能实验证明,过表达SCN4B可抑制前列腺癌细胞的增殖和侵袭。本研究对前列腺癌的诊断以及病情监测有一定意义。
——一道江苏高考题的奥秘解读和拓展

