蒿甲醚自微乳化给药系统对小鼠人脑胶质瘤皮下移植瘤的抑瘤作用研究
张亚红 王丽娟 林凤云 兰作平 甘淋玲

摘 要 目的:研究蒿甲醚(ARM)自微乳化给药系统(SMEDDS)对人脑胶质瘤皮下移植瘤模型小鼠的抑瘤效果。方法:以人脑胶质细胞瘤细胞株SHG44接种,并以组织块移植传代,建立裸小鼠皮下移植瘤模型。分别于接种后的第5、10、15、20、25天时测量小鼠肿瘤组织体积,绘制肿瘤生长曲线,确定肿瘤快速增殖初期。取裸小鼠30只,同法建立皮下移植瘤模型,并于肿瘤快速增殖初期时分为对照组(生理盐水)、ARM混悬液组[60 mg/(kg·d)]和ARM-SMEDDS低、中、高剂量组[10、20、30 mg/(kg·d)]并灌胃给予生理盐水或相應药液,每日1次,连续给药30 d。记录小鼠体质量变化及一般情况,测定肿瘤组织体积变化并计算相对肿瘤增殖率。结果:皮下移植肿瘤块组织后第10天左右即进入肿瘤快速增殖初期。给药期间各组小鼠一般情况正常,未见明显异常反应。自给药第10天起,ARM-SMEDDS各剂量组小鼠的肿瘤组织体积均较对照组显著缩小(P<0.05);自给药第15天起,ARM-SMEDDS各剂量组小鼠的肿瘤组织体积均较ARM混悬液组显著缩小(P<0.05)。末次给药后,ARM-SMEDDS各剂量组小鼠的相对肿瘤增殖率均较ARM混悬液组均显著降低(P<0.05)。结论:ARM-SMEDDS具有明显的抑制人脑胶质瘤增长的效果,抑瘤效果优于剂量更高的ARM混悬液剂型。
关键词 蒿甲醚;自微乳化给药系统;人脑胶质瘤细胞;皮下移植瘤;小鼠;抑瘤作用
Study on Anti-tumor Effects of Artemether Self-microemulsifying Drug Delivery System on Subcutaneous Transplantation of Human Glioma in Mice
ZHANG Yahong,WANG Lijuan,LIN Fengyun,LAN Zuoping,GAN Linling(School of Pharmacy, Chongqing Medical and Pharmaceutical College & Chongqing Engineering Research Center of Pharmaceutical Sciences, Chongqing 401331, China)
ABSTRACT OBJECTIVE: To study the anti-tumor effect of artemether (ARM) self-microemulsifying drug delivery system (SMEDDS) on human glioma subcutaneously transplanted model mice. METHODS: Human glioma cell line SHG44 was inoculated and passed on to establish subcutaneous transplanted tumor model of nude mice. At the 5th, 10th, 15th, 20th and 25th day after inoculation, the tumor tissue volume was measured and the growth curve was drawn to confirm the initial stage of rapid tumor proliferation. Thirty nude mice was collected to establish subeutaneously transplanted tumor nude model, and then divided into control group (normal saline), ARM suspension group [60 mg/(kg·d)], ARM-SMEDDS low-dose, medium-dose and high-dose groups [10, 20, 30 mg/(kg·d)] at the initial stage of rapid tumor proliferation. They were given normal saline and relevant solution intragastrically once a day, for consecutive 30 d. The weight change and general sibuation of mice were recorded. The change of tumor volume was determined and relative tumor proliferation rate was calculated. RESULTS: The subcutaneously transplanted tumor tissue entered the initial stage of rapid tumor proliferation from the 10th day after transplantation. The general situation was normal, and there was no obvious abnormal reaction in mice of each group during treatment. Since 10th day of administration, tumor tissue volume of mice in ARM-SMEDDS groups were shortened significantly than control group (P<0.05). At 15th day of administration, tumor volume of mice in ARM-SMEDDS groups were shortened significantly than ARM suspension group (P<0.05). After last administration, relative tumor proliferation rates of mice in ARM-SMEDDS groups were decreased significantly, compared with ARM suspension group (P<0.05). CONCLUSIONS: ARM-SMEDDS show significant inhibitory effect on the proliferation of human glioma, and are better than suspension with higher dosage.
KEYWORDS Artemether;Self-microemulsifying drug delivery system;Human glioma cells;Subcutaneous transplanted tumor; Mice; Anti-tumor effect
脑胶质瘤是中枢神经系统最常见的颅内恶性肿瘤,每10万人中约有10~20人患病,其发病率约占恶性肿瘤的1%~3%;在所有胶质细胞瘤患者中,胶质母细胞瘤患者1年生存率约为30%,但5年生存率不足5%[1]。目前,手术、放射和药物治疗等仍是脑胶质瘤最主要的治疗方法,但由于神经胶质瘤的特殊性、耐药性及血脑屏障等因素,传统的化疗药物如卡莫司汀、洛莫司汀、尼莫司汀等的治疗效果均不理想[1-2],而新型化疗药物如福莫司汀、替莫唑胺等价格较贵、副作用较大,所以进一步寻找新的安全性更好、价格更易于被患者接受的化疗药物迫在眉睫[1,3]。
青蒿素是一种含有过氧基团的倍半萜内酯类化合物,是临床上常用抗疟药物,主要从我国菊科艾属植物黄花蒿(Artemisia annual L.)中提取而来。青蒿素及其衍生物因具有高效、低毒、强抗疟性等特点,被世界卫生组织批准为治疗脑型疟疾和恶性疟疾的首选药物[4]。既往研究指出,青蒿素类化合物对脑胶质瘤细胞有较强的抑制、杀伤作用,呈现明显的剂量关系,而且对正常细胞的损伤很小[5-6]。蒿甲醚(Artemether,ARM)是青蒿素的一个重要衍生物,是通过青蒿素加氢还原生成双氢青蒿素后再醚化形成的化合物,目前被作为抗疟疾药物而广泛应用于临床;研究发现,ARM具有抗肿瘤的效果,并可以通过血脑屏障进入中枢神经系统[7-8]。但ARM水溶性差、体内代谢快,其在生物体内生物利用度较低,在大鼠的口服生物利用度仅约20%[9-10]。因此,本课题组前期自主研制出了ARM的自微乳化系统(Self-microemulsifying drug delivery system,SMEDDS),其口服生物利用度为ARM混悬液的16~18倍,可有效提高ARM的体内生物利用度,并延长其作用时间[11-12]。本研究在此基础上建立皮下人脑胶质瘤裸小鼠模型,旨在对ARM-SMEDDS的抑瘤效果进行评价。
1 材料
1.1 仪器
Quattro Premier XE MircoMass-2695型液压联用仪(美国Waters公司);ST-BE1100型混旋仪(台湾斯特仪器设备有限公司);移液器(北京长风仪器仪表公司);CPA225D型电子天平(德国 Sartorius公司);NDK200-1型氮吹仪(上海泉岛科贸有限公司);TGL-12型台式离心机(常州市凯航仪器有限公司);AIRTECH SW-CJ-1FD型超净工作台、NAPCO6500型CO2细胞培养箱(意大利Jouan公司);游标卡尺(天津桂量量具刃具有限公司)。
1.2 药品与试剂
ARM对照品(中国药品生物制品检定所,批号:100271-201003,纯度:99.8%);ARM原料药(重庆华立武陵山制药有限公司,批号:20110504,纯度:≥98%);Lauroglycol 90、Gelucire 44/14(法国 Gattefosse 公司);Cremophor RH 40(德国 BASF公司);DMEM培养基(美国Gibco公司);小牛血清(上海士锋生物科技有限公司);胰蛋白酶(上海古朵生物科技有限公司);0.9%氯化钠注射液(四川科伦药业股份有限公司,作生理盐水用);pH 7.2磷酸盐缓冲液(PBS,美国Thermo Fisher Scienrific公司);其余试剂均为国产分析纯,水为去离子水。
1.3 细胞
人脑胶质细胞瘤细胞株SHG44购自上海艾研生物科技有限公司,已传至第52代。
1.4 动物
SPF级Balb/c系裸小鼠,6~8周龄,雌雄兼用,体质量为20~25 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2013-0002。动物在室内温度 20~26 ℃、湿度 40%~70%条件下饲养,自由饮食(饲料由广东省医学实验动物中心提供)。
2 方法
2.1 ARM-SMEDDS的制备
按本课题组自主研制方法制备ARM-SMEDDS[11]:以 Lauroglycol 90为油相、Cremophor RH 40 为乳化剂、Gelucire 44/14为助乳化剂,按质量比为4 ∶ 4 ∶ 2制备而得。经HPLC法[11]测得ARM的载药量为 80 mg/g。
2.2 小鼠皮下移植瘤模型的制备
取人脑胶质细胞瘤细胞株SHG44,经0.25%胰蛋白酶消化后,用PBS洗涤,计数,以无血清的DMEM培养基配制成4×106个/mL的单细胞悬液。取上述细胞悬液0.5 mL,接种于裸小鼠右腋皮下,待肿瘤形成后以组织块移植传代。按照文献方法[13-14],选择传代后2周左右且肿瘤生长良好的荷瘤裸小鼠处死,取出肿瘤组织并剪碎,采用穿刺针将大小为2 mm3的肿瘤组织植入裸小鼠右腋部,以建立裸小鼠皮下移植瘤模型。
2.3 皮下移植瘤模型小鼠肿瘤生长曲线的绘制
取按“2.2”项下方法建立皮下移植瘤模型的小鼠12只,按照SPF级标准饲养于NASA1000级生物凈化室内,分别于接种后的第5、10、15、20、25天时测量小鼠体质量及其皮下肿瘤组织的最短径(a)和最长径(b),按公式计算肿瘤组织体积(V=a2×b/2)。以接种天数为横坐标、肿瘤组织体积为纵坐标绘制肿瘤生长曲线,以肿瘤生长曲线斜率出现明显增大的时间段作为肿瘤快速增殖初期。
2.4 ARM-SMEDDS对皮下移植瘤模型小鼠的抑瘤效果考察
根据“2.3”项下建立的肿瘤生长曲线,取小鼠30只,按“2.2”项下方法建立皮下移植瘤模型,并于肿瘤快速增殖初期时进行分组试验。参考已有文献的给药剂量[15],本试验将皮下移植瘤模型小鼠分为对照组(生理盐水)、ARM混悬液组[60 mg/(kg·d),生理盐水配制,剂量以主药计]和ARM-SMEDDS低、中、高剂量组[10、20、30 mg/(kg·d),剂量以主药计],每组6只。各组小鼠分别灌胃生理盐水或ARM相应剂型药液,灌胃体积约为0.2 mL(按照小鼠体质量微调),每日1次,连续给药30 d。分别在给药前(即进入肿瘤快速增殖初期时)和末次给药结束后测定小鼠体质量,观察和记录其一般情况以及是否出现相关异常反应;自开始给药起,每5天测定小鼠的皮下肿瘤组织体积,以给药时间为横坐标、肿瘤组织体积为纵坐标绘制肿瘤组织体积变化曲线,并计算相对肿瘤增殖率:相对肿瘤增殖率(%)=末次给药后给药组小鼠的肿瘤组织体积/末次给药后对照组小鼠的肿瘤组织体积×100%。
2.5 统计学方法
采用 SPSS 21.0软件对数据进行参数计算及统计分析。计量资料以x±s表示,各组小鼠治疗前后的体质量、皮下肿瘤体积的自身对照比较采用配对t检验,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 皮下移植瘤模型小鼠肿瘤生长曲线
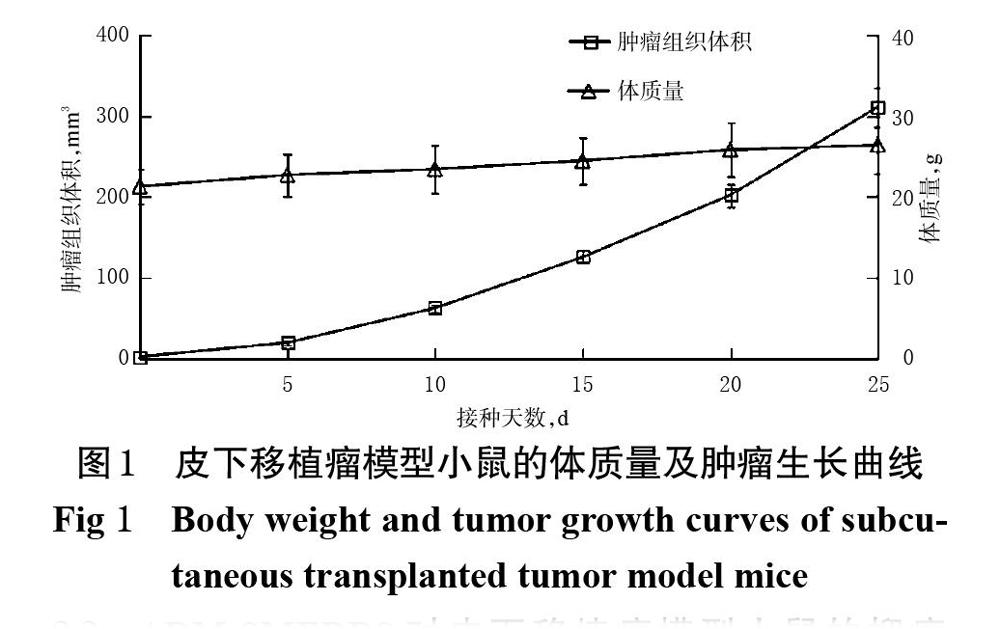
皮下移植瘤模型小鼠体质量及肿瘤生长曲线见图1。由图1可见,皮下移植瘤模型小鼠的肿瘤组织体积呈指数级增大,而体质量增长速度较平缓。肿瘤组织接种于裸小鼠后,5 d内肿瘤组织体积增长较缓,在5 d后增长速度加快,并于第10天左右进入肿瘤快速增殖初期,此时荷瘤小鼠的平均肿瘤组织体积为68.69 mm3(n=12),平均体质量为23.38 g(n=12)。因此,后续试验以接种肿瘤组织后第10天的皮下移植瘤模型小鼠进行药物抑瘤效果考察。
3.2 ARM-SMEDDS对皮下移植瘤模型小鼠的抑瘤效果
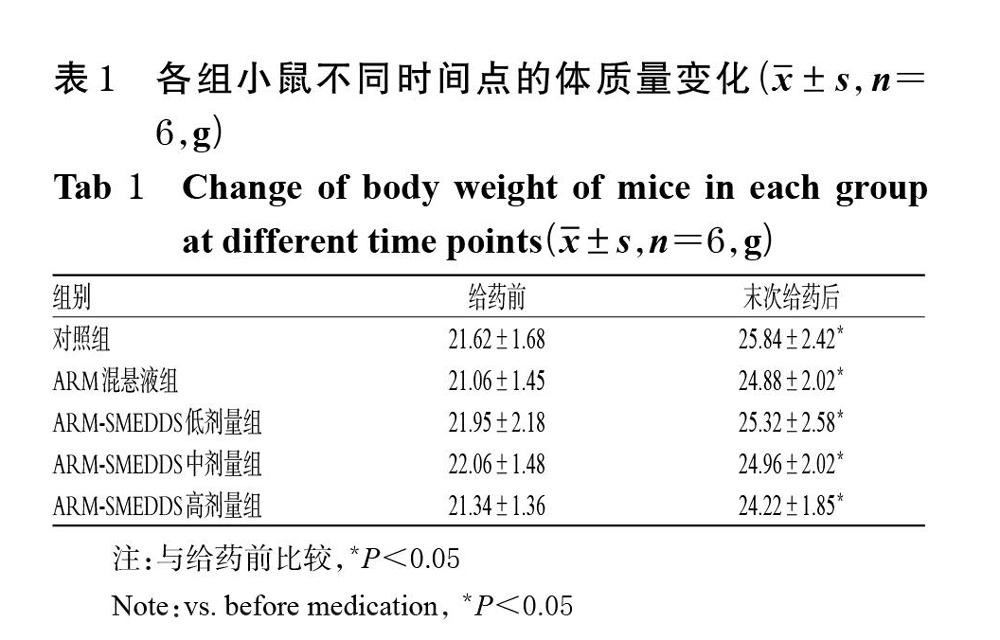
3.2.1 小鼠的体质量变化及一般情况 与给药前比较,各组小鼠末次给药后体质量均显著升高(P<0.05);各组小鼠的体质量在相同时间点组间比较的差异均无统计学意义(P>0.05)。各组小鼠给药期间一般情况正常,均未见明显的体质量降低等异常反应。各组小鼠不同时间点的体质量变化见表1。
3.2.2 小鼠肿瘤组织体积变化和相对肿瘤增殖率 各组小鼠肿瘤组织体积基本呈指数级生长;给药第5天时,各组小鼠肿瘤组织体积组间比较的差异无统计学意义(P>0.05);自给药第10天起,ARM-SMEDDS各剂量组小鼠的肿瘤组织体积较对照组显著缩小(P<0.05);自给药第15天起,ARM-SMEDDS各剂量组小鼠的肿瘤组织体积较ARM混悬液组显著缩小(P<0.05)。各组小鼠的肿瘤组织体积变化曲线见图2。
末次给药后,ARM-SMEDDS各剂量组小鼠的相对肿瘤增殖率均较ARM混悬液组显著降低(P<0.05),详见表2。
4 讨论
脑胶质瘤呈浸润性生长的患者在手术后必须进行系统化疗,由于大多数化疗药物难以透过血脑屏障且毒副作用较强,加之肿瘤细胞容易产生耐药性,因此目前脑胶质肿瘤患者的治疗效果较差。可见,进一步寻求毒副作用较小、能够通过血脑屏障的化疗药物非常重要。已有研究证实,青蒿素及其衍生物(如ARM)可抑制并杀伤脑胶质瘤细胞,且对正常细胞损伤很小[5-8],但是由于ARM口服生物利用度较低、体内代谢快、有效血药浓度维持时间短[9-10],因此研究高效、安全的ARM新型给药制剂对于其临床应用具有重要意义。近年来,ARM新型给药系统的研究已经得到了国内外学者的广泛关注[16]。
SMEDDS是由药物、油相、非离子表面活性剂和助乳化剂组成的均一澄明的混合液体,口服后在胃肠道的轻微蠕动下,能自发形成粒径小于100 nm的水包油(O/W)型微乳,可作为递药载体提高水难溶性药物的口服生物利用度、改善药物的稳定性和口感等,进而提高药物的治疗效果和患者的用药依从性[17]。在制剂过程中,选用长链脂肪酸作为表面活性剂,可促进药物的淋巴吸收,从而避免胃肠道的吸收屏障以及肝脏的首关效应[17-18]。
课题组前期对ARM-SMEDDS在大鼠体内的生物利用度进行研究时,根据已有文献设置ARM混悬液和ARM-SMEDDS的给药剂量分别为120、20 mg/kg(以主药计)[12]。由于本研究采用小鼠作为对象,考虑到不同动物间剂量转换情况及其安全性,故将小鼠的ARM混悬液和ARM-SMEDDS的每日给药剂量分别设置为60 mg/kg和10~30 mg/kg。本研究结果显示,ARM- SMEDDS以10~30 mg/(kg·d)给药后的抑瘤效果均明显优于以60 mg/(kg·d)给药的ARM混悬液,这与课题组前期研究结果,即ARM-SMEDDS经胃肠道给药后在大鼠体内生物利用度显著高于ARM混悬液是一致的。
综上所述,本课题组所设计和制备的ARM- SMEDDS具有明显的抑制人脑胶质瘤组织增长的效果,并优于剂量更高的混悬液剂型。本课题组后续将进一步针对该新剂型的透血脑屏障分布特征和治疗脑胶质瘤的效果进行研究,为ARM新型给药系统的进一步开发和应用提供依据。
参考文献
[ 1 ] 李红娟.青蒿素衍生物蒿甲醚抗癌机理的研究[D].昆明:云南大学,2016.
[ 2 ] 农大件,李国成.周围神經胶质瘤的治疗研究进展[J].中药医药指南,2013,11(26):58-60.
[ 3 ] CHOI PJ,TUBBS RS,OSKOUIAN RJ. Emerging cellular therapies for glioblastoma multiforme[J]. Cureus,2018.DOI:10.7759/cureus.2305.
[ 4 ] MISHRA M,MISHRA VK,KASHAW V,et al.Comprehensive review on various strategies for antimalarial drug discovery[J]. Eur J Med Chem,2017. DOI:10.1016/j.ejmech.2016.11.025.
[ 5 ] 李琛琛,尹昆,闫歌.抗疟药青蒿素及其衍生物相关药理作用研究进展[J].中国病原生物学杂志,2016,11(2):185-188.
[ 6 ] YAO Y,GUO Q,CAO Y,et al. Artemisinin derivatives inactivate cancer-associated fibroblasts through suppressing TGF-β signaling in breast cancer[J]. J Exp Clin Cancer Res,2018. DOI:10.1186/s13046-018-0960-7.
[ 7 ] ALCANTARA DD,RIBEIRO HF,CARDOSO PC,et al. In vitro evaluation of the cytotoxic and genotoxic effects of artemether,an antimalarial drug,in a gastric cancer cell line(PG100)[J]. J Appl Toxicol,2013,33(2):151-156.
[ 8 ] MANNING L,LAMAN M,PAGE-SHARP M,et al. Me- ningeal inflammation increases artemether concentrations in cerebrospinal fluid in Papua New Guinean children treated with intramuscular artemether[J]. Antimicrob Agents Chemother,2011,55(11):5027-5033.
[ 9 ] 邱玉琴,李春,張锁慧,等.蒿甲醚可溶解微针透皮贴片的制备和评价[J].今日药学,2016,26(8):532-537.
[10] 洪宗国,王东,吴林玉.蒿甲醚的纳米包装[J].中南民族大学学报(自然科学版),2012,31(1):55-57.
[11] 张亚红,林凤云,邱妍川,等.蒿甲醚自微乳化释药系统的制备及体外评价[J].第三军医大学学报,2013,35(21):2348-2351.
[12] 张亚红,唐倩,刘耀,等.自微乳化给药系统提高蒿甲醚大鼠的口服生物利用度[J].第三军医大学学报,2014,36(14):1481-1485.
[13] 吴自成,董军,项朝辉,等.替莫唑胺缓释微球治疗胶质瘤皮下移植瘤的实验研究[J].苏州大学学报(医学版),2010,30(5):910-914.
[14] YUAN DS,CHEN YP,TAN LL,et al. Artemisinin:a pa- nacea eligible for unrestrictive use?[J]. Front Pharmacol,2017. DOI:10.3389/fphar.2017.00737.
[15] PHAN TNQ,LE-VINH B,EFIANA NA,et al. Oral self- emulsifying delivery systems for systemic administration of therapeutic proteins:science fiction? [J]. J Drug Target,2019. DOI:10.1080/1061186X.2019.1584200.
[16] ZANUTTO FV,MCALISTER E,TANGERINA MMP,et al. Semisynthetic derivative of artemisia annua-loaded transdermal bioadhesive for the treatment of uncomplica- ted malaria caused by plasmodium falciparum in children[J]. J Pharm Sci,2019,108(3):1177-1188.
[17] 马俐丽.普罗布考自微乳化释药系统的研究[D].重庆:重庆医科大学,2009.
[18] 庞长河,杜伟,王栋梁,等.双氢青蒿素通过蛋白激酶 B 通路及线粒体途径诱导胶质瘤细胞凋亡[J].中华实验外科杂志,2015,32(3):531-533.
(收稿日期:2019-04-15 修回日期:2019-12-02)
(编辑:段思怡)

