基于哺乳动物细胞表达系统的猪瘟基因工程E2亚单位疫苗动物免疫效果评价
颜仁和,刘 蕾,王升尧,李安迪,万鹏飞,仇珍珍,范根成,李红卫,杜元钊∗,高永新∗
(1.广州伯尼兹生物科技有限公司,广东 广州510663;2.青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室,山东 青岛266032;3.南方医科大学 检验与生物技术学院,广东 广州510515)
猪瘟是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种以发热、拉稀、肠道发炎为主要症状的急性接触性传染病,具有高度传染性和致死性[1]。猪瘟仍然是当前中国养猪业的头号大敌,给养猪业造成了严重的经济损失。免疫接种是防止猪瘟蔓延最有效的方法,猪瘟兔化弱毒疫苗的广泛应用使得猪瘟的传播得到了显著控制[2]。然而近年来,我国猪瘟的流行形式和传播特点发生了很大的改变,散发流行、发病幼龄化、非典型病例增多、传播方式多样化等发生特点使得猪瘟的免疫和防治面临着新的挑战[3]。目前,猪瘟流行地区或国家仍然采用接种弱毒疫苗的方法作为预防猪瘟的主要策略,其中由中国科学家研究成功的猪瘟兔化弱毒疫苗(C株)是世界上公认的最好的猪瘟疫苗,对世界范围内猪瘟防控做出了卓著贡献。用猪瘟弱毒疫苗免疫的猪与自然感染猪瘟野毒的猪无法在免疫学上区分开来,显然该疫苗将无法用于猪场净化及猪瘟在我国的最终根除计划,为了消灭猪瘟、净化猪场,新型标记性疫苗的研究已迫在眉睫[4]。
目前研究较多的新型猪瘟疫苗主要包括基因工程亚单位疫苗、核酸疫苗、基因缺失疫苗及活载体疫苗等。其中,基因工程亚单位疫苗因其安全、有效、便于操作等优点而被认为是最具应用前景的新型猪瘟疫苗[5]。囊膜糖蛋白E2是CSFV 的1个结构蛋白,参与病毒感染过程,并能诱导机体产生保护性中和抗体对抗CSFV 野毒株,而且很容易通过检测抗CSFV Erns蛋白的抗体来区分疫苗免疫猪和野生毒株感染猪,评估猪场清净度,因此是猪瘟亚单位疫苗研制的首选结构蛋白[6]。
获得高纯度的E2蛋白是E2亚单位疫苗研发的重要基础,目前,E2蛋白已经在多个表达系统中成功表达,包括大肠杆菌表达系统、昆虫细胞表达系统、酵母表达系统等[7]。本课题组在前期研究中建立了一种基于人胚肾细胞HEK-293T 的E2分泌性表达系统,为猪瘟E2亚单位疫苗的研究奠定了基础。本研究拟在前期工作基础上,进一步在体内验证E2亚单位疫苗的免疫效果。
1 材料与方法
1.1 细胞稳定表达CSFV E2蛋白的重组细胞系HEK-293T-E2由本公司构建保存。
1.2 细胞培养基DMEM 培养基由Corning公司生产;胎牛血清购自美国Gibco公司。细胞生长液为含10%胎牛血清的DMEM 培养基。
1.3 检测试剂盒猪瘟抗体阻断ELISA 试剂盒购自美国IDEXX 公司。
1.4 试验动物1.5~3.0 kg 健康易感(CSFV ELISA 抗体阴性)兔和健康易感断奶仔猪(CSFV ELISA 抗体阴性,CSFV、猪圆环病毒2型和猪繁殖与呼吸综合征病毒抗原阴性)均来自青岛易邦生物工程有限公司;相关动物试验均在该公司动物中心进行。
1.5 重组CSFV E2蛋白的生产及纯化将本实验室保存的HEK-293T-E2细胞系扩增至15 cm 细胞培养皿中,经胰蛋白酶-EDTA 消化后,用含10%胎牛血清的DMEM 培养基重悬细胞,以1×107个/m L的密度传代至15 cm 细胞培养皿中,置37℃、5%CO2培养。当长成良好单层时,弃去原培养液,加入无血清培养基继续培养4 d 后收集细胞培养液,以4 000 r/min离心5 min,收集细胞上清液,利用His Trap HP 柱层析方法纯化蛋白;SDS-PAGE检测纯化蛋白的纯度;BCA 方法测定纯化后蛋白质量浓度。
1.6 E2蛋白免疫原性的鉴定
1.6.1 对兔的免疫原性 将纯化后的E2蛋白液用生理盐水稀释至蛋白质量浓度为50 mg/L,加入等量201 VG 佐剂,制备疫苗。选体温稳定的健康易感兔10只,随机分为2组,每组5只。第1组为免疫组,各皮下注射第1 代HEK-293T-E2 细胞表达的E2蛋白液所制备的疫苗0.1 m L,第2组不免疫作为对照组。免疫后21 d采血,检测CSFV ELISA抗体。
1.6.2 对猪的免疫原性 将纯化后的E2蛋白液用生理盐水稀释至蛋白质量浓度为50 mg/L,加入等量201 VG 佐剂,制备疫苗。用健康易感(猪瘟抗原、ELISA 抗体均为阴性)猪10头,随机分为2组,每组5头。第1组为免疫组,各颈部肌肉注射疫苗1.0 m L,一免后21 d用相同的疫苗,同等剂量进行二免,第2组以免疫PBS作为对照组。二免后14 d,采血,检测CSFV ELISA 抗体,然后所有猪颈部肌肉注射CSFV 石门系血毒1.0 m L(含不少于105.0MLD),观察16 d。观察期内如有死亡猪,立即剖检,剩余试验猪试验结束时(攻毒后16 d)全部剖检,记录试验结果。
2 结果
2.1 重组CSFV E2蛋白的纯度和浓度分析将纯化后的E2蛋白经SDS-PAGE 鉴定纯度,结果如图1所示;Image Lab 软件分析表明E2 蛋白纯度在91.8%左右;BCA 结果测得纯化后蛋白质量浓度为232.7 mg/L。
2.2 E2蛋白对兔的免疫原性结果免疫组共5只兔,免疫后21 d抗体检测结果显示,免疫组抗体均为阳性,阻断率均高于60%,而对照组抗体均为阴性,阻断率均在30%以下(表1)。
2.3 E2蛋白对猪的免疫原性结果免疫组5头仔猪抗体均为阳性,阻断率均高于80%以上,对照组抗体均为阴性,阻断率均在30%以下(表2)。攻毒后所有试验猪连续观察16 d,每日测定体温2次,观察采食、饮水、精神等有无局部或全身不良反应,结果显示免疫组在观察期内无明显的体温变化,也没有采食、饮水、精神等局部或全身不良反应,且全部健活;对照组攻毒后1 d就有3头体温明显升高,且能观察到饮食下降及腹泻等不良反应,从攻毒后9 d开始有猪死亡,整个观察期内5头对照猪均有明显发热反应,共死亡5头(图2)。
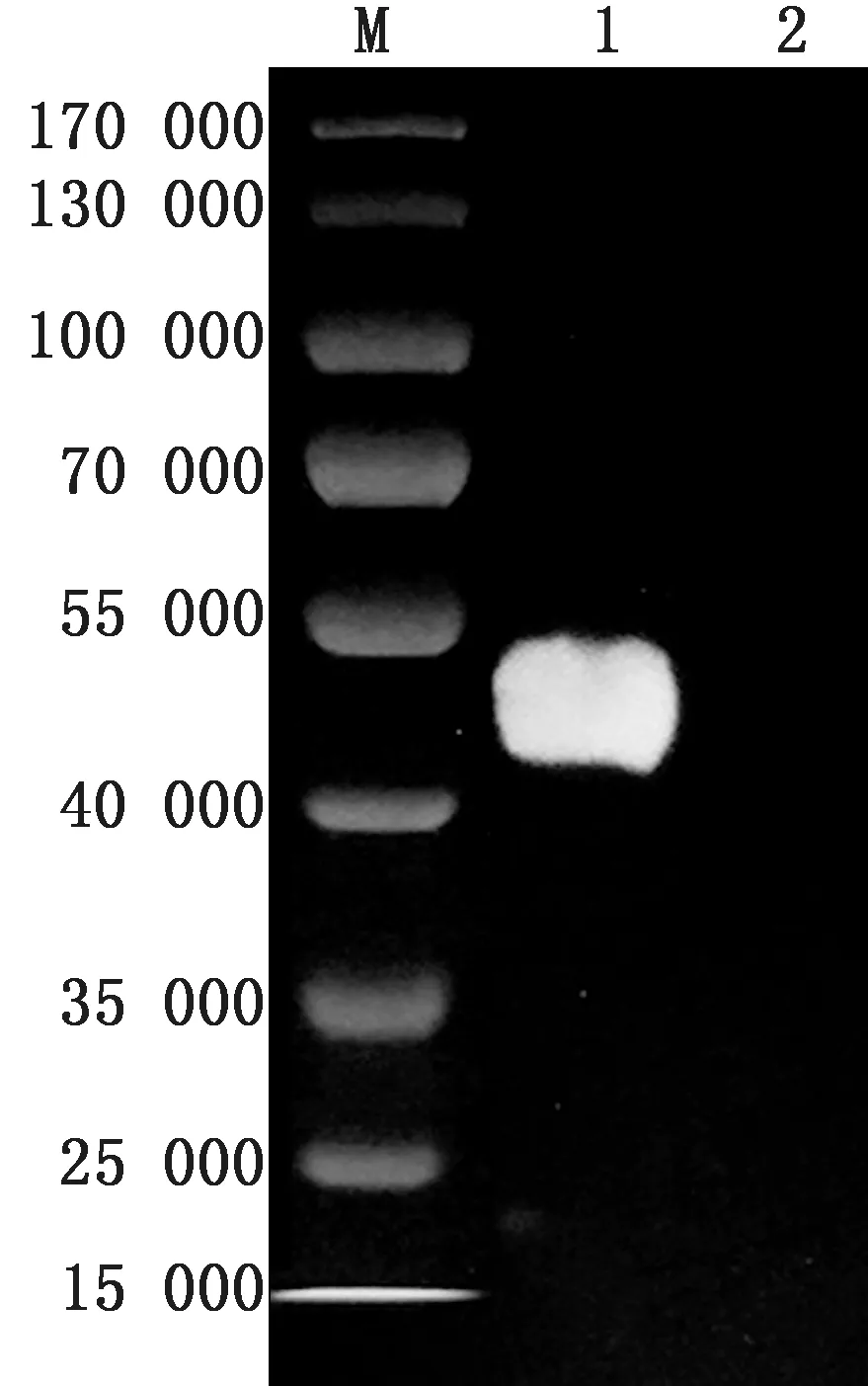
图1 SDS-PAGE检测E2蛋白纯度 M.蛋白相对分子质量Marker;1.E2纯化蛋白;2.空白对照
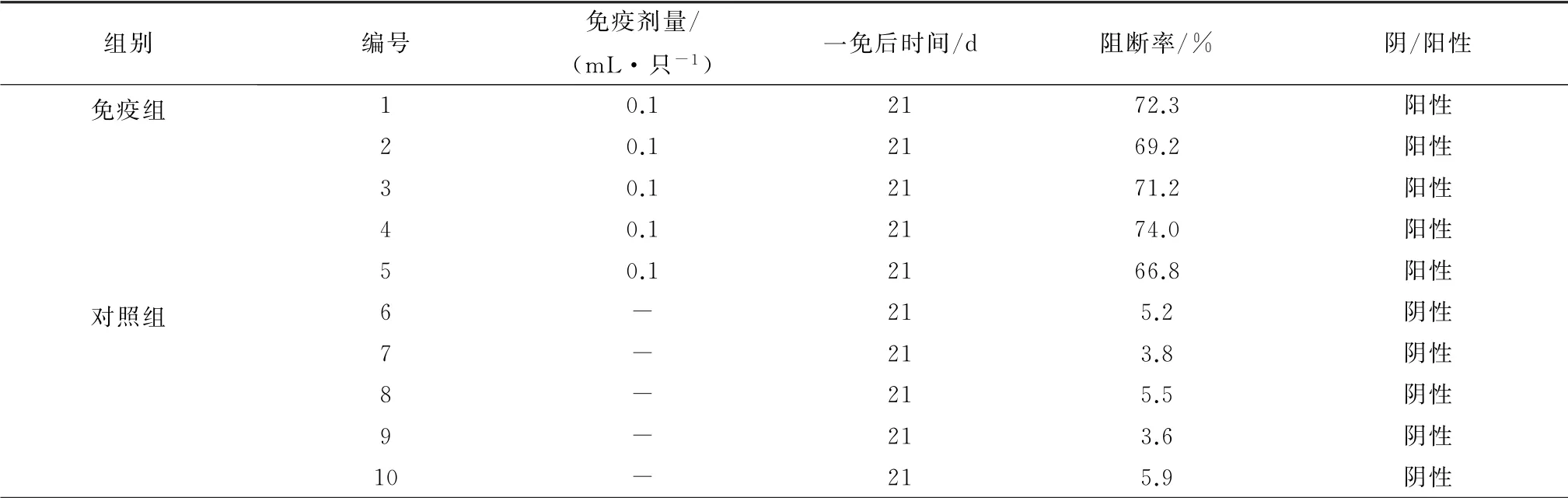
表1 E2蛋白对试验兔免疫原性检测结果
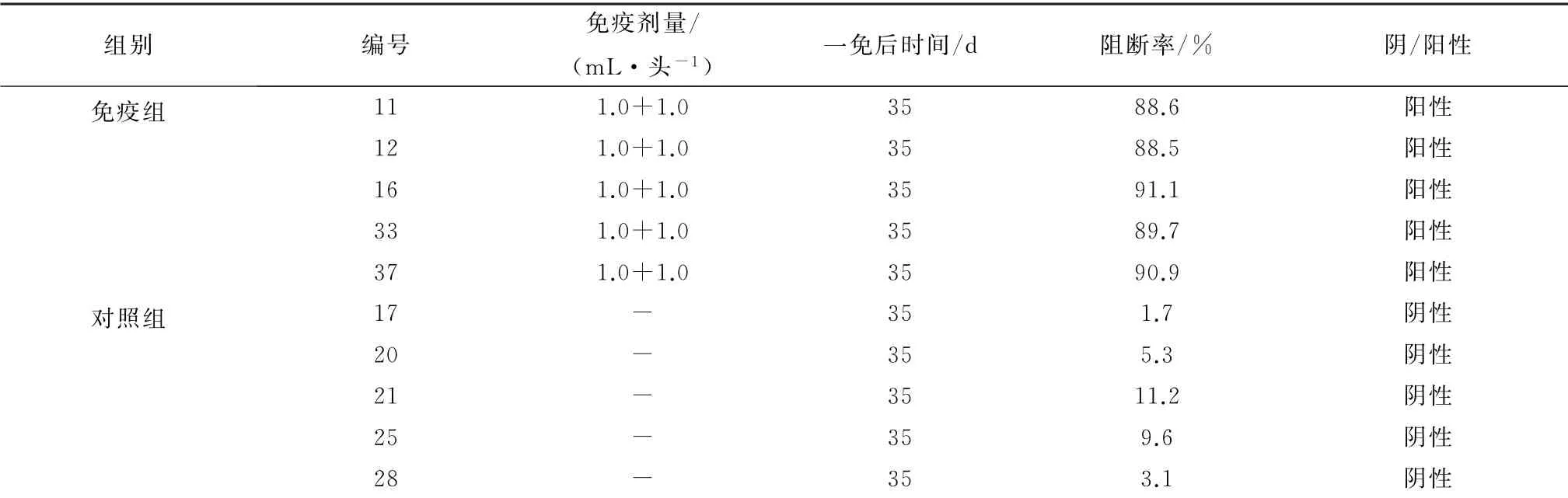
表2 E2蛋白对试验猪免疫原性检测结果
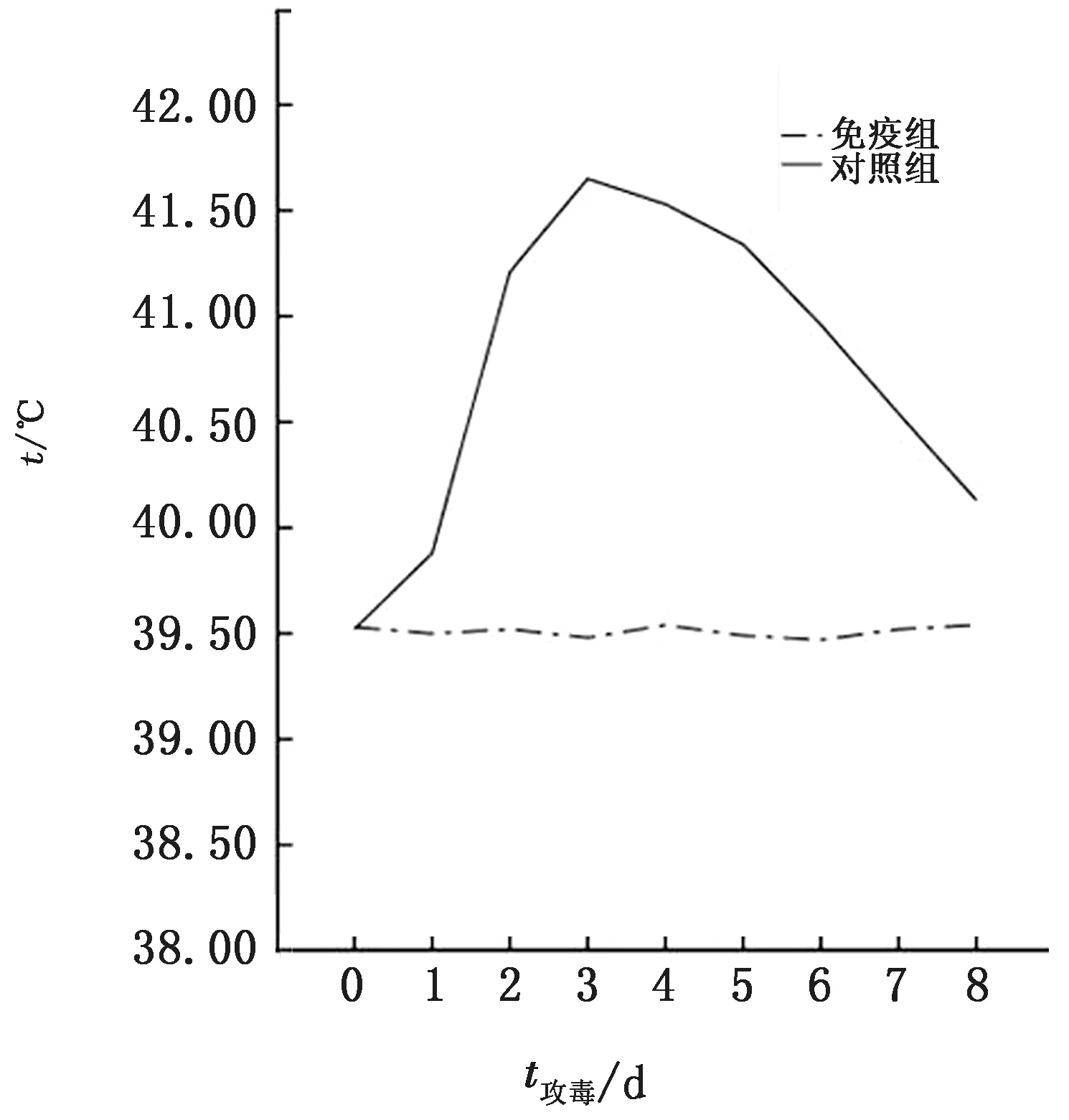
图2 E2蛋白免疫试验猪体温测定结果
3 讨论
E2蛋白作为CSFV 的主要结构蛋白,在机体抗CSFV 的免疫保护中起着重要作用。我国多年来致力于E2亚单位疫苗的研制,并取得了重要进展[8]。进一步提高E2抗原的免疫原性和安全性,是促进E2亚单位疫苗发展的动力[9]。本课题组在前期研究中成功建立了一种稳定表达E2蛋白的哺乳动物细胞系HEK-293T-E2,该细胞系能高效表达分泌性的重组E2 蛋白,为E2 亚单位疫苗研制打下了基础。本研究进一步在试验动物体内验证E2蛋白的免疫原性,将纯化后的E2蛋白液用生理盐水稀释至蛋白质量浓度为50 mg/L,按质量比1∶1比例加入SEPPIC ISA 201 VG 佐剂,制备疫苗。先用兔对其免疫原性进行检验,结果显示免疫兔全部阳性反应,对照组兔均为阴性反应。然后用10头健康易感仔猪进行免疫攻毒试验,结果发现免疫组5头仔猪,一免后35 d(二免后14 d)抗体全部转阳且阻断率均高于80%,并在攻毒后,在观察期内无明显的体温变化,无死亡;对照组攻毒后1 d起就有3头体温明显升高,整个观察期内5头对照猪均有明显发热反应,共死亡5头。以上结果表明我们构建的HEK-293T-E2细胞系表达的CSFV E2蛋白具有较好的免疫原性,免疫猪后能有效抵抗强毒的侵袭。
本研究建立的HEK-293T-E2 细胞系,能够稳定表达分泌性重组E2蛋白,解决了真核表达系统产量低、生产成本高等缺点,并简化了重组蛋白纯化过程。利用该系统生产的E2亚单位疫苗能成功诱导仔猪只产生抗CSFV E2的特异性抗体,而传统猪瘟疫苗免疫猪只后,体内只可产针对E2蛋白和Erns蛋白的特异性抗体,因此本疫苗可作为标记性疫苗,以通过检测Erns抗体来区分疫苗免疫和野毒感染(DIVA),剔除种群内带毒猪只,最终达到净化猪场消灭猪瘟,且无明显毒性反应。本研究具有很好的临床应用价值,为后续E2亚单位疫苗的推广应用打下了良好的基础。

