HBx介导SOCS-1基因甲基化致肝细胞癌发生的机制
龙云铸 贺萧瑾 李丹 周娟 周青 谭英征
肝细胞癌(HCC)是临床上常见的恶性肿瘤,我国HCC的发生与HBV感染关系密切[1]。HBV是由双链DNA构成的病毒,包含四个重叠的编码基因区域,其中,HBV X基因(HBx基因)可通过抑制抑癌基因的表达而导致HCC的发生[2],但HBx基因发挥作用的具体机制仍不清楚。在多种抑癌基因中,细胞因子信号转导抑制蛋白-1(SOCS-1)基因发挥重要的调控作用,SOCS-1基因启动子区域甲基化可促进多种肿瘤细胞的增殖和转移[3]。我们推测HBx基因可能通过抑制SOCS-1基因表达而起作用。本研究主要利用细胞转染及甲基化PCR技术,探究HBx介导SOCS-1基因甲基化致HCC发生的机制。
资料与方法
一、材料
(一)细胞系 人正常肝细胞系L-02,购于通派生物科技有限公司。
(二)主要试剂 胎牛血清、MEM培养基(Gibco Life Technologies);HBx质粒(上海吉玛制药有限公司);MTT细胞活力检测试剂盒、SYBR Green qPCR Mix试剂盒(上海碧云天生物技术有限公司);Transwell小室(美国康宁公司);RNA逆转录试剂盒、SOCS-1基因甲基化扩增试剂盒、引物序列合成(上海杰美基因医药科技有限公司),见表1;小鼠抗人HBX单抗、小鼠抗人SOCS-1单抗、兔抗小鼠二抗(圣克鲁斯生物技术有限公司)。
(三)主要仪器 细胞培养箱(上海培因实验仪器有限公司);酶标仪(Thermo Scientific MultiSkan Go);实时荧光定量PCR仪(美国应用生物系统公司);凝胶成像仪(美国Bio-Rad公司)。
二、方法
(一)细胞培养 将L-02细胞使用含10%胎牛血清的MEM培养基,放置在无菌培养箱中常规培养,培养温度为37 ℃,CO2浓度为5%,每4天传代一次。
(二)细胞分组及细胞转染 (1)细胞分组:在进行转染前,将培养在96孔板或6孔板的细胞分为对照组、空载质粒转染组、HBx质粒转染组。(2)细胞转染:当L-02细胞汇合度达到60%时,取2个2 mL无菌EP管,加入250 μL MEM培养基,再加入7 μL Lipofectamine 2 000,轻轻混匀。在这两个EP管中分别加入3 μL空载质粒、3 μL HBx质粒,轻轻混匀,静置20 min。将含有3 μL空载质粒的混合液加入空载质粒转染组,将含有3 μL HBx质粒的混合液加入HBx质粒转染组,对照组细胞中只加入与其他两组体积相同的MEM培养基,培养6 h后,将培养液换成含10%胎牛血清的MEM培养基,再培养24 h后进行相关实验。
(三)MTT法检测细胞增殖能力[4](1)将L-02细胞按5×103个/孔的数目接种于96孔板中,24 h后,按方法(二)步骤进行处理。(2)将96孔板中的细胞培养液吸取干净,每孔加入20 μL MTT溶液,放置在培养箱中孵育4 h。(3)将96孔板中液体倒掉,每孔加入150 μL DMSO溶液,震荡5 min,使紫色反应产物彻底溶解。(4)将酶标仪检测波长设置为490 nm,上机测定各组细胞的吸光度(OD),细胞OD值越大,细胞增殖能力越强,实验重复6次。
(四)Transwell小室法检测各组细胞迁移能力[5](1)将L-02细胞按3×104个/孔的数目接种于6孔板中,培养24 h,按方法(二)步骤对细胞进行处理。(2)取出6孔板,加入0.25%胰酶消化细胞,各组细胞经离心后,加入MEM培养基重悬细胞。(3)对离心管中的细胞计数,并调整离心管中的细胞浓度(细胞浓度为1.5×105个/mL)。(4)从离心管中吸取100 μL细胞悬液,加入Transwell小室中,置入培养箱培养12 h。(5)固定:取出小室后,使用95%乙醇溶液将细胞固定15 min。(6)染色:将0.1%的结晶紫溶液滴加在细胞表面,使细胞全部浸在染液中,10 min后,使用PBS对细胞清洗3次,晾干。(7)观察计数:用倒置显微镜进行观察,随机选取5个视野计算穿过膜的细胞数,穿过膜的细胞数越多,细胞迁移能力越强,重复6次。

表1 引物序列
(五)RT-qPCR法检测各组细胞HBX mRNA及SOCS-1 mRNA水平 (1)将L-02细胞接种于6孔板中,按方法(二)步骤进行转染。(2)收集各组细胞,添加TRIzol试剂提取各组细胞的总RNA,随后对总RNA进行逆转录。(3)按照试剂盒方法配制Mix及反应体系。(4)对cDNA进行扩增,扩增条件为:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共计50个循环反应。(5)采用2-ΔΔCt法计算相对表达量,实验重复6次。
(六)Western blot法检测各组细胞中HBX及SOCS-1蛋白水平 (1)将L-02细胞接种于6孔板中,按方法(二)步骤进行转染。(2)收集各组细胞,加入细胞裂解液,使用超声破碎仪裂解细胞,经低温高速离心后,使用BCA蛋白定量试剂盒调整蛋白浓度。(3)上样,进行SDS-PAGE凝胶电泳,转膜,使用2% BSA溶液封闭。(4)在4 ℃条件下孵育小鼠抗人HBx单抗(1∶1 000)及小鼠抗人SOCS-1单抗(1∶1 000)。(5)12 h后,在室温条件下,孵育兔抗小鼠二抗(1∶5 000),孵育2 h。(6)在凝胶成像仪中成像拍照,使用Image J软件进行分析,实验重复6次。
(七)甲基化PCR法检测各组细胞SOCS-1基因甲基化水平[6](1)将L-02细胞接种于6孔板中,按方法(二)步骤进行转染。(2)收集并提取各组细胞总DNA。(3)使用甲基化扩增试剂对SOCS-1基因的甲基化(M)引物及非甲基化(U)引物进行扩增。扩增条件:95 ℃变性45 s, 60 ℃退火50 s, 72 ℃延伸60 s,共计40个循环反应。(4)配制2%琼脂糖凝胶,对PCR扩增产物进行电泳,使用UVP凝胶成像仪拍照。(5)使用Image J软件分析SOCS-1基因甲基化水平,实验重复6次。(6)按照下列公式计算SOCS-1基因甲基化水平。公式:SOCS-1基因甲基化水平=灰度值M/(灰度值M+灰度值U)。
三、统计学分析
应用SPSS 21.0软件进行统计学分析。计量资料均服从正态分布,结果以均数±标准差表示。多组间均数的比较采用单因素方差分析,组间两两比较采用S-N-K检验。P<0.05为差异具有统计学意义。
结 果
一、各组细胞增殖能力比较
对照组、空载质粒转染组、HBx质粒转染组细胞的OD值分别为0.48±0.12、0.50±0.14、0.88±0.13,差异具有统计学意义(F=21.07,P<0.001)。空载质粒转染组与对照组细胞OD值比较,差异无统计学意义(q=0.4073,P>0.05)。HBx质粒转染组细胞OD值高于空载质粒转染组(q=7.7388,P<0.05)。
二、各组细胞迁移能力比较结果
对照组、空载质粒转染组、HBx质粒转染组穿过小室膜的细胞数目分别为148.31±6.92、151.27±8.22、229.18±11.37,差异具有统计学意义(F=154.68,P<0.001)。其中,空载质粒转染组与对照组穿过小室膜的细胞数目相比,差异无统计学意义(q=0.8028,P>0.05)。HBx质粒转染组穿过小室膜的细胞数目多于空载质粒转染组(q=21.1293,P<0.05)。
三、各组细胞HBx mRNA及SOCS-1 mRNA水平比较结果
对照组、空载质粒转染组、HBx质粒转染组细胞HBx mRNA及SOCS-1 mRNA水平比较,差异具有统计学意义(F=95.29、26.95,P<0.01)。空载质粒转染组与对照组细胞中HBx mRNA及SOCS-1 mRNA水平比较,差异均无统计学意义(q=0.304 6、0.315 4,P>0.05)。HBx质粒转染组细胞中HBx mRNA水平高于空载质粒转染组(q=17.057 8,P<0.05),HBx质粒转染组细胞中SOCS-1 mRNA水平低于空载质粒转染组(q=9.145 2,P<0.05)。
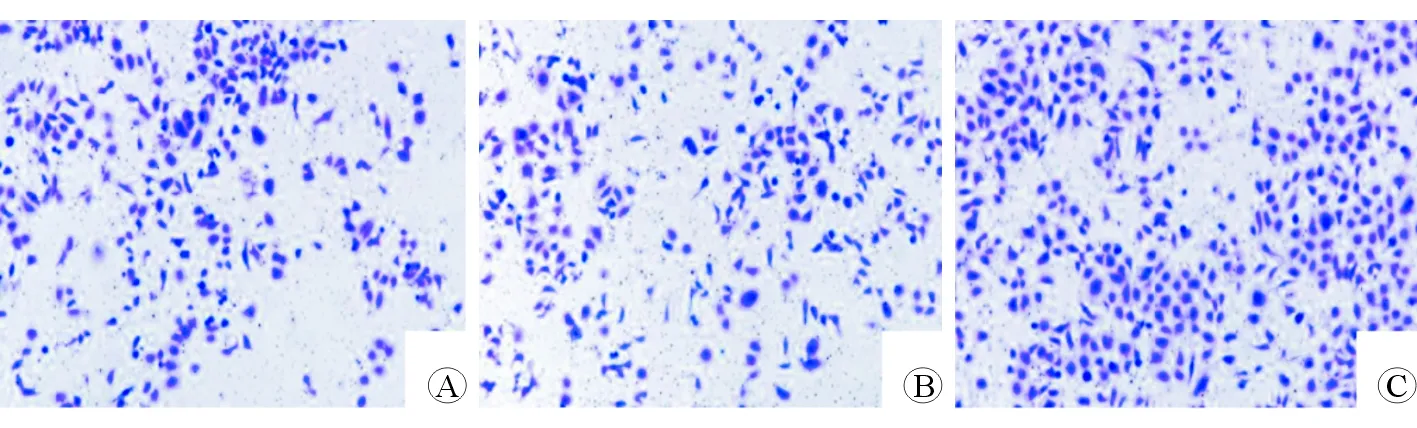
A:对照组,B:空载质粒转染组,C:HBx质粒转染组
图1各组细胞迁移能力(×100)

表2 各组细胞HBx mRNA及SOCS-1 mRNA水平比较结果(n=6)
注:与对照组相比,aP<0.05;与空载质粒转染组相比,bP<0.05
四、各组细胞中HBX及SOCS-1蛋白水平比较
各组细胞HBX及SOCS-1蛋白水平比较,差异具有统计学意义(F=149.88、154.74,P<0.01)。空载质粒转染组细胞内HBX及SOCS-1蛋白水平与对照组比较,差异均无统计学意义(q=0.226 8、1.923 7,P>0.05)。HBx质粒转染组细胞内HBX蛋白水平高于空载质粒转染组,差异有统计学意义(q=21.090 4,P<0.05)。HBx质粒转染组细胞内SOCS-1蛋白水平低于空载质粒转染组(q=22.442 8,P<0.05)。

A:对照组,B:空载质粒转染组,C:HBx质粒转染组
图3各组细胞中HBX及SOCS-1蛋白水平

表3 各组细胞中HBX及SOCS-1蛋白水平比较结果(±s, n=6)
注:与对照组相比,aP<0.05;与空载质粒转染组相比,bP<0.05
五、各组细胞SOCS-1基因甲基化水平比较
对照组、空载质粒转染组、HBx质粒转染组细胞SOCS-1基因甲基化水平分别为0.23±0.09、0.21±0.08、0.88±0.11,差异具有统计学意义(F=98.32,P<0.001)。空载质粒转染组与对照组细胞SOCS-1甲基化水平比较,差异无统计学意义(q=0.520 3,P>0.05)。HBx质粒转染组细胞SOCS-1甲基化水平高于空载质粒转染组,差异有统计学意义(q=17.428 9,P<0.05)。
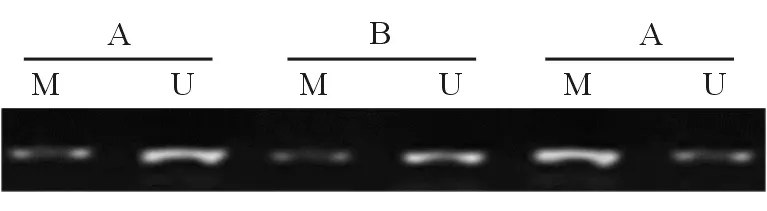
A:对照组;B:空载质粒转染组;C:HBx质粒转染组
图4各组细胞SOCS-1基因甲基化水平比较结果
讨 论
本研究将HBx质粒转入L-02细胞内后,L-02细胞的增殖、迁移能力均明显增强。HBx基因对L-02细胞增殖迁移能力的影响与HBx基因对HCC细胞的影响一致。研究者继续对L-02细胞中SOCS-1基因的表达水平进行检测。RT-qPCR结果显示,经HBx质粒转染后的L-02细胞内HBx mRNA水平升高、SOCS-1 mRNA水平降低。Western blot实验表明,经HBx质粒转染的L-02细胞内HBX蛋白水平上升、SOCS-1蛋白水平降低,HBX及SOCS-1蛋白水平的变化与HBx mRNA及SOCS-1 mRNA水平变化情况一致。上述结果表明,HBx基因可以通过促进SOCS-1基因启动子发生甲基化,抑制L-02细胞内SOCS-1基因的表达。本研究通过甲基化PCR法检测了各组细胞中SOCS-1基因启动子甲基化水平,结果显示,经HBx质粒转染的L-02细胞中SOCS-1基因启动子甲基化水平明显升高。
综上所述,L-02细胞经HBx质粒转染后,细胞中HBx mRNA水平和SOCS-1基因启动子甲基化水平升高,SOCS-1 mRNA及SOCS-1蛋白表达水平降低,L-02细胞增殖、迁移能力异常增强,从而导致HCC发生。但本研究仅从细胞水平进行了相关研究,在未来的研究中,我们将会利用动物实验对HBx基因、SOCS-1基因甲基化及HCC三者的关系进行研究。

