结直肠肿瘤患者术后发生代谢性酸中毒的危险因素
诸虹 孙明霞 朱桂松
南京市中医院(南京210001)
结直肠癌是世界范围内常见的肠道恶性肿瘤,近年来发病率呈上升趋势[1],目前外科手术仍是结直肠癌治疗最重要的手段之一。有研究统计,在经历重大外科手术的患者中,术后约78%的患者发生了严重的代谢性酸中毒(metabolic acidosis,MA)[2],笔者在临床工作中也发现有部分结直肠肿瘤术后患者发生了不同程度的MA,使得脱机拔管时间延长,而关于其发生的原因鲜有报道。本研究回顾性分析了我院105例结直肠肿瘤术后患者,探讨结直肠肿瘤术后发生MA的危险因素。现报道如下。
1 资料与方法
1.1 临床资料 收集南京市中医院2019年1-8月结直肠肿瘤根治术患者105例,纳入标准:(1)病例资料完整;(2)结直肠肿瘤行手术治疗者。排除标准:(1)病例资料不全者;(2)既往有内分泌相关疾病,如甲亢等;(3)术前检查发现严重呼吸、肾功能不全者;(4)年龄≤18岁。
1.2 研究方法 患者术前完善相关检查,签署手术知情同意,术毕麻醉未醒,气管插管接简易呼吸气囊转运至ICU,立即抽取动脉血气分析(血气分析仪:Roche cobas b221),综合评估pH、HCO3-、BE等结果,发生代谢性酸中毒58例,未发生代谢性酸中毒47例。收集两组患者年龄、性别、身高、病史等一般资料,以及术前尿素、肌酐、血浆白蛋白、碳酸氢盐、血红蛋白水平、手术方式、术中血糖、血钾水平等资料,作比较分析。
1.3 统计学方法 数据采用SPSS 22.0进行统计分析。计量资料采用()表示,用t检验进行比较,计数资料用χ2检验比较。对诸多危险因素进行单因素分析,筛选出有统计学意义的因素采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 结直肠肿瘤术后发生MA的危险因素分析 与未发生MA的患者相比,MA组低蛋白血症例数更多,手术时间更长,术中补液速度较低(P<0.05)。见表1。
2.2 Logistic回归分析 结直肠肿瘤术后发生MA的危险因素将低蛋白血症、手术时间、补液速度3个变量纳入Logistic多因素回归分析模型,其中手术时间、低蛋白血症均转换为分类变量,予赋值[手术时间:0=(< 3 h),1=(≥ 3 h):血浆白蛋白:1=(≥ 35 g/L):0=(< 35 g/L)]。结果显示,手术时间、低蛋白血症是结直肠肿瘤术后发生MA的独立危险因素(P<0.05)。见表2。
表1 结直肠肿瘤术后发生MA的危险因素分析Tab.1 Analysis of risk factors of metabolic acidosis in patients with colorectal cancer after operation ±s
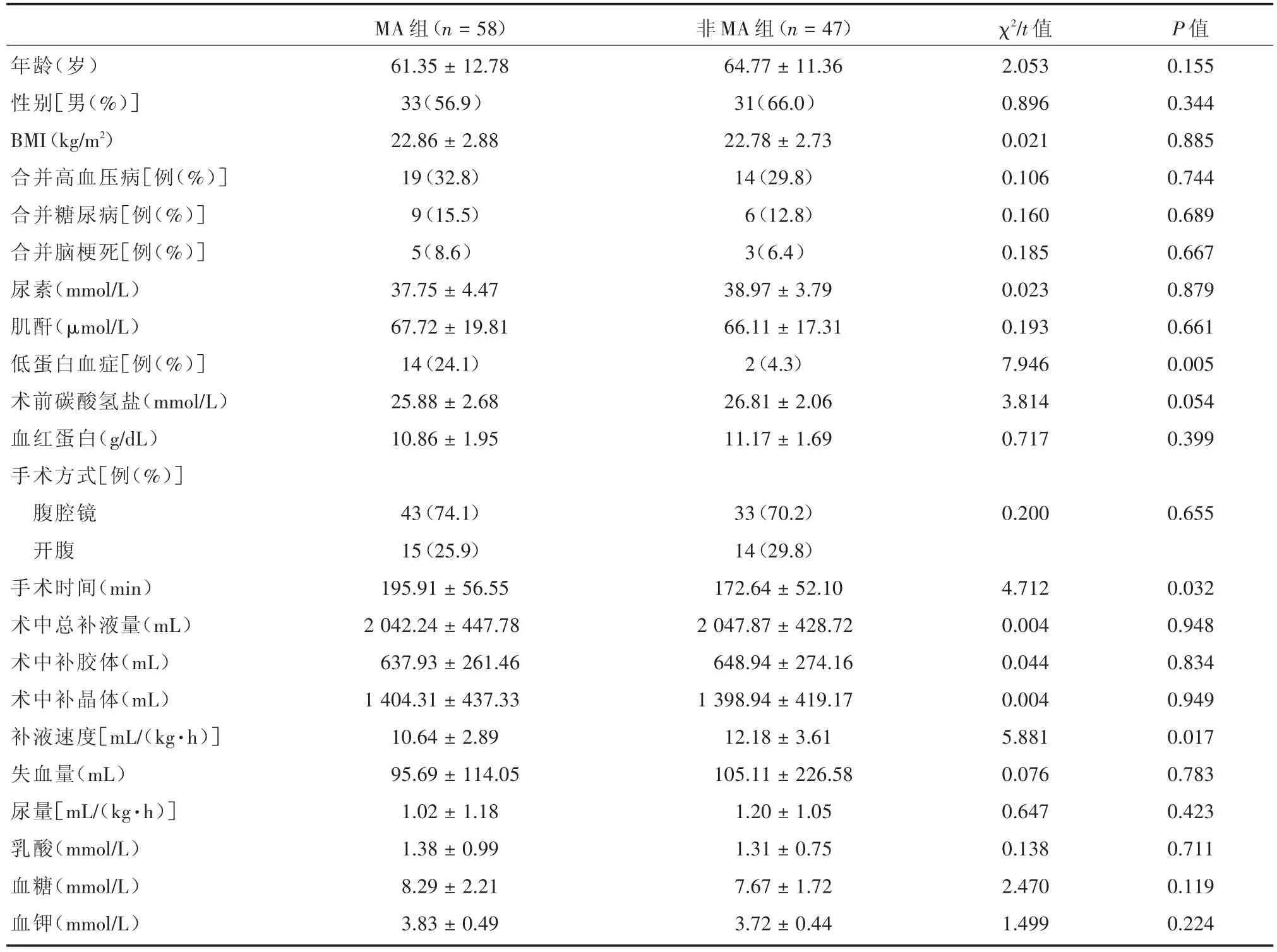
表1 结直肠肿瘤术后发生MA的危险因素分析Tab.1 Analysis of risk factors of metabolic acidosis in patients with colorectal cancer after operation ±s
年龄(岁)性别[男(%)]BMI(kg/m2)合并高血压病[例(%)]合并糖尿病[例(%)]合并脑梗死[例(%)]尿素(mmol/L)肌酐(μmol/L)低蛋白血症[例(%)]术前碳酸氢盐(mmol/L)血红蛋白(g/dL)手术方式[例(%)]腹腔镜开腹手术时间(min)术中总补液量(mL)术中补胶体(mL)术中补晶体(mL)补液速度[mL/(kg·h)]失血量(mL)尿量[mL/(kg·h)]乳酸(mmol/L)血糖(mmol/L)血钾(mmol/L)MA组(n=58)61.35±12.78 33(56.9)22.86±2.88 19(32.8)9(15.5)5(8.6)37.75±4.47 67.72±19.81 14(24.1)25.88±2.68 10.86±1.95非MA组(n=47)64.77±11.36 31(66.0)22.78±2.73 14(29.8)6(12.8)3(6.4)38.97±3.79 66.11±17.31 2(4.3)26.81±2.06 11.17±1.69 χ2/t值2.053 0.896 0.021 0.106 0.160 0.185 0.023 0.193 7.946 3.814 0.717 P值0.155 0.344 0.885 0.744 0.689 0.667 0.879 0.661 0.005 0.054 0.399 43(74.1)15(25.9)195.91±56.55 2 042.24±447.78 637.93±261.46 1 404.31±437.33 10.64±2.89 95.69±114.05 1.02±1.18 1.38±0.99 8.29±2.21 3.83±0.49 33(70.2)14(29.8)172.64±52.10 2 047.87±428.72 648.94±274.16 1 398.94±419.17 12.18±3.61 105.11±226.58 1.20±1.05 1.31±0.75 7.67±1.72 3.72±0.44 0.2000.655 4.712 0.004 0.044 0.004 5.881 0.076 0.647 0.138 2.470 1.499 0.032 0.948 0.834 0.949 0.017 0.783 0.423 0.711 0.119 0.224
3 讨论
MA是以血浆HCO3-原发性减少导致pH降低为特征的酸碱平衡紊乱,它是临床上常见的酸碱失衡类型之一[3],其对机体的影响是多方面的,如减弱心肌收缩力[4]、降低对儿茶酚胺的敏感性[5]、舒张动脉血管、抑制呼吸和中枢神经系统、破坏肠道屏障功能障碍等[6]。MA发生的机制主要有[7]:(1)酸负荷增多(固定酸生成过多、肾排酸减少、外源性固定酸摄入过多);(2)血浆HCO3-直接减少,主要见于严重腹泻、肠道瘘管或引流、大面积烧伤等;(3)高血钾。本研究中,两组患者术前肾功能指标如肌酐、尿素氮等均无异常,且既往无肾脏病史,术前禁食且均未补充外源性固定酸,均未出现腹泻、肠瘘、高血钾等情况。
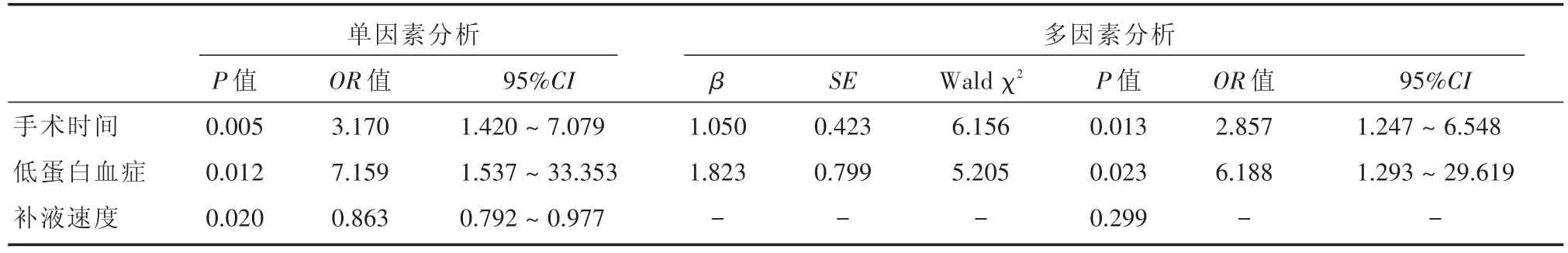
表2 结直肠肿瘤患者术后发生MA的危险因素单因素和多因素Logistic回归分析Tab.2 Univariate and multivariate Logistic regression analysis of risk factors of metabolic acidosis in patients with colorectal cancer after operation
本研究中MA的发生率约55.2%,寻找结直肠肿瘤手术患者术后发生MA的危险因素,有利于在术前尽早发现或术中及时干预。单因素比较显示两组补液速度、手术时间、低蛋白血症患者例数有差异有统计学意义(P<0.05)。补液速度与术中补液总量及手术时间相关,两组患者补液总量无明显统计学差异,但MA组手术时间较非MA组更长(P<0.05),说明MA组患者术中补液更加保守。对于腹部手术,有研究表明非限制补液患者术后血流动力学指标更稳定[8],而术中限制补液更易导致低血容量,心输出量及氧输送随之降低,进一步加重炎症反应[9],组织低灌注及细胞缺血缺氧发生无氧代谢,酸性代谢产物堆积,发生MA。此外,MYLES等[10]纳入3 000例患者的临床多中心随机对照研究对比了术中限制性液体管理和开放性液体管理,发现限制性液体管理组患者急性肾损伤发生率、肾脏替代治疗率、术区感染率均高于开放性液体管理组。但另一方面,补液速度过多过快,易导致容量负荷过重、血管外肺水增加,造成呼吸衰竭、心衰等[11],对于如何优化滴定补液速度还有待进一步的研究。
多因素比较显示手术时间和低蛋白血症是结直肠肿瘤患者术后发生MA的独立危险因素。本研究发现手术时间≥3 h的患者发生MA的风险是<3 h患者的2.857倍(OR=2.857)。已知有多种因素可能影响手术时间,如术前准备、外科医生手术经验、手术疲劳、手术室工作人员经验以及手术器械的易获得性等[12],长时间手术导致组织脏器缺血时间、暴露在应激状态下时间延长,且失血量有可能增加,使得组织细胞通过无氧糖酵解的形式供能,产生大量酸性代谢产物导致MA的发生。此外,低蛋白血症的结直肠肿瘤患者术后MA发生率是非低蛋白血症患者的6.188倍(OR=6.188)。白蛋白主要在肝脏合成,一直被认为是评估患者营养状况和肝功能的指标,它有维持血浆胶体渗透压、运输多种小分子物质、清除自由基等作用[13]。约有10%~57%结直肠癌患者围手术期出现低蛋白血症[14],其原因主要有肠道肿瘤导致消化吸收功能受影响,蛋白摄入能力下降[15];肿瘤患者营养消耗增加,蛋白分过度分解[16];在重大手术应激状态下,肝脏合成急性期蛋白增加而白蛋白的合成减少[17];手术导致血管通透性增加,毛细血管渗漏,白蛋白进一步丢失[18],在术后早期这一过程丢失的蛋白占蛋白总丢失量的75%[19]。白蛋白还可以评估临床预后,国外学者研究表明术后白蛋白水平的下降与预后不良有关[20],低蛋白血症还是结直肠肿瘤患者营养不良和预后较差的预测因素[21]。
本研究的不足之处在于样本量较少,且研究对象均取自我院,可能存在一定程度的选择偏倚,下一步应扩大样本量进一步研究,排除混杂因素的干扰。
综上所述,低蛋白血症、手术时间、补液速度是结直肠肿瘤患者术后发生MA的危险因素,其中低蛋白血症和手术时间是独立危险因素。基于此,临床上应做好充分的术前评估、规划,熟练掌握手术步骤及术中合理放置手术器械等[22],以缩短手术时间;术前充分评估患者营养状况,加强营养支持,必要时可补充外源性蛋白。

