脂多糖结合蛋白在口腔鳞状细胞癌患者中的变化及其意义
王爽 李翠萍 穆婷 冯浩然 黄旋平 何雨亮
广西医科大学附属口腔医院/广西口腔颌面修复与重建研究自治区级重点实验室/广西颅颌面畸形临床医学研究中心/颌面外科疾病诊治研究重点实验室(广西高校重点实验室)(南宁530021)
口腔癌(oral cancer,OC)是一种起源于在口腔上皮组织的恶性肿瘤的总称。根据国家癌症研究所检测估计,近10年间口腔及口咽癌的发病率平均每年上升0.8%。2009-2015年五年生存率为 65.3%[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的口腔癌,为全身第6位高发的恶性肿瘤[2]。据估计,全球每年新发病例超过30万,死亡病例近15万[3]。肿瘤复发、转移是主要的致死原因。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁上的一种内毒素(endotoxin),体外研究表明LPS具有降低血管通透性、促进肿瘤细胞周围血管生成的作用,可促肿瘤细胞远处转移[4-5]。脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)是LPS与CD14结合的靶点,对LPS介导的炎症反应具有增敏作用,促进单核巨噬细胞产生上千倍的炎症介质[6],影响细胞微环境。已有数据证实,LBP可能会增加幽门螺杆菌感染导致胃癌的风险[7]。并且,外泌体LBP蛋白表达在转移性非小细胞肺癌患者较非转移性患者表达上调[8]。KOVACS[9]等研究发现 LBP 表达与肾细胞癌患者存活率有关,证实LBP的表达与肾细胞癌进展存在相关关系。由此可见,LBP在恶性肿瘤的发生、发展过程中,可能起到了一定的促进作用。
1 材料与方法
1.1 材料
1.1.1 组织样本 2017年9月至2018年6月广西医科大学附属口腔医院病理诊断为OSCC并接受手术治疗的54例患者的癌组织及癌旁正常组织样本。肿瘤中央处避开糜烂区切去癌组织2份,距肿瘤边界>2 cm取癌旁组织2份,RNA Keeper Tissue Stabilizer的EP管中与空管各1份,-80℃冻存。
1.1.2 血清样本 2017年9月至2018年6月广西医科大学附属口腔医院病理诊断为OSCC的血液样本159例,以及招募健康志愿者的血液样本44例。离心2 000g15 min,取上清液,-80℃冻存。以上样本收集经广西医科大学伦理委员会批准,经患者知情同意。
1.1.3 试剂与仪器 PCR:RNA Keeper Tissue Stabilizer(南京诺唯赞生物科技有限公司)Prime-ScriptTM RT Master Mix试剂盒(Takara Corporation,JPN)总RNA提取试剂盒(Promega Corporation,US)SYBR®Premix Ex TaqTM Ⅱ(Takara Corporation,JPN)引物(广州擎科生物有限公司):目的基因 LBP:上游序列 5′-GATGTCGCAAGCAGGTTCC-3′,下游序列 5′-AAGTAGCCAAGGCTCGATGG-3′。内参基因 GAPDH:上游序列 5′-AGAAGGCTGGGGCTCATTTG-3′,下游序列 5′-AGGGGCCATCCACAGTCTTC-3′。
ELISA:ExoQuick Exosome Precipitation solution(上海吉泰依科赛生物科技公司),BCA试剂盒(碧云天),人类LBP酶联免疫吸附试剂盒(ab213805)(ABCAMCorporation,US)。
仪器:Step One Plus实时荧光定量PCR仪(Thermo Fisher Scientific,US),酶标仪(上海帝肯贸易有限公司),血常规分析仪检(深圳迈瑞生物医疗电子股份有限公司),全自动生化分析仪(HITACHI,JPN)。
1.2 方法
1.2.1 样本RNA的提取及cDNA合成 取出RNA保护液中的癌与癌旁组织,剪碎,匀浆,总RNA提取试剂盒提取总RNA,PrimeScriptTM RT Master Mix试剂盒逆转录 cDNA[10]。
1.2.2 qPCR 使用SYBR®Premix Ex TaqTMⅡ试剂盒配制20 μL反应体系,Step One Plus实时荧光定量 PCR 仪反应:(1)预变性:95 ℃ 30 s;(2)PCR:95 ℃ 5 s;60 ℃ 30 s;40循环;(3)熔解:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。记录2-△△CT值[10]。
1.2.3 外泌体提取 250 μL血清加入63 μL Exo-Quick Exosome Precipitation solution,裂解外泌体,-80℃保存。BCA试剂盒测定样品外泌体蛋白质浓度。加入5XSDS上样缓冲液,变性95℃10 min,-80℃冻存。
1.2.4 标准夹心酶联免疫吸附技术 应用人类LBP酶联免疫吸附试剂盒(ab213805),将LBP抗体包被于96孔板上。加入标准品(标准的表达系统:NSO;免疫原序列:A26-V481)以及待测样品,加入生物素化的LBP抗体。充分洗涤后加入抗生物素蛋白-生物素-过氧化物酶复合物,PBS洗涤。HRP催化TMB产生蓝色产物后终止反应。15 min内,空白调零,酶标仪450 nm波长下测定吸光度(OD值)。
1.2.5 血常规分析 检测血清LBP蛋白水平检测的OSCC患者白细胞计数、血小板计数、淋巴细胞绝对值、中性粒细胞绝对值。全自动生化分析仪检测OSCC患者碱性磷酸酶、乳酸脱氢酶、总蛋白水平。
1.3 统计学方法 应用SPSS 25.0软件进行统计分析,计量资料采用均数±标准差或中位数(四分位数间距)表示集中趋势与离散程度。正态分布资料采用t检验,偏态分布资料采用秩和检验,P<0.05为差异有统计学意义。采用直线相关分析计算两组计量资料的相关性,Pearson积差相关系数r表示相关关系。ROC曲线计算曲线下面积和敏感度。
2 结果
2.1 LBP mRNA在OSCC中的表达 OSCC癌组织中LBP mRNA的相对表达量为0.845(0.200,3.089),癌旁组织中表达量 1.000 02(1.000 01,1.00005),差异无统计学意义(P>0.05)。临床资料:TMN分期(AJCC 2010年第七版):Ⅰ-Ⅱ期26例,Ⅲ-Ⅳ期28例。淋巴转移:有转移31例,无转移23例。分化程度:高分化44例,中低分化10例。吸烟19例,不吸烟35例。饮酒18例,不饮酒36例。OSCC癌组织LBP mRNA表达在吸烟、饮酒的病例中,癌组织中LBP mRNA的相对表达量明显较癌旁组织增高(P<0.05)。其余分组差异无统计学意义(P>0.05)。见表1、图1。
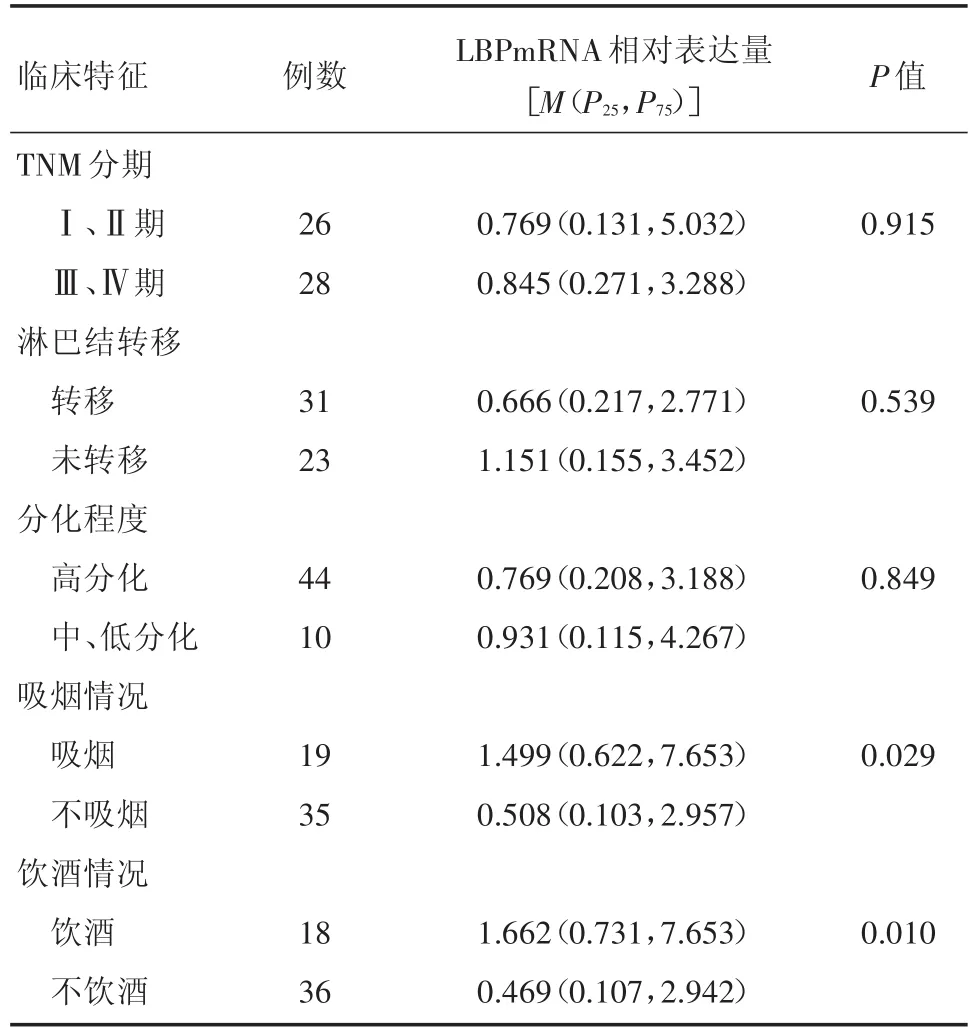
表1 OSCC癌组织中LBP mRNA相对表达量与患者临床特征的关系Tab.1 Relationship between the relative expression of LBP mRNA in OSCC cancer tissues and clinical characteristics of patients
2.2 LBP蛋白在OSCC血清中的表达 OSCC血清中LBP蛋白的OD值(149.433±69.015)mg/L,明显高于健康人血清OD值(102.380±31.956)mg/L(P<0.05)。见图2。OSCC血清中LBP蛋白表达量与患者淋巴结转移、饮酒相关(P<0.05),其余分组差异无统计学意义(P>0.05)。见表2、图3。
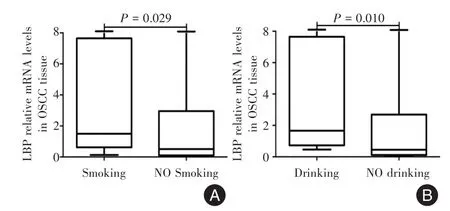
图1 吸烟与不吸烟OSCC癌组织LBP mRNA相对表达量比较(A);饮酒与不饮酒OSCC癌组织LBP mRNA相对表达量比较(B)Fig.1 AComparison of the relative expression of LBP mRNA in smoking and no smoking OSCC cancer tissues(A);Comparison of the relative expression of LBP mRNA in drinkingand no drinking OSCC cancer tissues(B)
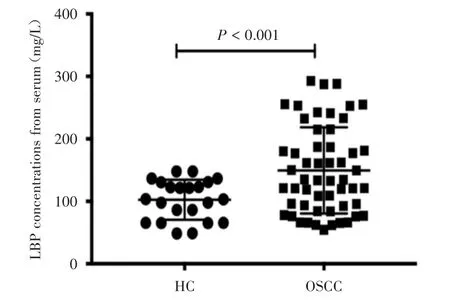
图2 OSCC患者血清与健康人血清LBP蛋白表达量比较Fig.2 Comparison of LBP protein expression in serum from OSCC patients and healthy people
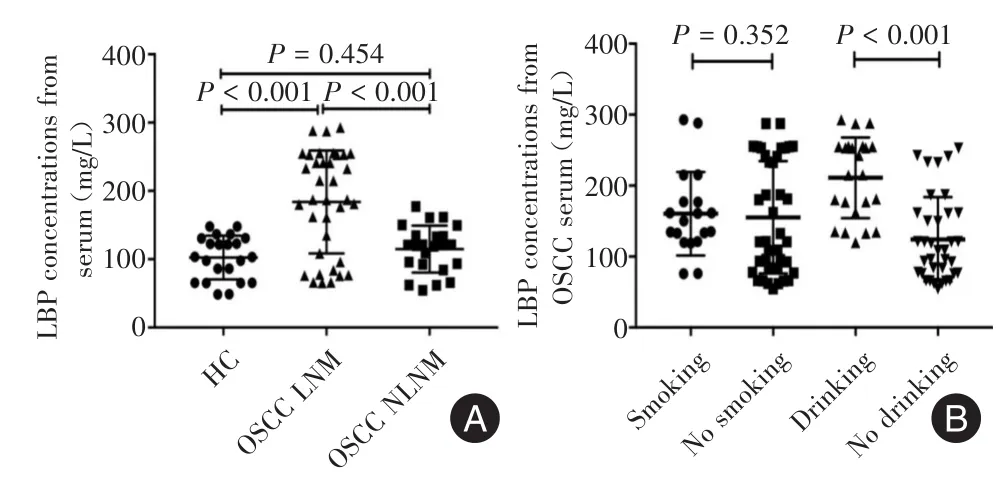
图3 健康对照组、淋巴结转移与不转移OSCC血清LBP蛋白表达量比较(A);吸烟与不吸烟、饮酒与不饮酒OSCC血清LBP蛋白表达量比较(B)Fig.3 Comparison of LBP protein expression in serum from healthy controls,OSCC lymph node metastasis and nonmetastasis(A);Comparison of LBP protein expression in serum from OSCC smoking and no smoking,drinking and no drinking(B)
2.3 LBP mRNA在OSCC患者血清中相对表达量 OSCC血清中LBP mRNA表达量为0.570(0.254,1.581),癌旁组织中表达量0.496(0.256,1.328),差异无统计学意义(P>0.05)。在饮酒组中mRNA表达较不饮酒组升高(P<0.05)。其余分组差异无统计学意义(P>0.05)。见表3、图4。
表2 OSCC血清中LBP蛋白表达量与患者临床特征的关系Tab.2 Relationship between the expression of LBP protein in OSCC serum and clinical characteristics of patients ±s
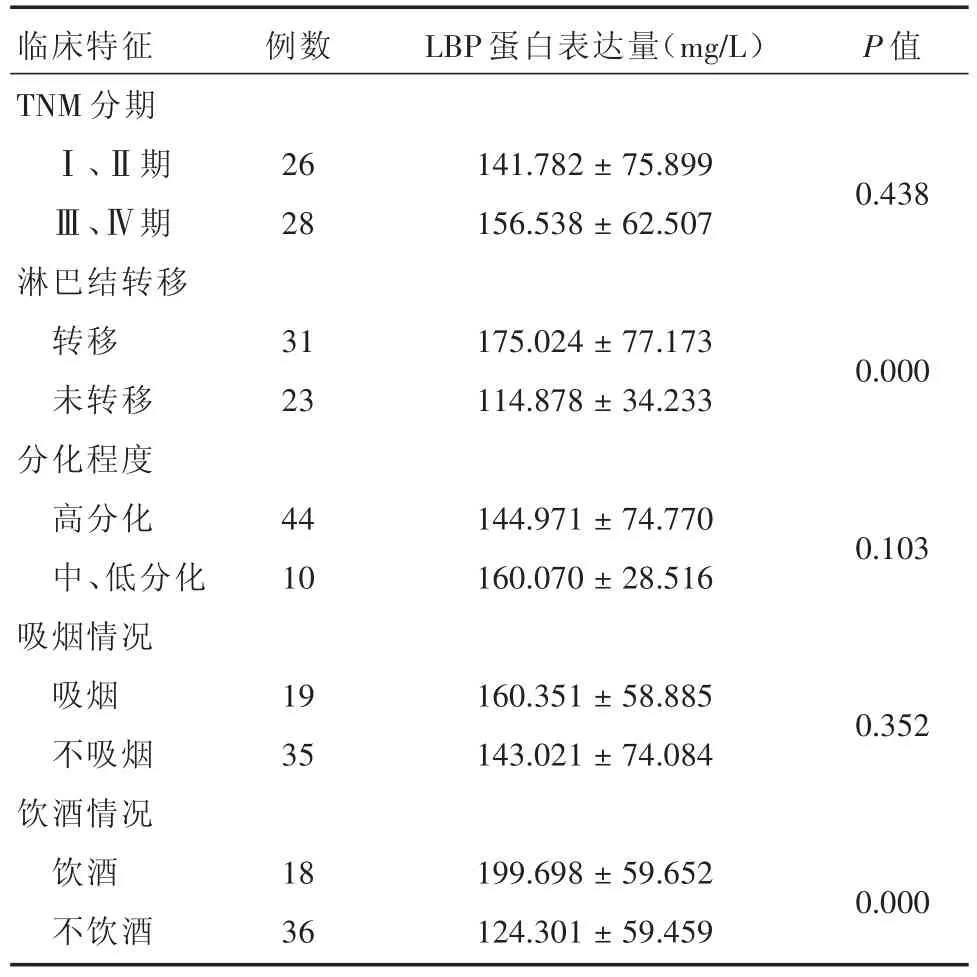
表2 OSCC血清中LBP蛋白表达量与患者临床特征的关系Tab.2 Relationship between the expression of LBP protein in OSCC serum and clinical characteristics of patients ±s
临床特征TNM分期Ⅰ、Ⅱ期Ⅲ、Ⅳ期淋巴结转移转移未转移分化程度高分化中、低分化吸烟情况吸烟不吸烟饮酒情况饮酒不饮酒26 28 141.782±75.899 156.538±62.5070.438 31 23 175.024±77.173 114.878±34.2330.000 44 10 144.971±74.770 160.070±28.5160.103 19 35 160.351±58.885 143.021±74.0840.352 18 36 199.698±59.652 124.301±59.4590.000例数LBP蛋白表达量(mg/L)P值
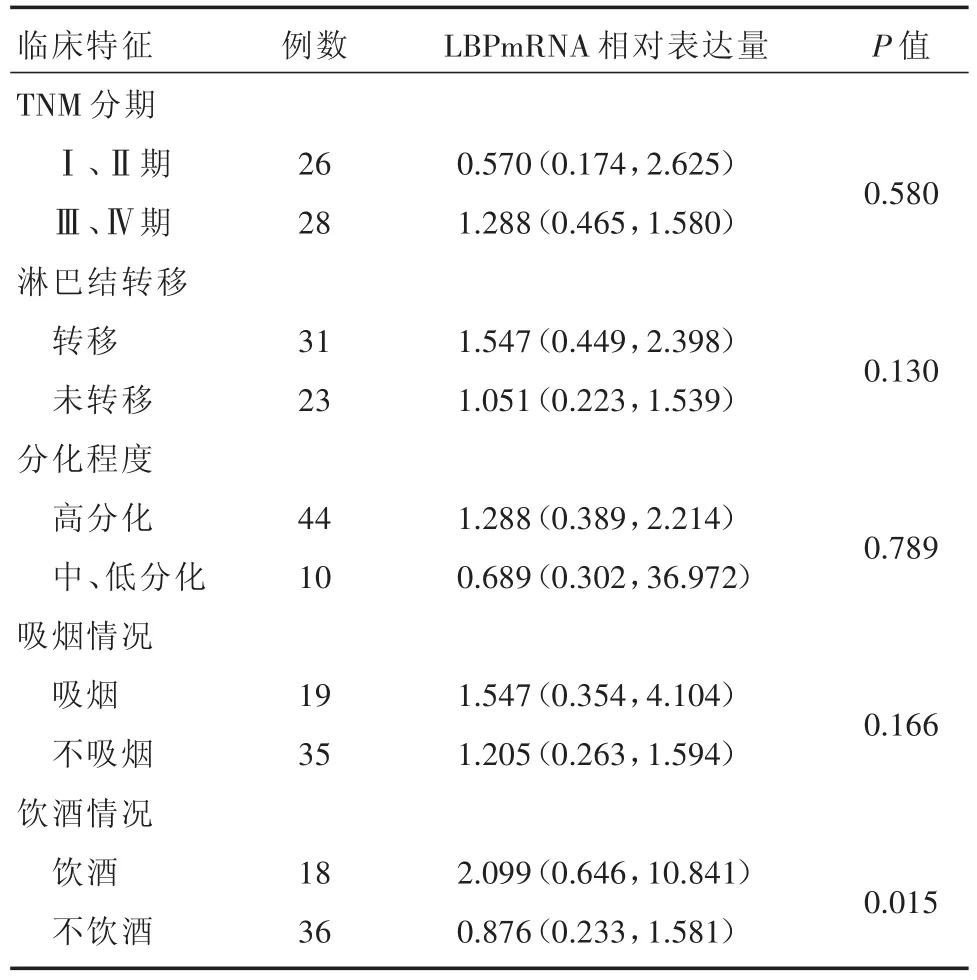
表3 OSCC血清中LBP mRNA相对表达量与患者临床特征的关系Tab.3 Relationship between relative expression of LBP mRNA in OSCC serum and clinical characteristics of patients M(P25,P75)
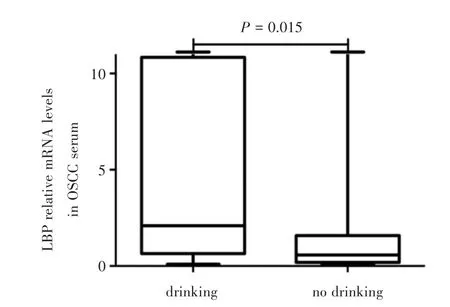
图4 饮酒与不饮酒OSCC血清中LBPmRNA相对表达量比较Fig.4 Comparison of LBP mRNA expression in serum from OSCC drinking and no drinking.
2.4 LBP蛋白在OSCC血清外泌体中表达 OSCC血清外泌体中LBP蛋白的OD值为(6.953±2.018)mg/L,健康人血清OD值(6.709±1.518)mg/L,差异无统计学意义(P>0.05)。OSCC患者中淋巴结转移、饮酒病例的血清外泌体中LBP蛋白表达量明显增高(P<0.05),其余分组差异无统计学意义(P>0.05)。见表4、图5。
表4 OSCC血清外泌体中LBP蛋白表达量与患者临床特征的关系Tab.4 Relationship between the expression of LBP protein in OSCC serum exosomes and clinical characteristics of patients±s
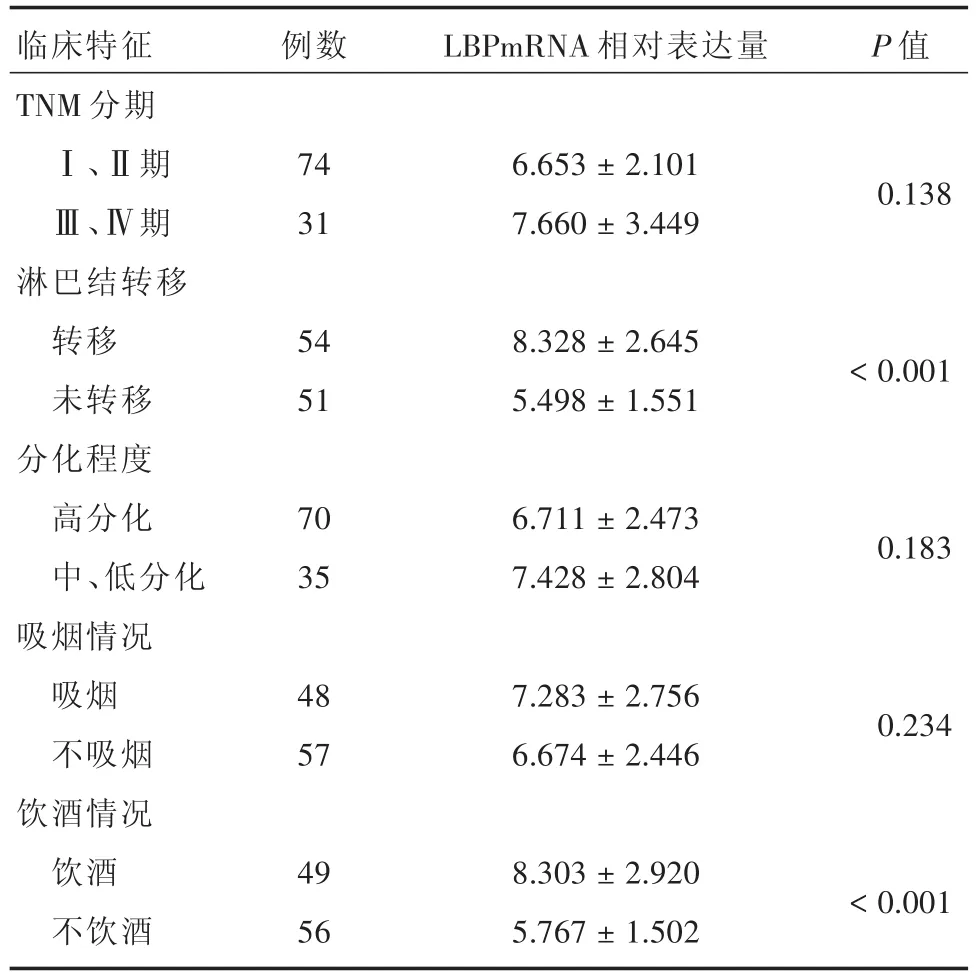
表4 OSCC血清外泌体中LBP蛋白表达量与患者临床特征的关系Tab.4 Relationship between the expression of LBP protein in OSCC serum exosomes and clinical characteristics of patients±s
临床特征TNM分期Ⅰ、Ⅱ期Ⅲ、Ⅳ期淋巴结转移转移未转移分化程度高分化中、低分化吸烟情况吸烟不吸烟饮酒情况饮酒不饮酒例数LBPmRNA相对表达量P值74 31 6.653±2.101 7.660±3.4490.138 54 51 8.328±2.645 5.498±1.551<0.001 70 35 6.711±2.473 7.428±2.8040.183 48 57 7.283±2.756 6.674±2.4460.234 49 56 8.303±2.920 5.767±1.502<0.001
2.5 OSCC患者血清LBP与一般生化指标相关性与ROC曲线 OSCC患者ALP、LDH、总蛋白与LBP存在一定线性关系。r值分别为0.340、0.568、-0.309。见表5。LBP、ALP、LDH、总蛋白 ROC曲线下面积分别为76.0%、86.1%、79.1%、77.1%;敏感度分别为为53.2%、72.2%、51.1%、72.2%。见表6、图6。
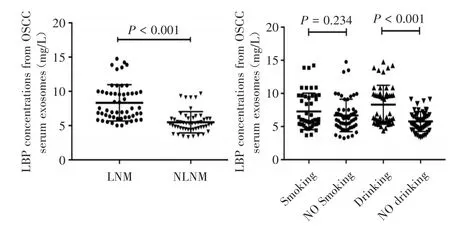
图5 淋巴结转移与不转移OSCC血清外泌体LBP蛋白表达量比较(A);吸烟与不吸烟、饮酒与不饮酒OSCC血清外泌体LBP蛋白表达量比较(B)Fig.5 Comparison of LBP protein expression in serum exosomes from OSCC lymph node metastasis and no metastasis(A);Comparison of LBP protein expression in serum exosomes from OSCC smoking and no smoking,drinking and no drinking OSCC(B)
3 讨论
基因调控下的细胞自身结构与胞外环境的改变是肿瘤细胞发生的基础,其往往伴随着细胞微环境的紊乱[11]。OSCC中常见肿瘤细胞周围炎症浸润[12]。这种不平衡的病理环境,在影响肿瘤细胞蛋白表达的同时,与免疫系统产生一系列相互作用,进一步促进肿瘤细胞的增殖、迁移[13]。近年来,对于OSCC微环境的研究成为目前的研究热点。本文章探讨LBP作为Ⅰ型急性期反应蛋白对OSCC影响。
肿瘤来源外泌体(Tumour derived exosomes,TDE)是目前公认的人体血清中最容易发现具有特异性的肿瘤标志物的研究对象[14-15]。前期实验中,笔者通过对OSCC患者与正常人血清外泌体(Exosomes)进行了蛋白质组学分析,发现淋巴结转移组OSCC中LBP蛋白有上调趋势。表明血清外泌体中LBP含量在淋巴结转移OSCC患者中明显高于非淋巴结转移患者。由此可见,外泌体LBP可能是促进OSCC转移的驱动因子之一。
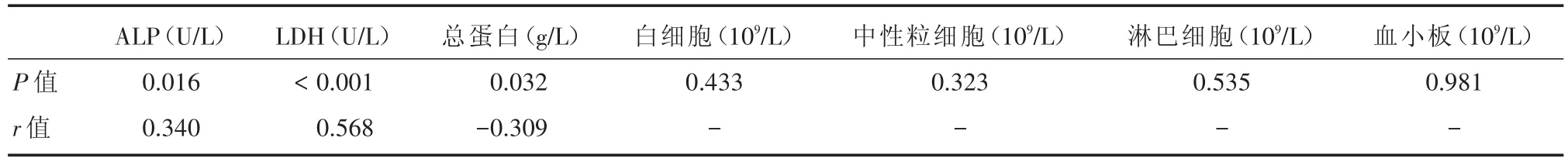
表5 OSCC血清中LBP蛋白表达量与患者一般生化指标的相关Tab.5 Correlation between LBP protein expressions and general biochemical indicators of patients in OSCC serum
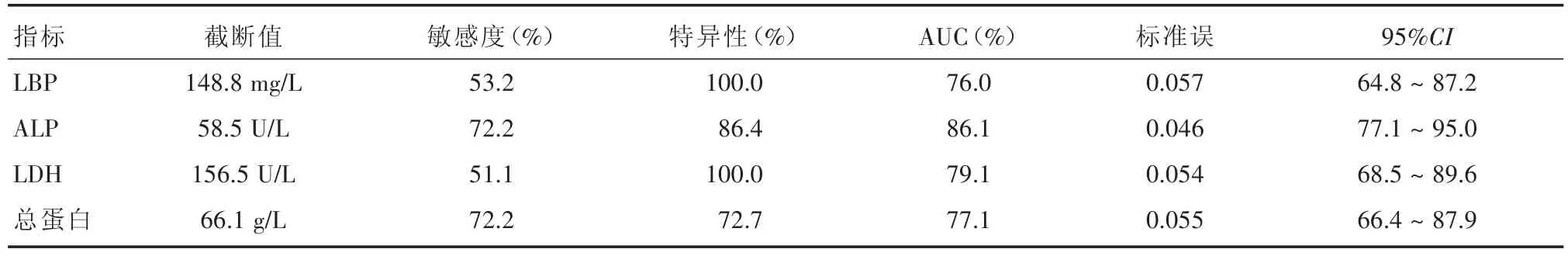
表6 OSCC血清中LBP蛋白表达量与一般生化指标ROC曲线数据Tab.6 The ROC curve data of LBP protein expression and general biochemical
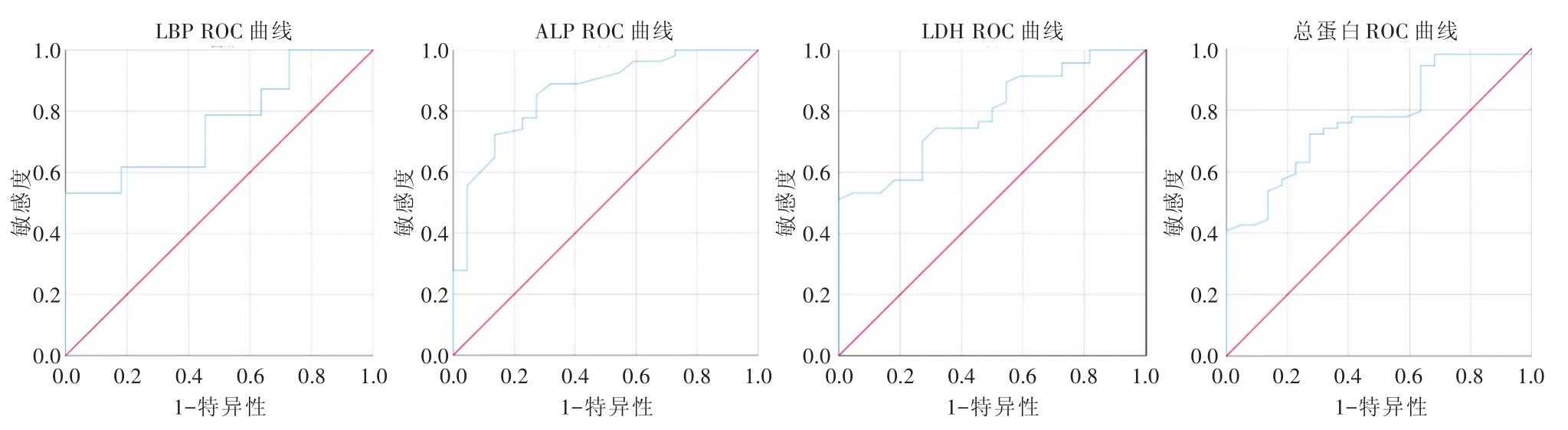
图6 LBP、ALP、LDH、总蛋白ROC曲线Fig.6 ROC curves of LBP,ALP,LDH,and total protein
本次实验研究发现,OSCC人体血清中的LBP蛋白含量较健康人的含量显著提高。相比血清外泌体LBP表达,循环LBP诊断效能大于外泌体LBP。淋巴结转移OSCC患者LBP血清蛋白表达量也较健康人明显增加。表明LBP蛋白可以在循环血清中被稳定检测并可能作为诊断OSCC的生物标志物。
为了进一步明确血清LBP对于OSCC诊断价值,笔者分析了LBP与OSCC患者血清一般生化指标之间的关系,发现LBP与LDH、ALP、总蛋白具有一定的线性相关关系。其中与LDH相关性最为显著。目前,乳酸脱氢酶(lactate dehydrogenase,LDH)已被纳入血清肿瘤标志物。恶性肿瘤中LDH水平升高归因于细胞有丝分裂增多导致糖蛋白分解产生的大量乳酸[16]。血清LDH与OSCC相关性在诸多研究中被证实[17-18]。OSCC好发部位靠近颌骨,肿瘤颌骨转移是OSCC常见的并发症。血清碱性磷酸酶(alkaline phosphatase,ALP)由一般由骨细胞产生,并在恶性肿瘤骨转移患者中大量表达[19]。OSCC主要因影响患者进食和恶性肿瘤消耗而影响机体总蛋白水平。通过对LBP与LDH、ALP、总蛋白对OSCC诊断的敏感度的比较,发现ALP=总蛋白>LBP>LDH。上述结果证实血清LBP与OSCC存在某种关联性并对OSCC具有诊断价值。具体的作用机制有待进一步探究。
此外,笔者整理了OSCC患者的一般临床资料,进一步分析对OSCC发生发展的影响因素。结果表明,吸烟、饮酒的OSCC患者癌组织LBP mRNA相对表达量明显高于不吸烟、不饮酒患者,证实了吸烟、饮酒是促进OSCC发生、增殖的局部促进因素。饮酒组血清、血清外泌体蛋白表达,血清mRNA表达均上调,表明饮酒相对于吸烟而言对OSCC具有更大的全身促进作用。吸烟、饮酒是OSCC主要危险因素[20]。严重和长期的吸烟和饮酒习惯会显著增加触发OSCC的风险[21]。此次研究对OSCC早期防治工作目前开展提供了相对明确方向。
LBP与革兰氏阴性细菌脂多糖(LPS)在CD14细胞上形成高亲和力的复合物,可促进巨噬细胞产生大量的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)[6]。TANG 等[22]证实 TNF-α可以通过 NF-κB信号通路增强OSCC细胞的侵袭和转移能力。TNF-α的表达上调可以导致OSCC周围血管生成,促进细胞增殖、迁移[23]。LPS通路基因多态性TLR2,TLR4,MD-2,LBP,和CD14均能增加导致幽门螺杆菌感染和胃癌的风险[7,24]。由此笔者推测LPS通路可能是影响OSCC进展的途径之一。目前尚无关于LBP对与OSCC作用机制的研究。本课题组在以后的研究中会进一步研究LBP在LPS相关信号通路中对OSCC的影响。
综上所述,LBP可能是诊断OSCC转移的生物学标志和化疗药物靶向治疗的新的突破口。笔者使用了蛋白质组学和基因组学技术寻找OSCC诊断标志物,为OSCC早期防治、早期诊断以及预后提供理论依据,拓宽了研究OSCC发生、发展机制的新思路。
——外泌体与老年慢性疾病相关性的研究进展

