冠心病患者中脂蛋白(a)与心脏瓣膜病的相关性
吴同薇 薛雅芝 林子祥 郎吉萍 戴秋月 曾庆春 郭志刚
南方医科大学南方医院惠侨医疗中心1心血管病区,2全科医学培训基地(广州510515);3南方医科大学南方医院心内科(广州510515)
脂蛋白(a)[lipoprotein(a),Lp(a)]与低密度脂蛋白(low density lipoprotein,LDL)类似,都含有载脂蛋白B100(apoB100),但其独特之处在于LPA基因编码的糖蛋白载脂蛋白(a)能够通过二硫键与apB100结合,从而发挥其独特的病理生理作用[1]。流行病学和遗传学研究证实动脉粥样硬化血栓形成的风险与血浆中Lp(a)水平升高有关,并已经确定钙化性主动脉瓣疾病与 Lp(a)水平相关[1]。进一步的研究发现,Lp(a)能与血液中的自毒素(autoxin,ATX)相互作用促进主动脉瓣的钙化[2]。既往研究[3]发现,Lp(a)的升高与主动脉瓣狭窄(aortic stenosis,AS)风险的增加相关。在外周血管疾病(peripheral vascular disease,PAD)患者中,Lp(a)水平虽然与心脏瓣膜病(valve heart disease,VHD)的发生不相关,但在亚组分析中,Lp(a)水平与AS及二尖瓣狭窄(mitral stenosis,MS)的发生风险相关[4]。有趣的是,在包括冠心病(coronary artery disease,CAD)及非CAD的老年患者中(≥ 70岁),Lp(a)的水平仅与CAD的临床症状相关,而与AS不相关[5]。因此,不同人群、不同疾病中,Lp(a)与心脏瓣膜病的相关性存在着差异。既往的研究发现,Lp(a)与急性冠脉综合征患者左主干病变的发生呈独立正相关[6],且Lp(a)是CAD的独立危险因素,高Lp(a)是CAD的残余风险[7],CAD患者中升高的Lp(a)是否与VHD存在相关性,目前尚未有研究对此进行探究。因此,本文旨在通过探索合并VHD的CAD患者包括Lp(a)在内的风险因素,在中国CAD人群中探讨Lp(a)与VHD的相关性。
1 资料和方法
1.1 研究对象 收集2013年1月至2016年12月期间在南方医科大学南方医院就诊住院并符合以下标准的患者260例:(1)年龄≥ 40岁;(2)符合冠心病诊断标准的患者,行冠状动脉造影术提示至少1支主要冠状动脉或其主要分支内径狭窄≥50%;(3)住院期间行血脂八项及超声心动图检查。排除标准:年龄≥40岁;不符合冠心病诊断患者;既往有风湿病、心内膜炎、其它炎症性疾病;重症心肌炎;严重肝肾功能损害;严重感染性疾病;血液系统性疾病;自身免疫性疾病;甲状腺功能异常;肿瘤以及临床数据缺失患者。本研究经南方医科大学南方医院伦理委员会审查通过。
1.2 方法
1.2.1 病史采集 所有纳入的研究对象均收集包括年龄、性别、吸烟史、高血压及糖尿病史、身高、体质量,计算体质量指数(body mass index,BMI)。入院后行血常规、血肌酐、血脂八项、C反应蛋白(C-reactive protein,CRP)、糖化血红蛋白(hemoglobin A1c,HbA1c)等项目检查。
1.2.2 血脂测量方法 采用美国Roche全自动化分析测定甘油三脂、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇(low density lipoproteincholesterol)、载脂蛋白 A-I(aopA-I)、载脂蛋白 B(apoB)、载脂蛋白E(apoE)、Lp(a)等脂质指标,试剂盒为美国Roche全自动生化分析仪配套试剂盒,质控及校准品由美国Bio-Rad公司提供。TG、TC、HDL-C、LDL-C等指标采用酶学方法检测,而apoAI、apoB、apoE、Lp(a)采用免疫比浊法检测。
1.2.3 冠脉造影 冠状动脉造影术由心内科导管室专业医师在标准导管室完成。所有患者均采用Judkins法多体位完成左、右冠状动脉造影,并由2名有经验的医师对其造影结果进行重新评估。
1.2.4 心脏彩超 所有患者均使用Philips IE33超声诊断仪(Philips,美国)进行超声心动图检查。患者取左侧卧位,暴露前胸,扫查心脏常规切面,测量左室舒张末期内径、左室收缩末期内径、左房内径、左室射血分数等指标。
1.2.5 诊断标准 冠心病诊断标准:根据卫生部2010年11月实施的《冠状动脉粥样硬化性心脏病诊断标准(WS319-2010)》进行诊断,结合患者的病史、临床表现、辅助检查及血清心肌损伤标志物等诊断冠心病,符合诊断标准且冠脉造影术提示至少1支主要冠状动脉主支血管或主要分支血管内径狭窄≥50%的患者诊断冠心病。
根据2017ACC/AHA心脏瓣膜病患者管理指南诊断心脏瓣膜病[8];根据美国超声心动图学会的建议定义返流[9]和狭窄[10]性病变;根据2017ACC/AHA心脏瓣膜病患者管理指南将瓣膜病的严重程度分为轻度、中度和重度[8]。(1)AS或MS:瓣口面积:轻度> 1.5 cm2、中度1.0 ~ 1.5 cm2、重度< 1.0 cm2。(2)主动脉瓣返流(aortic regurgitation,AR):轻度:返流容积<30 mL;中度:返流容积30~59 mL;重度:返流容积≥ 60 mL。(3)二尖瓣返流(mitral regurgitation,MR),轻度:中心返流面积<20%左心房面积;中度:返流容积< 60 mL;重度:返流容积≥ 60 mL。(4)三尖瓣返流(tricuspid regurgitation,TR):轻度:中心返流面积< 5.0 cm2、中度5 ~ 10 cm2、重度> 10 cm2。
1.3 统计学方法 应用SPSS 23.0统计软件对数据进行统计分析。计量资料采用均数±标准差表示,两组间比较采用两组独立样本t检验,计数资料组间采用χ2检验。将VHD的严重程度分为4个等级:无、轻度、中度和重度,分别以0、1、2、3量化其严重程度。简单皮尔逊相关系数用于计算VHD严重性和所有风险因素,包括Lp(a)之间的相关性。采用逐步正向线性多元回归分析方法对皮尔逊相关性分析中P<0.05的因素进行评价,检验包括Lp(a)在内的各危险因素与VHD严重程度之间的关系。P<0.05为差异具有统计学意义。
2 结果
2.1 入组患者的临床特点 本研究共纳入260例冠心病患者,其中心脏瓣膜病组[VHD(+)]125例、非心脏瓣膜病组[VHD(-)]135例(表1)。VHD(+)和VHD(-)组在年龄、性别、BMI、吸烟、高血压和糖尿病史方面均差异无统计学意义(P>0.05)。实验室检验指标除血红蛋白(P=0.035)、血肌酐(P=0.010)、NT-proBNP(P=0.013)、甘油三酯(P=0.013)和 apoA1(P=0.028)之外差异均无统计学意义(P>0.05)。心脏彩超指标中,与VHD(-)组相比,VHD(+)组左房前后径(P=0.005)、左室舒张末(P=0.007)及收缩末前后径(P<0.001)明显较大,两组的射血分数差异无统计学意义(P>0.05)。根据瓣膜病的严重程度,每种瓣膜病的患病率见图1。
表1 入组患者的临床资料比较Tab.1 Baseline clinical characteristic in enrolled patients ±s, 例(%)
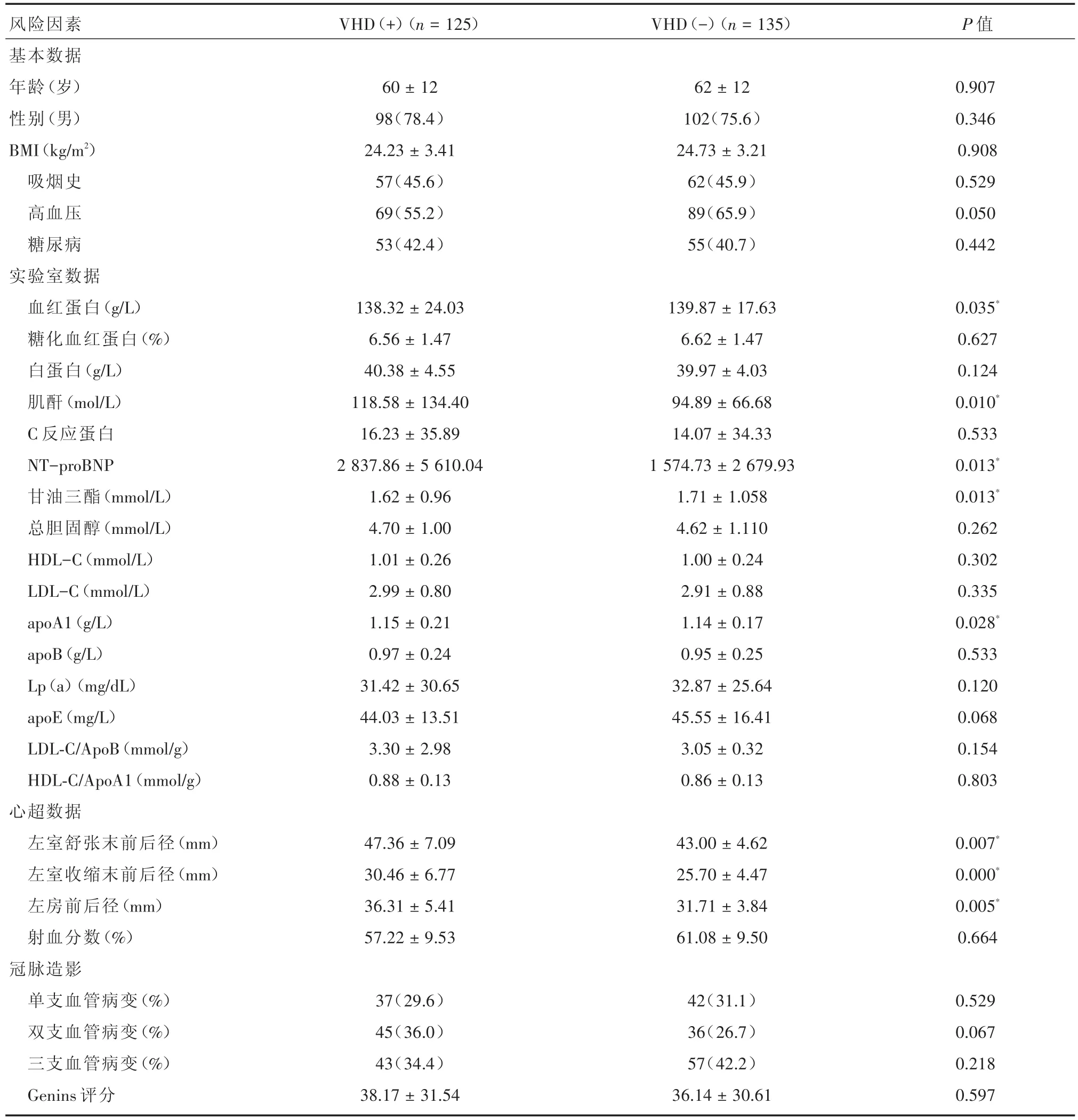
表1 入组患者的临床资料比较Tab.1 Baseline clinical characteristic in enrolled patients ±s, 例(%)
注:*P<0.05
风险因素基本数据年龄(岁)性别(男)BMI(kg/m2)吸烟史高血压糖尿病实验室数据血红蛋白(g/L)糖化血红蛋白(%)白蛋白(g/L)肌酐(mol/L)C反应蛋白NT-proBNP甘油三酯(mmol/L)总胆固醇(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)apoA1(g/L)apoB(g/L)Lp(a)(mg/dL)apoE(mg/L)LDL-C/ApoB(mmol/g)HDL-C/ApoA1(mmol/g)心超数据左室舒张末前后径(mm)左室收缩末前后径(mm)左房前后径(mm)射血分数(%)冠脉造影单支血管病变(%)双支血管病变(%)三支血管病变(%)Genins评分VHD(+)(n=125)VHD(-)(n=135)P值60±12 98(78.4)24.23±3.41 57(45.6)69(55.2)53(42.4)62±12 102(75.6)24.73±3.21 62(45.9)89(65.9)55(40.7)0.907 0.346 0.908 0.529 0.050 0.442 138.32±24.03 6.56±1.47 40.38±4.55 118.58±134.40 16.23±35.89 2 837.86±5 610.04 1.62±0.96 4.70±1.00 1.01±0.26 2.99±0.80 1.15±0.21 0.97±0.24 31.42±30.65 44.03±13.51 3.30±2.98 0.88±0.13 139.87±17.63 6.62±1.47 39.97±4.03 94.89±66.68 14.07±34.33 1 574.73±2 679.93 1.71±1.058 4.62±1.110 1.00±0.24 2.91±0.88 1.14±0.17 0.95±0.25 32.87±25.64 45.55±16.41 3.05±0.32 0.86±0.13 0.035*0.627 0.124 0.010*0.533 0.013*0.013*0.262 0.302 0.335 0.028*0.533 0.120 0.068 0.154 0.803 47.36±7.09 30.46±6.77 36.31±5.41 57.22±9.53 43.00±4.62 25.70±4.47 31.71±3.84 61.08±9.50 0.007*0.000*0.005*0.664 37(29.6)45(36.0)43(34.4)38.17±31.54 42(31.1)36(26.7)57(42.2)36.14±30.61 0.529 0.067 0.218 0.597
2.2 VHD的风险因素探索 因VHD(+)与VHD(-)组对比Lp(a)的水平无差异,本研究首先对VHD患者进行了亚组的单因素分析。在皮尔逊相关性分析中显示:(1)AS与年龄(P< 0.001)、肌酐(P=0.030)、NT-proBNP(P=0.018)和 Lp(a)(P=0.022)呈正相关,与 BMI(P=0.026)、血红蛋白(P=0.005)、甘油三酯(P=0.040)及 apoE(P=0.015)呈负相关;(2)MS与年龄(P=0.002)、NT-proBNP(P< 0.001)和Lp(a)(P=0.002)呈正相关,与性别(P=0.011)和血红蛋白(P=0.002)呈负相关;(3)AR与年龄(P=0.023)和NT-proBNP(P=0.010)呈正相关,与血红蛋白(P=0.001)呈负相关;(4)MR与NT-proBNP(P=0.002)呈正相关,与血红蛋白(P=0.032)呈负相关;(5)TR与NT-proBNP(P=0.004)呈正相关。在单因素分析中,Lp(a)仅与AS和MS存在相关性。见表2。
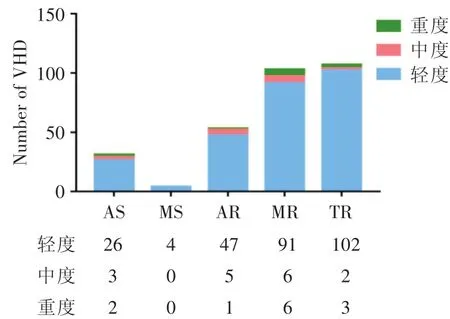
图1 不同严重程度和不同种类心脏瓣膜病的发病率Fig.1 Prevalences of each VHD classified as mild,moderate and severe
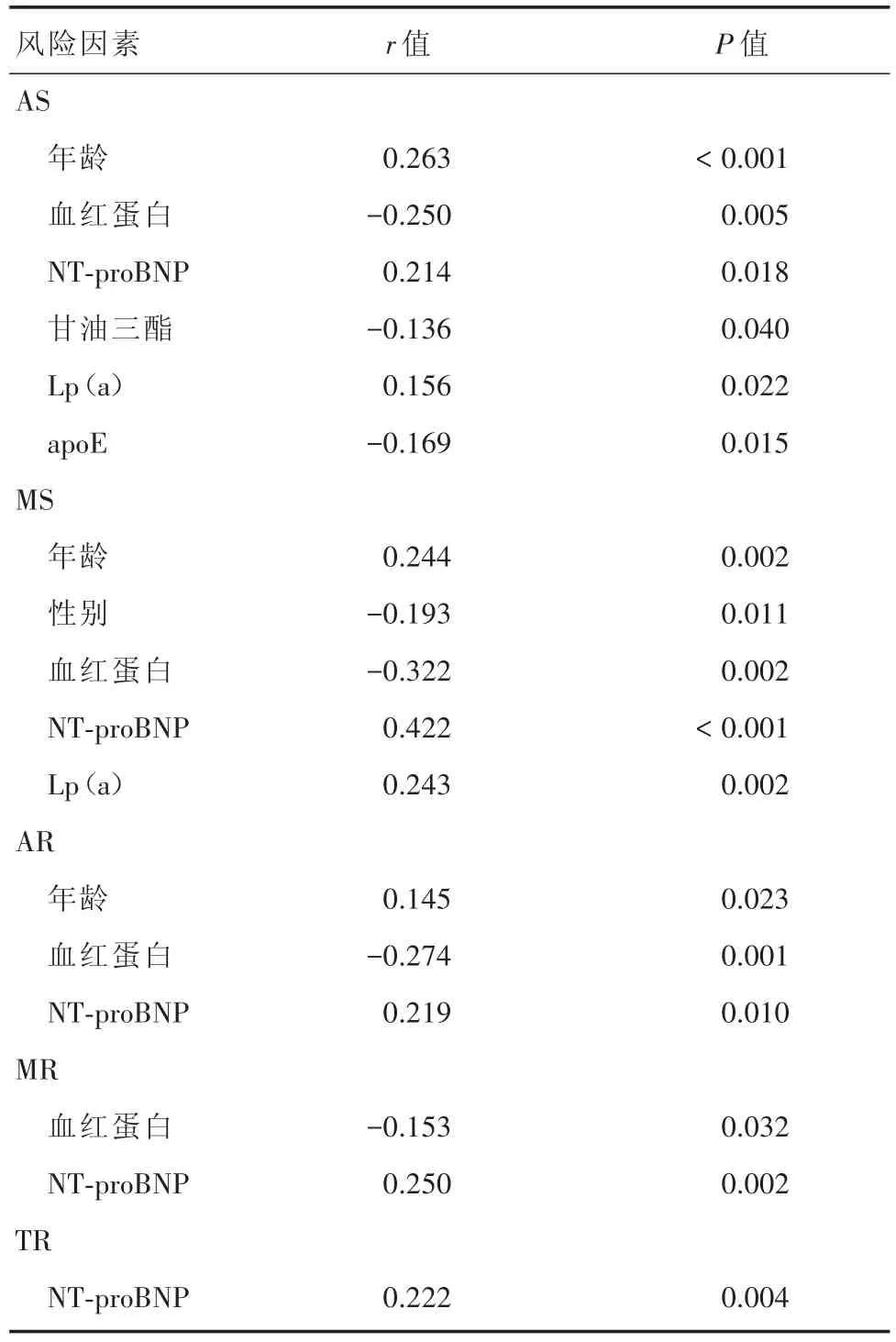
表2 风险因素与心脏瓣膜病的皮尔森相关性分析Tab.2 Correlations between severity of VHDs and risk factors in Pearson′s correlation analysis
接下来,笔者对AS和MS进行了多因素分析,如表3所示,在进一步疾病严重程度的逐步多元回归分析中,AS与Lp(a)和年龄呈正相关;MS与NT-proBNP和年龄呈正相关;而狭窄性瓣膜病(AS或MS)与左房前后径及Lp(a)呈正相关。单因素分析中,Lp(a)与狭窄性瓣膜病、AS和MS均存在相关性;但在进一步逐步多元回归分析中,Lp(a)与仅狭窄性瓣膜病及AS呈正相关。

表3 心脏瓣膜病严重程度与危险因素的多元回归分析Tab.3 Correlations between severity of VHDs and risk factors in multiple regression analysis
2.3 AS或MS患者中Lp(a)的水平 因Lp(a)与AS和MS存在统计学上的相关性,笔者对比了AS、MS及狭窄性瓣膜病患者与非VHD患者的Lp(a)水平。如表4所示,与非VHD患者相比,AS、MS及狭窄性瓣膜病患者的血清Lp(a)水平明显较高[AS:(32.87 ± 25.64)mg/dLvs.(36.06 ± 40.71)mg/dL,P=0.001;MS:(32.87 ± 25.64)mg/dLvs.(72.25± 52.10)mg/dL,P=0.003;狭窄性瓣膜病:(32.87 ±25.64)mg/dLvs.(40.20 ± 42.87)mg/dL,P< 0.001]。
表4 AS、MS患者中的Lp(a)水平Tab.4 Lp(a)levels in patients with AS or without VHD,with MS or without VHD,with AS or MS and without VHD±s
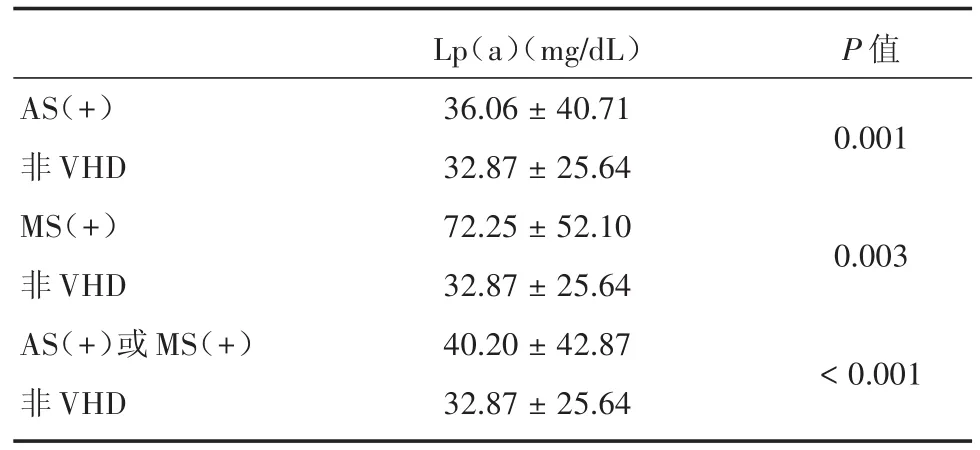
表4 AS、MS患者中的Lp(a)水平Tab.4 Lp(a)levels in patients with AS or without VHD,with MS or without VHD,with AS or MS and without VHD±s
AS(+)非VHD MS(+)非VHD AS(+)或 MS(+)非VHD Lp(a)(mg/dL)36.06±40.71 32.87±25.64 72.25±52.10 32.87±25.64 40.20±42.87 32.87±25.64 P值0.001 0.003<0.001
3 讨论
在过去的50年里,VHD的流行病学发生了巨大的变化,随着预期寿命的稳步增长,退行性瓣膜病的发病率也在不断增加[11]。虽然目前VHD的患病率较CAD低,但长期随访的必要性以及高昂的调查和治疗费用意味着VHD将对医疗系统产生以忽视的影响[12]。同时,全球人口的迅速老龄化,而与年龄密切相关的VHD可能成为“下一个心脏流行病”。近年来的研究证实Lp(a)的升高与AS风险增加相关,在PAD患者中,升高的Lp(a)水平与AS及MS的发生密切相关[4]。但是在≥70岁的老年患者中,Lp(a)仅与CAD的临床症状相关,而与AS的发生不相关[5]。
大量的临床研究证实了Lp(a)与主动脉瓣膜病相关。在主动脉瓣钙化的过程中,Lp(a)和瓣膜间质细胞分泌的ATX共同作用,介导炎症、诱导骨形成蛋白生成,从而引起瓣膜钙化[13]。此外,Lp(a)能显著增加碱性磷酸酶活性、促进磷酸盐释放、增加钙沉积、增加羟基磷灰石、促进细胞凋亡、促进基质囊泡形成、增加信号转导蛋白的磷酸化,同时,增加软骨-成骨介质的表达、降低SOX9和基质Gla蛋白,介导主动脉瓣瓣膜钙化[13]。而心脏瓣膜的钙化会导致瓣膜狭窄或返流的发生,因此,Lp(a)与VHD的发生发展可能存在着一定的相关性。
然而,在中国CAD患者中,升高的Lp(a)水平与VHD的相关性仍未有报道。本文是第一篇在中国CAD患者中探索Lp(a)与VHD的相关性的研究,根据有无VHD将患者分为VHD(+)和VHD(-)组,回顾性的分析其临床资料及、血脂情况及心脏彩超结果。基线资料的对比发现,VHD(+)组和 VHD(-)组患者的 Lp(a)水平并无统计学差异。但是在危险因素的初步筛查中,亚组的皮尔逊相关性分析提示了升高的Lp(a)与狭窄性瓣膜病,即AS和MS相关。进一步的多元逐步回归分析发现,Lp(a)与狭窄性瓣膜病(AS或MS)及AS的严重程度呈现正相关,且Lp(a)对AS的严重程度的影响权重最大。同时,AS、狭窄性瓣膜病组Lp(a)水平显著高于非VHD组。基础研究发现,钙化性AS是一种以脂质积聚、炎症和钙化为特征的活动性疾病过程,与动脉粥样硬化类似[14]。分子研究认为Lp(a)能与ATX、溶血磷脂酸相互作用介导主动脉瓣钙化。在CAD和钙化性主动脉瓣膜疾病,Lp(a)可能导致内皮功能障碍、向正在发育的病变输送脂质、促进炎症和钙化[2]。因此,在CAD患者中,升高的Lp(a)可能促进AS的发生发展。
此外,尽管多元逐步回归分析提示MS的严重程度与Lp(a)不存在统计学意义上的相关,这可能是缘于MS例数较少;但在单因素分析中,Lp(a)与MS是存在统计学上的相关性的,且MS组的Lp(a)水平显著高于非VHD组。本研究发现CAD患者中血清Lp(a)水平与MS存在相关性。有研究曾报道编码Lp(a)中独特的糖蛋白载脂蛋白(a)的LPA基因位点上的一个突变(rs10455872SNP)与二尖瓣环钙化的CT表现密切相关[3],而LPA上的SNPs与主动脉瓣钙化和狭窄有关[3]。同时,严重的环状钙化是MS的主要危险因素之一。因此,与AS类似,在CAD患者中,高Lp(a)水平也可能是MS发生发展的危险因素。
本研究发现在中国冠心病患者中发现Lp(a)与心脏瓣膜病中的狭窄性瓣膜病(AS或MS)及其严重程度相关,这可能源于Lp(a)与瓣膜钙化的发生发展相关。目前的研究发现,米泊美生[15]、烟酸[16]、前蛋白转化酶枯草杆菌转化酶 9[17-18]、CETP抑制剂[19]以及白介素-6的抗体[20]均能降低 Lp(a)的水平,表明其对LPA基因的表达、Lp(a)的组装和/或清除起着一定的调节作用[21]。其中,PCSK9单克隆抗体衣伏库单抗,能够降低26.9%的Lp(a)水平[17];在亚洲人群中,另一种PCSK9单抗阿利西尤单抗能够降低 30.3%的 Lp(a)水平[18]。目前尚未有研究报道通过降低Lp(a)水平能影响狭窄性瓣膜病的进展,本研究的发现有望为狭窄性瓣膜病(AS和MS)的防治提供新的靶点。同时,笔者期待更多的临床及基础研究关注于通过降低Lp(a)对CAD患者狭窄性瓣膜病进行防治。
本研究的局限性包括样本量相对较小且研究在单一中心开展。其次,本研究设计为横断面分析,未基于人口纳入数据且没有分析SNP,故需要进一步的研究来探究Lp(a)在CAD患者AS或MS的发生发展中所起的作用以及不同分型的Lp(a)对AS和MS的影响。

