脐带间充质干细胞外泌体转运miR-21-5p促进子宫内膜间质细胞增殖的作用机制
吕承晓,段 华,汪 沙,甘 露,徐 倩
0 引 言
子宫内膜损伤性疾病,又称宫腔粘连,因其造成女性生育力的严重损害,而临床现行的一线治疗手段对于中、重度宫腔粘连患者的疗效不甚理想,成为妇科临床亟待解决的议题之一[1]。近年来,相关的研究结果显示,基于间充质干细胞的细胞治疗能够在宫腔镜下宫腔粘连分离术后,有效加速损伤子宫内膜再生、显著改善相关生育结局,取得了较为满意的疗效[2-3],但其发挥疗效的作用机制仍不明确。前期的动物研究结果显示,外源性间充质干细胞损伤内膜局部定植率低,且主要定植在子宫内膜间质[4-5];细胞研究的结果则显示,间充质干细胞通过旁分泌作用促进子宫内膜间质细胞(endometrial stromal cells, ESC)的增殖,从而加速损伤内膜的修复,这其中间充质干细胞所分泌的外泌体发挥了关键作用[6]。外泌体作为间充质干细胞旁分泌活动的主要方式之一,不仅协助其母细胞清除溶酶体内多余的细胞代谢废物,更可被局部或远隔器官内的靶细胞内吞后介导细胞间的物质运输,协助细胞间信息交流,因此被认为是组织局部微环境调控的关键介质,从而成为间充质干细胞在多种器官损伤修复中发挥疗效的重要成分[7-8]。
本研究前期研究已经证实脐带间充质干细胞(umbilical cord mesenchymal stem cells, UCMSC)通过分泌其外泌体促进ESC的增殖,起效迅速、效应持久,并且以剂量依赖的方式促进增殖活性[6]。但外泌体内包含多种核酸、蛋白质和脂质,具体是何种生物活性成分在促进内膜增殖中发挥主导作用,仍然不明确。近期的多项研究显示,miR-21-5p不仅在多种间充质干细胞外泌体中存在较高的表达丰度,更在转运至损伤组织局部后,参与靶细胞内多种靶基因表达,发挥激活增殖、抑制凋亡、加速血管新生、调节免疫反应等效应,从而加速组织修复及愈合[9-12]。然而,UCMSC外泌体miR-21-5p如何调节外泌体内的靶mRNA表达,是否参与促进外泌体的增殖活性从而加速损伤子宫内膜的修复,均尚不清楚。本研究旨在探讨UCMSC外泌体所携带的miR-21-5p对于子宫内膜间质细胞增殖的影响,为研究其具体作用机制提供参考。
2 资料与方法
1.1 组织标本来源人脐带间充质干细胞由北京市脐血库提供。增殖期子宫内膜标本取自2018年1月至6月首都医科大学附属北京妇产医院妇科微创中心,因宫颈上皮内瘤变III级、子宫肌瘤等行开腹或腹腔镜下全子宫切除的3例患者。纳入标准:①年龄20~40岁;②既往月经周期规律;③术前3个月内未使用过雌、孕激素类和促性腺激素释放激素类似物等甾体类激素药物;④术后病理检查证实无子宫内膜病变。排除标准:①合并其他子宫内膜疾病,如子宫内膜息肉、子宫内膜增生等;②术前患有其他引起不孕或月经减少的疾病,如卵巢功能低下、多囊卵巢综合征等妇科内分泌疾病。本研究经过医院伦理委员会批准(批准号:IEC-B-03-V01-FJ1),患者均签署了知情同意书。
1.2子宫内膜间质细胞原代培养及鉴定将新鲜的子宫内膜组织迅速浸泡在无菌等渗盐水中,置于冰盒内尽快转运至实验室超净台。用无菌PBS反复冲洗3~5次,将内膜组织充分剪碎,直至形成大小约1 mm3的糜状组织块。加入3~5倍体积的0.2%I型胶原酶(含0.005%DNA酶),振荡至组织块呈悬浮状态。置入细胞培养箱中孵育消化40~50 min,加入等量完全培养基(DMEM/F12+10%FBS+1%青-链霉素)终止消化。将组织消化液分别通过100 μmol/L和40 μmol/L细胞晒网过滤,去除组织残渣,分离获得ESC细胞进行接种,记为P0。传代后用于后续鉴定及检测。
免疫荧光染色鉴定原代分离的ESC。取P3代ESC按1×105个/皿将其均匀接种到玻底培养皿中,继续培养使之重新贴壁。取出后加100 μL 4%多聚甲醛室温固定10 min,吸弃后加PBS洗3次;加100 μL 0.3%TritonX-100室温打孔5 min,吸弃后加PBS洗3次;加100 μL含0.8%BSA的0.1%TritonX-100室温封闭30 min;吸弃封闭液,加100 μL按1∶100稀释的Vimentin(Proteintech)和pan-cytokeratin(Santa Cruz)的一抗混合液,置入4 ℃湿盒内孵育过夜;吸弃一抗加1 mL 0.1%TritonX-100,慢摇洗3次,每次5 min;吸弃0.1%TritonX-100,加100 μL按1∶1000稀释的Alexa Fluor 488标记的驴抗小鼠二抗(Invitrogen),及Alexa Fluor 594标记的驴抗兔二抗(Invitrogen)混合液,避光室温孵育1 h;吸弃二抗,加1 mL 0.1%TritonX-100,避光慢摇洗3次,每次5 min。随后每皿滴加1滴含DAPI的封固剂,立即封片。在激光共聚焦显微镜下观察细胞染色的情况。
1.3脐带间充质干细胞外泌体提取与鉴定将FBS以离心半径15.4 cm、100 000×g超速离心70 min,取上清,制备获得无外泌体FBS,配置无外泌体完全培养基,用于培养UCMSC。收集UCMSC培养上清,4 ℃,300×g,离心10 min,去除残余细胞;取上清,4 ℃,2000×g,离心10 min,去沉淀中死细胞;取上清,4 ℃,10 000×g,离心30 min,去除细胞碎片。每次吸取上清时,均保留沉淀0.5 cm以上的液体,以防吸入沉淀影响外泌体纯度。将上清分装置入超速离心机(Beckman Coulter),4 ℃,100 000×g,超速离心70 min,用移液管小心吸出上清,沉淀即为外泌体。加1 mL无菌PBS将外泌体重悬洗涤,并收集至同一个离心管内,再次4 ℃,100 000×g,超速离心70 min,用移液管小心吸出上清弃去,沉淀即为洗涤后的外泌体。向沉淀内加入100~150 μL无菌PBS重悬外泌体,采用BCA试剂盒测定外泌体的浓度后,置于-80 ℃备用。采用Western blot鉴定外泌体特异性蛋白标记物Alix(Abcam)、TSG101(Abcam)和CD63(Abcam);透射电镜(日立)观察外泌体形态;Zeta View纳米离子跟踪分析仪(Particle Metrix)测定外泌体粒径分布及大小。
1.4荧光定量PCR检测miR-21-5p的表达水平取UCMSC外泌体及去除外泌体的UCMSC培养上清各30 μL,按照miRNeasy血清/血浆RNA提取试剂盒(Qiagen)步骤提取分别提取其总RNA,提取过程中每个样品加入3.5 μL浓度为1.6×108copies/μL的ce-miR-39 RNA spike-in control(Qiagen)工作液作为外参基因。外泌体及培养上清中总RNA浓度一般较低,因此均取8 μL RNA 作为模板,按照42 ℃ 60 min→95 ℃ 3 min的条件进行加polyA尾及逆转录反应,合成cDNA。将cDNA产物稀释10倍,取2 μL作为模版,配制总体积为20 μL的荧光定量PCR反应体系,按照三步法95 ℃ 15 min起始变性(1个循环)→94 ℃ 20 s变性,65 ℃ 30 s退火,72 ℃ 34 s延伸进行预扩增(5个循环)→94 ℃ 20 s变性,61 ℃ 34 s退火延伸进行扩增,并采集荧光信号(40个循环)的条件进行荧光定量PCR反应。
此外,收集UCMSC外泌体(20 μg/mL)处理24 h后的外泌体及未处理的外泌体各2×105个,Trizol法提取细胞总RNA,采用Nano Drop One分光光度计检测RNA样本浓度和纯度,取1 μg总RNA 作为模板,按照 42 ℃ 60 min→95 ℃ 3 min的条件进行加polyA尾及逆转录反应,合成cDNA。将cDNA产物稀释100倍,取2 μL作为模版,配制总体积为20 μL的荧光定量PCR反应体系,按照两步法95 ℃ 15 min起始变性(1个循环)→94 ℃ 20 s变性,61 ℃ 34 s退火延伸进行扩增并采集荧光信号(40个循环)的条件进行荧光定量PCR反应。
miR-21-5p表达水平采用2-ΔΔCt法进行相对定量分析,其中外泌体样本以外参基因ce-miR-39为管家基因,细胞样本以内参基因U6为管家基因,Ct为循环阈值;每个标本重复3次,取平均值进行统计学分析。
1.5CCK8和EdU染色检测抑制miR-21-5p后子宫内膜间质细胞的增殖活性为了进一步明确miR-21-5p对于外泌体增殖的影响,取指数增殖期的外泌体接种于96孔板(3×103个/孔)和24孔板(2.5×104个/孔)。待细胞密度达30%~50%时,按照试剂盒步骤,用转染试剂lipofectamine 2000(Invitrogen)将100 nmol/L miR-21-5p inhibitor(锐博生物)或miR inhibitor NC(锐博生物)转染至外泌体,分为抑制组(转染miR-21-5p inhibitor)、对照组(转染miR inhibitor NC)、空白组(未转染)。转染后0、24、48和72 h分别向96孔板每孔加入10 μL CCK8(同仁化学所),继续避光孵育 2 h 后用酶标仪检测A450nm;另外,转染后48 h,向24孔板加入与原有培养基等体积的2× EdU工作液(碧云天),继续孵育2 h对增殖期细胞进行标记。取出后弃培养基,PBS洗3遍,加500 μL 4%多聚甲醛固定10 min,吸弃后加3%BSA洗3次;加500 μL 0.3%TritonX-100室温打孔5 min,吸弃后加3%BSA洗3次;加100 μL按EdU试剂盒配制的Click反应液,避光孵育30 min,吸弃后加3%BSA洗3次;加500 μL 1×Hoechst33342,室温避光孵育10 min,对细胞核进行染色,吸弃后加3%BSA洗3次。随后荧光显微镜下观察,并在低倍镜下每个样品随机取3个视野并拍照记录。采用Image J软件计数每个视野内总细胞数和EdU结合阳性的细胞数,计算EdU结合阳性的细胞的百分比。
1.6生物信息学分析预测外泌体miR-21-5p下游靶基因为了预测miR-21-5p在子ESC内的潜在的下游mRNA靶标,联合使用TargetScan、miRDB和TargetMiner3个miRNA数据库对其进行检索后,将三者中检索得到的靶基因集合采用VennDiagram R软件包取交集,作为miR-21-5p 下游mRNA靶标的预测结果,并对其进行可视化呈现。随后将这些潜在靶基因采用clusterProfiler R软件包进行GO分析及KEGG通路富集分析,并将其可视化,进一步预测 miR-21-5p 的这些潜在的靶基因参与的主要细胞生物学进程。

2 结 果
2.1 ESC及UCMSC外泌体的鉴定结果原代分离培养的ESC在光镜下呈多角形梭形或多角形,贴壁生长。免疫荧光染色结果显示,ESC对间质来源标记物波形蛋白(Vimentin)染色呈现阳性反应,阳性率达95%以上;而对上皮来源标记物细胞角蛋白(pan-cytokeratin)染色呈阴性反应,阳性率低于5%。上述细胞形态和免疫荧光染色结果特征符合子宫内膜间质细胞的鉴定标准。见图1。

a:光镜; b:Vimentin染色; c:pan-cytokeratin染色; d:DAPI; e:Merged图1 ESC的原代培养及鉴定Figure 1 Primary culture and identification of ESC
Western blot结果显示UCMSC外泌体中内体转运体相关特异性标记物TSG101、Alix呈强阳性表达,4次跨膜蛋白CD63也呈阳性表达。透射电子显微镜下观察见UCMSC外泌体呈现双凹圆盘状的双层膜结构,直径100 nm左右。NTA结果显示UCMSC外泌体粒径介于60~200 nm,且96.9%的UCMSC外泌体粒径处于这一范围内。上述蛋白标记物、形态和粒径的特征,符合外泌体的鉴定标准。见图2。
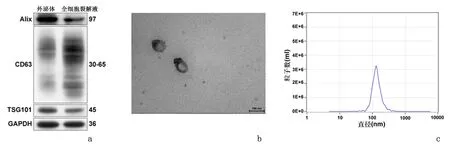
a:Western blot;b:TEM观察外泌体的形态;c: NTA分析外泌体的粒径大小及分布图2 UCMSC外泌体的分离及鉴定Figure 2 Isolation and characterization of UCMSC-derived exosomes
2.2miR-21-5p在UCMSC外泌体及其处理后ESC中的表达情况荧光定量PCR结果显示, UCMSC外泌体中miR-21-5p相对表达量(33.76±1.17)显著高于培养基(1.00±0.3),差异有统计学意义(P<0.01);UCMSC外泌体处理后ESC中miR-21-5p相对表达量(1.49±0.03),显著高于其在未处理的外泌体中相对表达量(1.00±0.04),差异有统计学意义(P<0.01)。
2.3抑制miR-21-5p功能下调对ESC增殖活性的影响CCK8结果显示,24、48、72 h ,抑制组的吸光度显著低于对照组和空白组(P<0.01),见图3。EdU染色结果显示,转染后48 h后,抑制组的ESC增殖活性[(7.47±0.44)%]显著低于对照组和空白组[(13.47±0.47)%、(14.60±1.08)%],差异有统计学意义(P<0.01)。见图4。
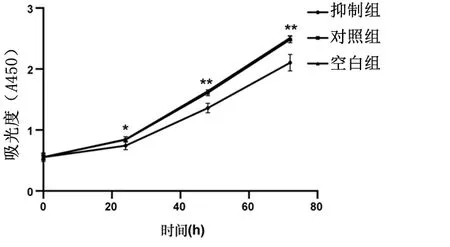
*P<0.05,**P<0.01图 3 抑制miR-21-5p对ESC增殖活性的影响Figure 3 Influence of inhibition of miR-21-5p on proliferation of ESC
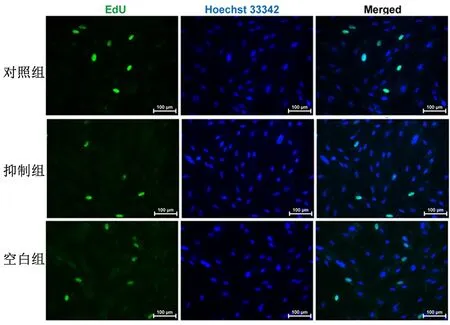
图示抑制组ESC增殖活性显著低于对照组、空白组图 4 抑制miR-21-5p对ESC增殖活性的影响Figure 4 Influence of inhibition of miR-21-5p on proliferation of ESC
2.4生物信息学分析预测miR-21-5p下游靶基因及其功能在TargetScan、miRDB和TargetMiner 3个miRNA数据库中对miR-21-5p的下游mRNA进行检索,并将所得的3个靶基因集合取交集,最终得到74个 miR-21-5p的潜在靶基因。通过GO 分析和KEGG通路富集分析预测这些靶基因的功能关联及其所参与的细胞信号调控,发现这些miR-21-5p的潜在靶基因参与2162种生物学进程(P<0.05)、300种分子生物学功能(P<0.05)和214种细胞学组分(P<0.05),并富集到3条细胞信号通路(P<0.05),推测miR-21-5p可能通过这些途径促进外泌体增殖和损伤子宫内膜损伤修复。见图5。
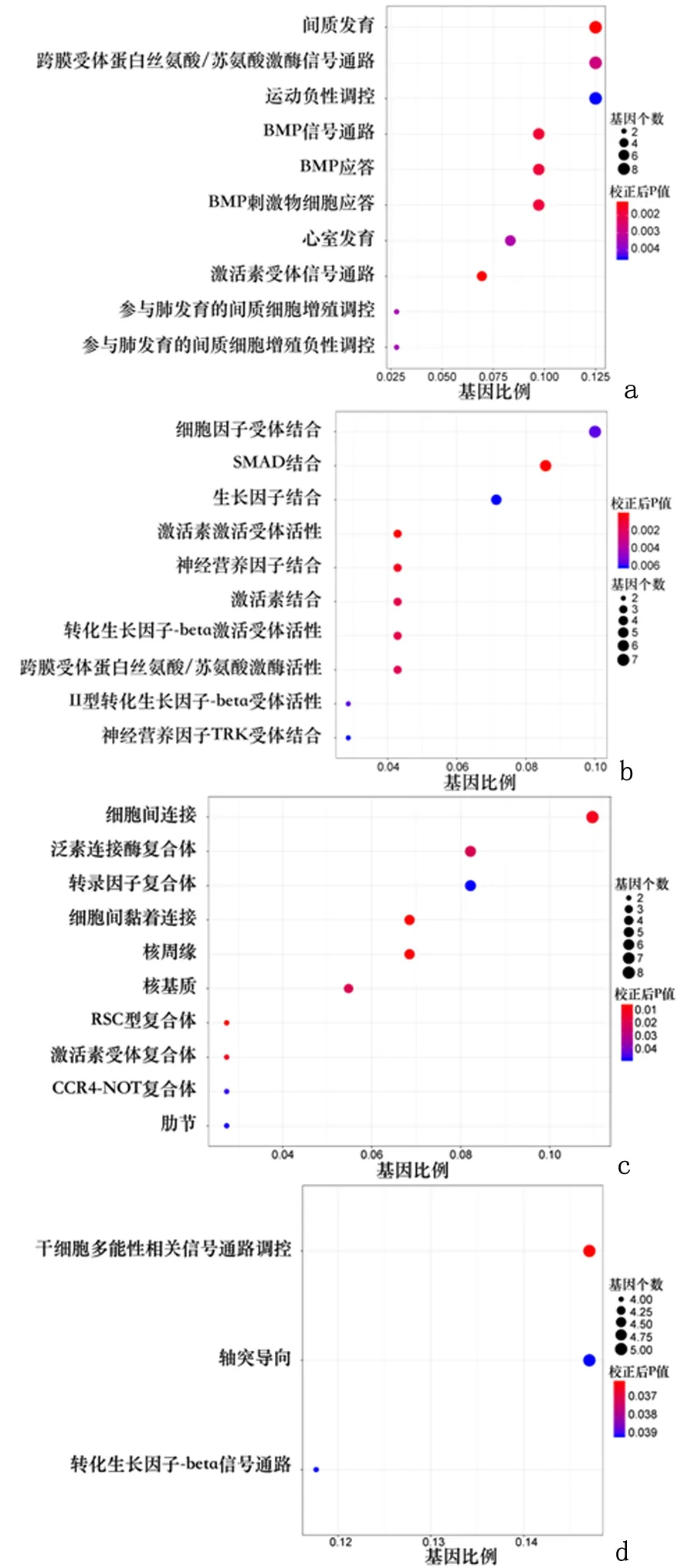
a:生物学进程; b:分子生物学功能; c:细胞学组分; d:KEGG富集分析图5 生物信息学分析预测ESC内miR-21-5p潜在靶基因Figure 5 Bioinformatic analysis for prediction of targeted genes of miR-21-5p in ESC
3 讨 论
本研究验证了UCMSC外泌体及其处理后的ESC内miR-21-5p的表达水平显著上调,并且抑制内膜间质细胞内miR-21-5p的功能可显著抑制其增殖活性,表明miR-21-5p在UCMSC外泌体促进ESC增殖的疗效机制中发挥关键的作用,是UCMSC外泌体中所包含的主要效应分子之一。此外,结合生物信息学分析预测发现74个ESC内miR-21-5p的潜在靶基因,并采用GO分析和KEGG分析预测其可能参与的ESC内与增殖相关的细胞信号通路和分子生物学活动。
与mRNA等大分子RNA相比,miRNA作为一种小分子单链RNA分子,更易于被母细胞分选装载到外泌体中,从而转运至靶细胞内,发挥负性调控其下游靶基因的生物学效应[13]。越来越多的证据显示,间充质干细胞外泌体所携带miRNA在心血管疾病、神经系统疾病、肝损伤、肾损伤和促进骨和软骨的再生等多种疾病的治疗研究中多种疾病条件下均能发挥有效的治疗效果,因而受到广泛关注[14]。而近期的多项基于miRNA高通量测序的研究结果显示,miR-21-5p在UCMSC外泌体中的表达水平较高,位于UCMSC外泌体内各种miRNAs表达丰度的前列,推测其可能易于被UCMSC分选至外泌体中,从而分泌至细胞外并被摄取至靶细胞内,是UCMSC外泌体中的主要效应分子之一[9, 15-16]。本研究通过荧光定量PCR检测发现,miR-21-5p在UCMSC外泌体内的表达水平确实显著高于UCMSC培养上清,表明UCMSC内的miR-21-5p主要通过外泌体分泌至细胞外环境并转运至靶细胞内,而非直接单独分泌至细胞外;此外,进一步结果发现UCMSC外泌体处理后的ESC内miR-21-5p的表达水平也显著升高,表明UCMSC确实通过其外泌体向ESC内成功转运了miR-21-5p,并可能是加速ESC增殖的主要效应分子。但本研究仅验证了UCMSC外泌体最低起效浓度条件下,ESC内miR-21-5p的表达水平的改变,高浓度条件下的情况尚需进一步实验验证。
miRNA-21-5p在UCMSC外泌体中的不仅表达水平较高,更在促进女性生殖系统的组织器官修复过程中发挥促进细胞增殖、抑制凋亡的作用。例如,UCMSC外泌体内miR-21-5p及其他4种高表达的miRNAs可显著促进阴道上皮细胞VK2的增殖活性、抑制其凋亡,发挥促进损伤阴道上皮的修复的作用[9];此外,UCMSC外泌体能够将miR-21-5p和miR-146a-5p转运至卵母细胞内,并激活其内的PI3K/mTOR通路,从而提高小鼠成熟卵母细胞的数量及质量,改善年龄相关性卵巢功能不全[17]。因此,我们进一步通过CCK8和EdU染色观察转染miR inhibitor的方法抑制ESC内miR-21-5p的活性,探索miR-21-5p对于ESC增殖活性的影响。结果均表明抑制miR-21-5p活性可显著下调ESC的增殖活性和增殖能力,从侧面证实了UCMSC外泌体miR-21-5p在促进ESC增殖中发挥关键作用。
miRNAs主要是通过与靶mRNA的3’非翻译区的结合,促进其降解或抑制其翻译,从而在表观遗传学水平负性调控其下游多种靶mRNA的表达水平,而一种miRNA往往识别上百种mRNA,并与其结合进行调控[18]。因此,为了探索UCMSC外泌体miR-21-5p在激活ESC增殖活性中的分子机制,同时在三个不同的miRNA数据库中检索miR-21-5p的潜在靶基因,并将其取交集整合,使其预测的准确性和可靠性显著提高。进一步将这些靶基因进行GO分析和KEGG通路富集分析,发现这些miR-21-5p的潜在靶基因所参与的分子生物学进程及细胞信号通路中包括多种参与调控间质细胞增殖和间质发育等生物学过程,及干细胞多能性调节、TGF-β等信号通路,而这些分子机制参与促进ESC增殖、抑制子宫内膜EMT等与子宫内膜再生修复相关的重要细胞及分子生物学进程[19-21],推测miR-21-5p可能通过这些途径促进损伤子宫内膜修复。虽然本研究完成了UCMSC外泌体miR-21-5p在促进子宫内膜损伤修复中生物信息学的预测,但如要进行深入研究,仍然需要设计进一步的实验验证其与下游靶基因的相互作用及相关表型的改变,在此未涉及。
综上所述,本研究显示UCMSC外泌体及其处理后的ESC内miR-21-5p的表达水平显著上调,抑制miR-21-5p活性可下调ESC增殖活性,表明UCMSC外泌体通过转运miR-21-5p能够有效促进ESC增殖。生物信息学分析则显示UCMSC外泌体所携带的miR-21-5p可能通过参与调控ESC内多种与子宫内膜再生修复相关的基因表达及信号通路,进而加速子宫内膜的再生修复。

