利妥昔与DC-CIK治疗ALL患儿的疗效及预后影响分析
苗巧,李艳秋
(四川省遂宁市中心医院 血液科,四川 遂宁 629000)
急性淋巴细胞白血病(acute lymphocytic leukaemia, ALL)多发于2~5 岁儿童[1],临床常用化疗及造血干细胞移植进行治疗,但不良反应多[2]。随着医学技术发展,过继免疫治疗中树突状细胞-细胞因子诱导的杀伤细胞免疫疗法(dendritic cells cytokine-induced-killer cell immunotherapy, DC-CIK)技术通过体外培养自身单个核细胞并回输,消灭体内微小残留病,阻止复发[3]。利妥昔通过结合淋巴细胞表面CD20 抗原消灭肿瘤,与化疗联合使用可显著提高疗效而不增加毒副作用[4]。本研究比较不同方案治疗儿童ALL 的临床疗效,以及利妥昔对DC-CIK 治疗预后的影响。
1 资料与方法
1.1 一般资料
选取2006年6月—2012年6月四川省遂宁市中心医院经细胞形态学、免疫学、遗传学及分子生物学确诊分型并完成整个治疗过程的ALL 患儿,并从中随机选取50 例做回溯性调查研究。纳入条件:①首次发病且为初次治疗;②经免疫分型判定为前体B 型ALL(Pre B-ALL);③CD20 表达量>20%;④无乙型肝炎、慢性粒细胞白血病、肿瘤等其他疾病。对照组为化疗联合DC-CIK 治疗,入组患儿25 例,年龄10个月至 13 岁,中位年龄6.7 岁;观察组为利妥昔、化疗及DCCIK 联合治疗,入组患儿25 例,年龄8个月至13 岁,中位年龄6.2 岁。患儿主要临床表征为:发热、疲倦、苍白、出血等,并伴有骨关节痛;部分有肝、脾、淋巴结 肿大等浸润表现。血象表征为:血红蛋白、红细胞及血小板减少,淋巴细胞比例增高,血液中出现数量不等的原始、幼稚淋巴细胞,多数患儿白细胞数目增高。骨髓涂片显示原始淋巴细胞及幼稚淋巴细胞总数>25%。
1.2 试剂与仪器
淋巴细胞分离液购自北京鼎国生物工程有限公司,Trizol 购自上海宝赛生物工程有限公司,Go ScriptTMReverse Transcription System 逆转录试剂盒和Go Tag qPCR Master Mix 实时荧光定量聚合酶链反应(qRTPCR)试剂盒购自美国Omega 公司。超净工作台购自珠海造鑫仪器有限公司,日本三洋-80℃超低温冰箱、芬兰Biohit 移液枪、Eppendorf 台式4℃离心机、美国ABI real-time PCR 仪、电热恒温水浴箱均购自上海精宏实验设备有限公司。
1.3 方法
1.3.1 对照组治疗方案 在儿童ALL 诊疗建议基础上,根据本研究实际情况按危险程度不同将所有患儿分为低危组(low risk, LR)、中危组(middle risk, MR)及高危组(high risk, HR)[5]。化疗过程主要包括诱导缓解治疗、早期强化治疗、巩固治疗、延迟强化治疗及维持治疗。诱导治疗采用长春新碱-柔红霉素-左旋门冬酰胺酶-地塞米松(VDLD)进行治疗,并根据患儿个体情况配合使用柔红霉素(DNR)。早期强化治疗采用环磷酰胺-阿糖胞苷-6-巯基嘌呤(CAM),中度及高度危险患儿需进行2 轮CAM 治疗。巩固治疗根据患儿危险度不同使用不同剂量的甲氨蝶呤(HD-MTX)。延迟强化治疗阶段使用长春新碱-阿霉素-左旋门冬酰胺酶-VDLD 联合CAM 方案。维持治疗采用6-巯基嘌呤(6-MP)并HD-MTX 及长春新碱-VDLD 鞘注。中度危险患儿增加1 轮延迟强化治疗及维持治疗。
1.3.2 观察组治疗方案 观察组患儿于诱导缓解治疗及巩固治疗开始前1 天给予利妥昔静脉注射,1 次/周,每次治疗2 周,共4 次。0~10 岁患儿利妥昔使用浓度为125 mg/m2,10 岁以上儿童188 mg/m2。利妥昔使用时用生理盐水稀释至0.5 mg/ml。首次滴注初速度控制在0.5 mg/min 以下,若无不良反应发生可增加至1 mg/min。每次用药前30 min 需静脉注射VDLD 并肌内注射非那根以降低毒副作用发生。
1.3.3 DC-CIK 治疗 达到细胞学完全缓解后进行DC-CIK 治疗,治疗前需经本院医学伦理委员会批准并告知患儿及监护人。在确定患儿血象及凝血功能正常后,无菌抽取患儿骨髓液30~50 ml。将抽取的骨髓液用无血清RPMI 1640 于37℃,5%二氧化碳CO2条件下培养得到贴壁细胞,后加入粒细胞-巨噬细胞集落刺激因子(GM-CSF)1 000 u/ml、白细胞 介素-4(IL-4)500 u/ml 培养10 d。培养过程中每3 天 换液1 次,收获前3 天加入肿瘤坏死因子-α(TNF-α) 10 μg/L 诱导DC 成熟,检测DC 免疫表型确定其成熟。在DC 即将成熟的同时,用血细胞分离机采集患儿外周血单核细胞50 ml,调整细胞密度至1×106个/ml 后与成熟DC 共培养。培养基中加抗CD3 单抗50 μg/ml、γ 干扰素(IFN-γ)1 000 u/ml、白细胞介素-1(IL-1) 100 u/ml、IL-2 300 u/ml,37℃、5% CO2,培养10 d,每3天换液1 次并于换液时补充IL-2。收获扩增后的DCCIK 细胞并质检,检验合格(无病原体,细胞活性达95%以上且细胞表型符合要求)后回输。回输分2 次 进行,每次回输间隔1 d,回输时给予皮下注射IL-2,持续10 d。根据治疗情况进行1~3个疗程不等,每个 疗程间隔3个月。统计两组患儿治疗前后外周血样及骨髓样本中CD3+、CD3+CD4+、CD3+CD8+、CD3-CD56+、CD3-CD19+比例,比较其组内和组间差异。
1.3.4 Per2、Bmal1 及EVI1 mRNA 表达水平的检测 先进行骨髓红细胞裂解,而后提取总RNA,并合成cDNA,应用qRT-PCR 检测EVI1 mRNA 表达,其中EVI1 正向引物为5'-GAGAGCAGCCTTACAGAT-3',反向引物为5'-GACATGTTCCCATTCTCATGT-3',产物长度为116 bp。β-actin 正向引物为5'-AGCTACGAGC TGCCTGAC-3',反向引物为5'-AAGGTAGTTTCGTGGA TGC-3',产物长度为150 bp。应用实时聚合酶链反应(real-time PCR)检测Per2、Bmal1 mRNA 的表达,从NCBI 数据中查找Per2、Bmal1的基因序列,其中Per2正向引物为5'-AACTGCCCCTGGACTAAGAAAT-3',反向引物为5'-GTTTGACCCGCTTGGACTT-3',产物长度为114 bp。Bmal1 正向引物为5'-ACTGTGCTAAG GATGGCTGTTC-3',反向引物为5'-TGGTTTGTAGTTT GCTTCTGTG-3',产物长度为122 bp。β-actin 正向引物为5'-TGACGTGGACATCCGCAAAG-3',反向引物为5'-CTGGAAGGTGGACAGCGAGG-3',产物长度为150 bp。反应条件:首先95℃预变性2 min,循环1 次; 95℃变性3 s,循环40 次;60℃退火/延伸30 s,循环 40 次;然后依次再95℃预变性15 s、60℃变性1 min、95℃退火15 s 和60℃延伸15 s 进行熔解程序。
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验;计数资料以例表示,比较采用χ2检验;生存分析方法采用Kaplan-Meier 生存曲线;P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿一般资料比较
两组患儿性别、年龄、危险程度、体重增加例数、血红蛋白及血小板达标例数、原幼稚淋巴细胞及完全缓解(complete response, CR)比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患儿一般资料比较 (n =25)
2.2 淋巴细胞亚群比较
观察组与对照组组内治疗前后CD3+CD4+,CD3+CD8+,CD3-CD56+比较,差异有统计学意义(P< 0.05);其他指标组内治疗前后比较,差异无统计学意义(P>0.05)。观察组与对照组组间治疗前后各项指标比较,差异无统计学意义(P>0.05)。见表2。
2.3 MRD 阴性例数比较
在MRD 检测中,判断为阳性的标准条件为MRD ≥0.01%或检出IgH/TCR 重排。比较两组患儿化疗及DC-CIK 治疗结束后半年MRD 水平。化疗结束后,对照组患儿MRD 阴性16 例(64%),观察组患儿MRD 阴性23 例(80%),两组患儿MRD 阴性差异有统计学意义(χ2=8.000,P=0.005)。DC-CIK 治疗结束后半年对照组患儿MRD 阴性17 例(68%),观察组患儿MRD 阴性24 例(96%),观察组患儿MRD阴性率高于对照组(χ2=4.500,P=0.034)。
2.4 不良反应
对照组患儿化疗过程中出现6 例(24%)轻、中度贫血,1 例(4%)血小板下降,2 例(8%)肝功能异常,5 例(20%)轻度感染,6 例(24%)发热;DC-CIK治疗过程中均出现不同程度发热症状,4 例(16%)皮疹。观察组患儿利妥昔联合化疗治疗过程中出现轻、中度贫血患儿7 例(28%),2 例(8%)血小板下降,2 例(8%)心悸,1 例(4%)寒战,6 例(24%)发热,3 例(12%)感染,2 例(8%)恶心;DC-CIK 治疗过程中也均有发热症状,2 例(8%)皮疹。两组患儿不良反应在药物治疗后改善,心、肾功能均无明显变化,肝功能影响较小,未出现严重感染及代谢疾病。
2.5 远期疗效
对照组患儿3年无事件生存率(event free survival, EFS)为72%,观察组患儿3年EFS 为84%,生存曲线见图1。其中对照组患儿低危组EFS 为81%,中危组EFS 为67%,高危组EFS 为33%;观察组 患儿低危组EFS 为94%,中危组EFS 为75%,高危组EFS 为50%。对照组患儿复发7 例(28%),平均复发时间(20.57±7.46)个月;观察组患儿复发4 例(16%),平均复发时间(20.75±6.02)个月。两组患者复发率和复发时间比较,差异无统计学意义(χ2=1.049,P= 0.306;t=0.094,P=0.926)。
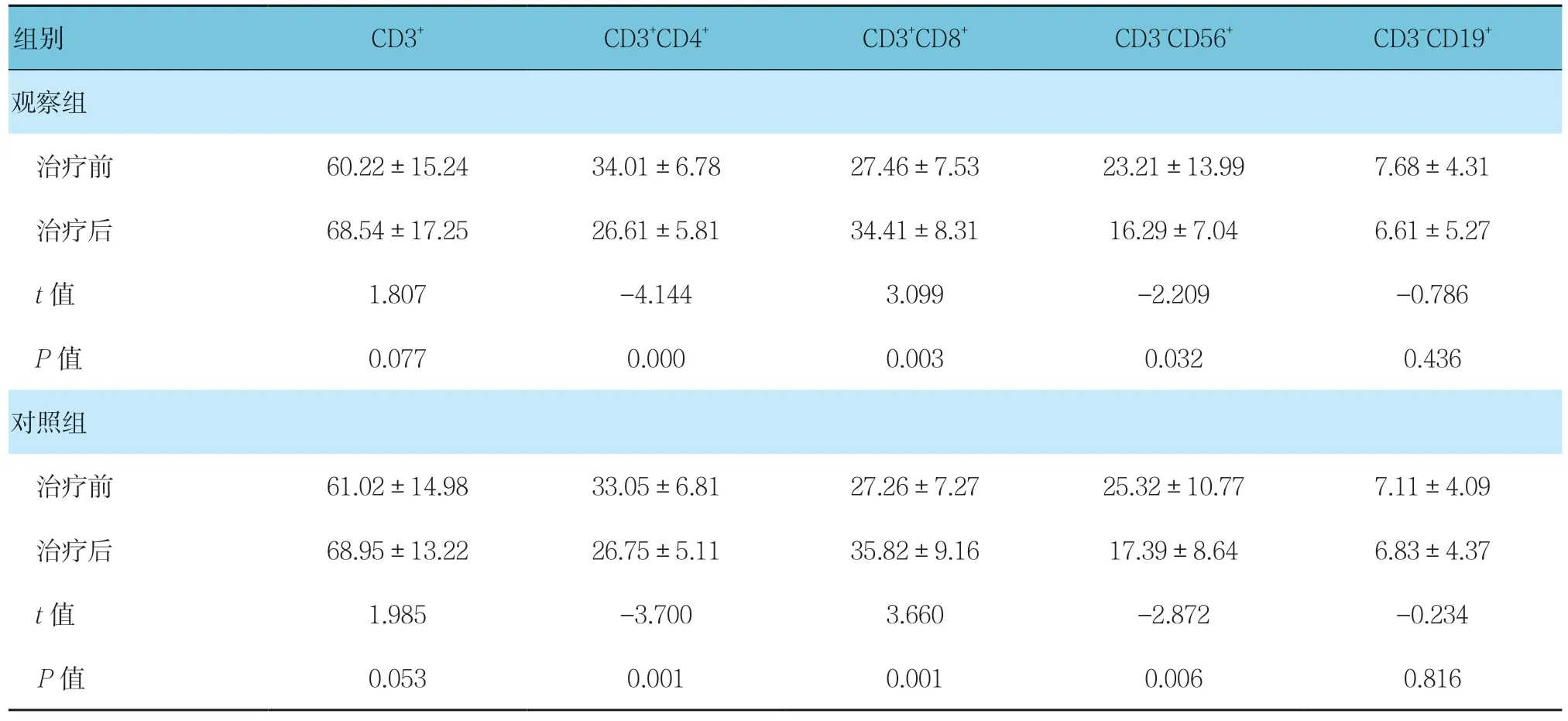
表2 两组患儿治疗前后CD3+、CD3+CD4+、CD3+CD8+、CD3-CD56+、CD3-CD19+比较 (n =25)
2.6 两组Per2 和Bmal1 mRNA 表达水平的比较
治疗前两组Per2 和Bmal1 mRNA 表达水平比较,差异无统计学意义(P>0.05)。治疗后两组Per2 和Bmal1 mRNA 表达水平比较,差异有统计学意义(P< 0.05),治疗后表达下降,且观察组低于对照组。见表3。
2.7 两组EVI1 mRNA 表达水平的比较
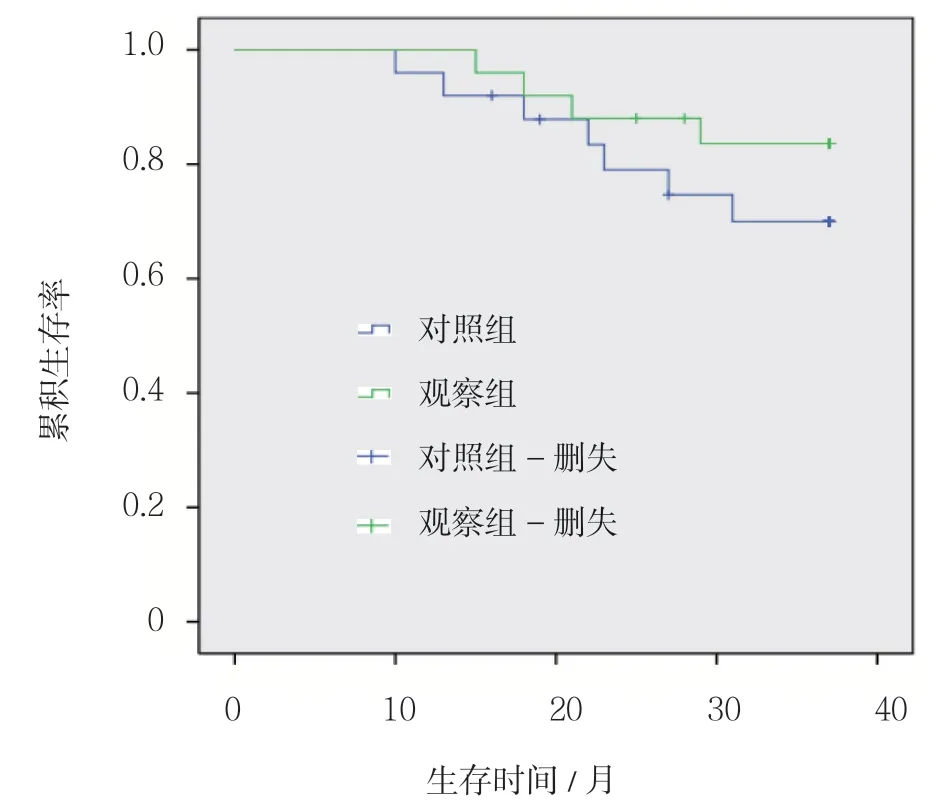
图1 两组3年生存曲线
治疗前两组EVI1 mRNA 表达水平比较,差异无统计学意义(P>0.05)。治疗后两组EVI1 mRNA 表达水平比较,差异有统计学意义(P<0.05),两组EVI1 mRNA的表达水平下降,且观察组低于对照组。见表4。
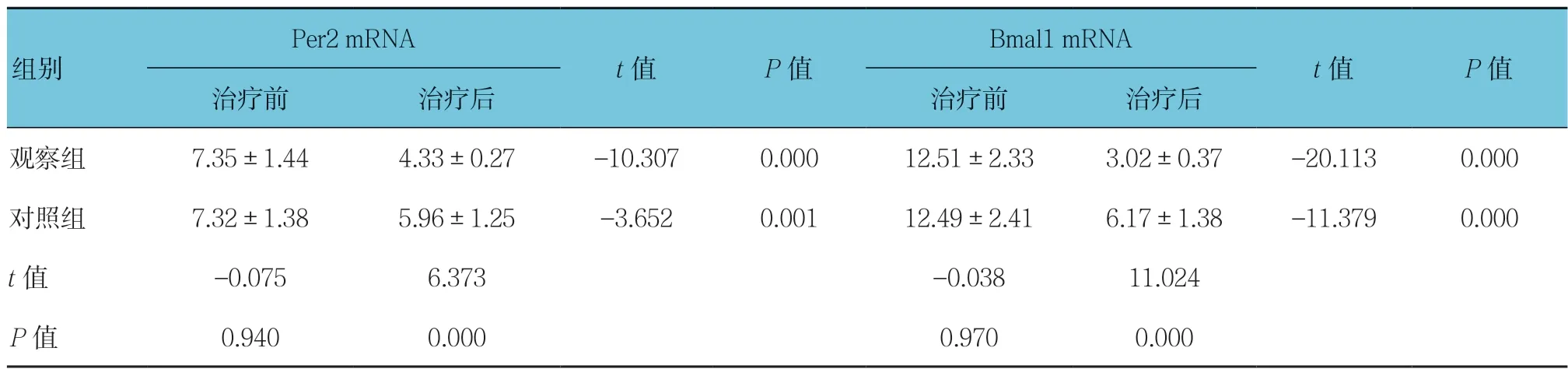
表3 两组Per2 和Bmal1 mRNA 表达水平的比较 (n =25)
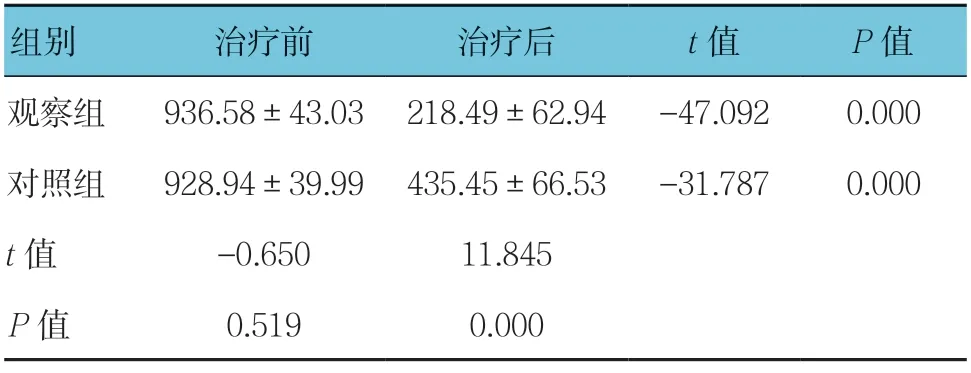
表4 两组EVI1 mRNA 表达水平的比较 (n =25)
3 讨论
ALL 由失去成熟及定向分化功能的未成熟白细胞引起,根据免疫分型可分为T-ALL 和B-ALL,其中Pre B-ALL 是最常见的一种。利妥昔是全球首个治疗恶性肿瘤的单抗药物,其通过结合CD20 抗原、抑制淋巴细胞增殖及增强化疗效果对Pre B-ALL 起治疗作用。CD20 抗原在前体B 细胞至成熟B 细胞的各阶段均于细胞膜上稳定表达,且不脱落不内化,利妥昔通过与CD20 结合激发机体自身免疫,消灭肿瘤细胞。约30%~40%的Pre B-ALL 表达CD20 抗原[6],因此利妥昔对这类Pre B-ALL 具有治疗作用。本研究结果表明,两组先期治疗使用利妥昔的患儿其治疗后Th(CD3+CD4+)、NK(CD3-CD56+)高于未使用利妥昔的患儿,而两者相比总T 细胞(CD3+)和B 细胞(CD3-CD19+)无差异。Th 细胞增加可使得机体细胞因子分泌增加,Th1 和Th2 分别参与细胞免疫及体液免疫;CTL 细胞可特异性杀伤肿瘤细胞;NK 细胞同样具有抗肿瘤作用,是机体重要免疫细胞,参与抗体依赖性细胞介导的细胞毒性试验过程。说明利妥昔配合DCCIK 治疗后机体特异性肿瘤杀伤能力增强。组间比较差异无统计学意义,说明利妥昔对后续细胞治疗过程中免疫细胞的变化无明显影响。
MRD 是诱发ALL 复发的主要因素[7]。DC-CIK治疗前观察组MRD 阴性率高于对照组;DC-CIK 治疗结束后半年观察组MRD 阴性率高于对照组。表明利妥昔对DC-CIK 清除MRD 的能力可能有一定程度促进作用。经过先期治疗的ALL 患者其自身免疫力极低,微量残留的肿瘤细胞易逃逸。而利妥昔可使淋巴细胞对化疗药物的细胞毒性更加敏感[8],范丽霞等[9]研究发现,患者连续使用利妥昔治疗4 周后其自身DC 细胞形态结构改变,对淋巴细胞刺激能力减弱,从而抑制淋巴细胞增殖。这些都使得DC-CIK 治疗前的MRD 水平更低。体外培养的DC 细胞及杀伤细胞CIK回输后免疫系统具有更大优势,因此清除MRD 更加彻底。因此,利妥昔配合DC-CIK 治疗的方法清除MRD 能力更强。
治疗过程中观察组感染率较对照组低,但恶心、心悸、寒战等不良反应较对照组多。观察组3年无事件生存率较对照组高,这与观察组较高的MRD 阴性率相关。本研究结果表明,利妥昔配合DC-CIK 治疗CD20 阳性的儿童Pre B-ALL 疗效更佳,利妥昔对DC-CIK 治疗预后有促进作用。此外,DWORZAK 等[10]研究显示治疗过程中一些患者会由CD20 阴性变为CD20阳性,这也使得利妥昔对CD20阴性的Pre B-ALL也具有潜在的治疗作用。PIEVANI 等[11]在培养CIK时加入利妥昔药物,发现CIK 抗肿瘤活性增强。该研究结果表明利妥昔配合DC-CIK 治疗存在更广泛的应用范围,其疗效也有进一步提高的可能。此外,本文发现,治疗后两组Per2 和Bmal1 及EVI1 mRNA 的表达水平下降,且观察组低于对照组。提示观察组治疗方案能够明显降低Per2、Bmal1 及EVI1 mRNA 的表达。究其原因,Per2基因的表达产物—PER2 蛋白能够抑制Cyclin B1 的转录,并上调p53 的蛋白量,从而影响肿瘤细胞周期的变化进程。而化疗药物又会对Per2基因的表达产生一定的抑制作用,因此在治疗后的表达明显下降。Bmal1基因则是通过在A3.01 细胞系内cpG 岛的甲基化而影响肿瘤细胞的表达,此种甲基化过程能够导致Bmal1基因正常转录表达出现沉默。因此,虽然Bmal1基因属于抑癌基因,但随着化疗药物的干预,其表达水平仍会发生一定程度的下降。EVI1过表达能够致使粒细胞分化过程受阻,并使红细胞的分化发生障碍,其对造血干细胞自身造血分化进程具有重要的调节作用。观察组经过综合治疗后,EVI1 表达水平下降的程度更低,这也从侧面证实观察组治疗方案相对更佳。但需指出,本研究由于样本数量有限,后续还应加大样本数量以期得到更加可靠的结论。此外,无论是利妥昔药物还是DC-CIK 治疗,其医疗成本较高,还不能被广泛使用,这也限制了该方法的应用。

