超微粉碎对怀山药粉抗氧化和体外消化性的影响
聂梅梅 肖亚冬 李大婧 冯蕾 张钟元 张培通 刘春泉 宋江峰 武敬楠 杨慧珍


摘要:采用振动式超微粉碎机对怀山药进行超微粉碎,研究超微粉碎前后怀山药粉抗氧化活性变化及其在体外模拟消化过程中功能性成分溶出率的影响。结果表明,超微粉碎显著改善了怀山药粉的抗氧化性、体外消化特性和胰脂肪酶活性抑制率。超微粉碎显著降低了怀山药粉体的粒径,超微粉碎5 min,粒径可以达到超微粉的要求。超微粉碎显著改善了怀山药粉的DPPH自由基清除率和Fe2+螯合能力,超微粉碎5 min,怀山药粉的DPPH自由基清除率比普通粉碎显著提高37.20百分点。此外,怀山药超微粉在胃肠消化中多糖得率显著高于普通粉碎。超微粉碎显著提高了怀山药粉的胰脂肪酶活性抑制率,超微粉碎5 min胰脂肪酶活性抑制率较高。
关键词:怀山药粉;超微粉碎;体外消化;抗氧化;胰脂肪酶活性
中图分类号:TS201.1 文献标志码:A 文章编号:1002-1302(2020)21-0224-05
怀山药(Dioscorea oppositifolia L.)是我国传统的药食同源物之一,富含糖蛋白、山药多糖、薯蓣皂苷元、淀粉、各种游离氨基酸和黄酮等生物活性成分[1-2],具有调节免疫、抗衰老、抗氧化、降血糖和降血脂等生理活性[3-4]。但因其收获季节集中,新鲜原料含水量高、体积大、易折断,常温下不耐贮存,易褐变腐烂,使保存和运输都很困难,直接影响其食用性,极大地限制了山药在食品中的应用。
超微粉碎作为一种新型的食品加工改性方法,指通过物理的剪切挤压等技术来克服被粉碎物料内部的凝聚力,从而达到使物料粒径极大程度减小的目的,将物料粒径粉碎至10~25 μm,由于粉碎细度远超普通粉碎方式,得到的粉体比表面积大、表面活性强,且会出现普通粉体所不具备的特殊功能,因此被广泛地应用于食品领域中[5-6]。超微粉碎可以粉碎常温下难以粉碎的物料,如葡萄籽和食用菌等,粉碎后的粉体,粒度更加微小和均匀,溶解性能改善,营养成分溶出率增加,易于人体吸收[7-8]。最新研究表明,超微粉碎后荞麦粉的理化性质与降糖及抗氧化功能特性显著提升[9]。然而关于超微粉碎对山药粉功能营养成分变化的研究较少。刘亚男筛选出怀山药粉的最佳干燥方式为喷雾干燥[10]。张雪等研究分析超微粉碎增加了怀山药粉中多糖溶出率,然而得出其粉碎时间为3 h,能耗较高[11],不适宜在工业化中应用。
为延长怀山药的贮藏期,提高怀山药的综合利用价值,本研究结合前期的试验结果,以真空冷冻干燥后的怀山药为原料制备粗粉,采用超微粉碎机进行不同时间的超微粉碎,探究超微粉碎前后怀山药粉抗氧化活性与体外模拟消化特性的变化,以及对胰脂肪酶活性的影响。研究超微粉碎对怀山药粉的功能性质,对于提高怀山药产品的附加值,实现怀山药精深加工具有重要的现实意义。
1 材料与方法
1.1 试验材料
供试山药品种为怀山药,产地为河南焦作,购自南京市孝陵卫集贸中心。试验于2020年5—8月在江苏省农业科学院农产品加工研究所实验室进行。
1.2 主要试剂与仪器
1.2.1 主要试剂 浓硫酸、盐酸、无水乙醇、葡萄糖等为分析纯试剂,购自国药集团化学试剂有限公司。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]、2,4,6-三(2-吡啶基)三嗪[2,4,6-Tri(2-pyridinyl)-1,3,5-triazine,TPTZ]均購自美国Sigma公司。胃蛋白酶(10 000 U/g)、胰酶(250 000 U/g)、猪胆盐,均购自上海麦克林生化科技有限公司。
1.2.2 仪器与设备 HH-8数显恒温水浴锅,购自上海江星仪器有限公司;FD-1A-50型冷冻干燥机,购自北京博医康实验仪器有限公司;XDW-6A振动式细胞级超微粉碎机,购自济南达微机械有限公司;FW100高速万能粉碎机,购自天津市泰斯特仪器有限公司;BS224S电子分析天平,购自赛多利斯科学仪器(北京)有限公司;DW-86L828型超低温保存箱,购自青岛海尔股份有限公司;H2050R台式高速冷冻离心机,购自湘仪离心机仪器有限公司;UV-6300紫外分光光度计,购自上海美谱达仪器有限公司;激光粒度分布仪,购自英国马尔文仪器有限公司;NI GI20体外模拟消化系统,购自澳大利亚NutraScan公司。
1.3 样品处理
新鲜山药清洗去皮切成1~5 mm的薄片,以质量分数为2.0%柠檬酸加0.1%抗坏血酸水溶液为护色剂,按料液比为1 g ∶ 10 mL在95 ℃烫漂 2 min,沥干水分,称质量后待用。
1.4 山药片的制备
取适量削皮切片后的山药,经预处理后进行真空冷冻干燥,将怀山药干燥至干燥终点(水分含量<5%),装入自封袋,置于干燥器中备用。
1.5 超微粉的制备
将得到的怀山药片用多功能粉碎机进行粉碎,每次粉碎时间为10~15 s,过100目筛,得到怀山药的粗粉。将怀山药粗粉放入超微粉碎机中进行超微粉碎,每次投样量一定,粉碎时间分别为2、5、10 min,得到3种微粉,分别命名为超微粉Ⅰ、超微粉Ⅱ、超微粉Ⅲ。并利用激光粒度仪测定怀山药超微粉的粒径。
1.6 抗氧化活性的测定
1.6.1 样品制备 准确称取1.0 g怀山药粉于100 mL具塞锥形瓶中,依次加入30 mL 50%(体积分数)乙醇,超声辅助浸提30 min(功率为300 W、频率为 40 kHz、温度为40 ℃),以1 000 g离心 10 min,将上层浸提液冻存于-20 ℃冰箱中,备用待测。
1.6.2 DPPH自由基清除能力测定 根据文献方法并略做调整[12]。精确量取2.0 mL提取液,加入2.0 mL DPPH无水乙醇溶液(0.2 mmol/L,DPPH试剂需现配现用)充分混合均匀,于室温下避光静置30 min,于517 nm波长处测定吸光度,以维生素C作阳性对照,以无水乙醇作空白对照,每份样品平行测定3次。
式中:Ds为样品(2.0 mL样品+2.0 mL DPPH)的吸光度;Dc为对照组(2.0 mL样品+2.0 mL无水乙醇)吸光度;Db为空白对照组(2.0 mL无水乙醇+2.0 mL DPPH)吸光度。
1.6.3 铁离子还原能力(ferric reducing ability of power,FRAP)的测定 FRAP试剂由0.3 mol/L pH值为3.6的醋酸缓冲液25 mL、10 mmol/L TPTZ溶液2.5 mL、20 mmol/L FeCl3溶液2.5 mL组成,测定前以10 ∶ 1 ∶ 1体积比混合[13]。准确取0.5 mL怀山药粉提取液,加入4.5 mL FRAP工作液,混匀后置于37 ℃恒温培养箱中反应30 min,以50%乙醇溶液为空白对照,于593 nm处测定混合液的吸光度[14]。
1.7 体外模拟消化
1.7.1 体外模拟胃消化 参照 Rufian-Henares等的方法[15],稍做修改。准确称取1.0 g怀山药粉于100 mL具塞锥形瓶中,按1 g ∶ 10 mL加入0.9% NaCl 溶液混合均匀,将pH值调为2.0±0.1后加入用 0.1 mol/L盐酸溶液配制的胃蛋白酶溶液(0.05 g)。空白组不加胃蛋白酶,避光条件下,置于 37 ℃、100 r/min恒温水浴摇床中消化1 h,每隔 0.5 h 取样1次,冰浴冷却后以800 g离心15 min,取上清液测定多糖含量。
1.7.2 体外模拟肠消化 参照 Pastoriza等的方法[16],以经过胃消化后的样品作为肠消化的初始时间0 h。首先用1 mol/L NaHCO3调节pH值到 7.0±0.1,加入5 mL胰酶-胆盐液(胰酶浓度为0.2 mg/mL,胆盐浓度为1.2 mg/mL,胆盐、胰酶溶解到0.1 mol/L NaHCO3)。空白组加5 mL 1 mol/L NaHCO3,避光条件下置于100 r/min 、37 ℃恒温水浴摇床中消化2 h,每隔0.5 h取样1次,冰浴冷却后以800 g离心15 min,取上清液测定多糖含量。多糖含量测定参考文献[17]。
1.8 胰脂肪酶活性测定
对胰脂肪酶活性的测定参照文献[18],并做出修改。准确称取100 mg胰脂肪酶溶于50 mL磷酸盐缓冲液中,得到2 mg/mL酶液。称取0.5 g样品于100 mL锥形瓶中,加入5 mL磷酸缓冲液、4 mL食用油和 10 mL胰脂肪酶液,置于37 ℃水浴锅中振荡1 h,然后置于沸水浴中5 min终止反应,冷却后以1 000 g离心10 min。采用滴定法,以酚酞作指示剂,用0.025 mol/L NaOH标准溶液滴定所释放的游离脂肪酸的量,记录NaOH的消耗量。空白试验中脂肪酶在反应终止后加入。样品的胰脂肪酶活性抑制率用以下公示表示:
式中:C为样品的胰脂肪酶活性抑制率;V0为空白组消耗NaOH的体积(mL);V1为样品消耗NaOH的体积(mL)。
1.9 数据统计分析
所有试验均重复3次,试验结果以平均值±标准偏差表示。采用Origin 8.5 软件制图,用SPSS 17.0 软件分析数据,对试验结果进行单因素试验统计分析及组间差异的Duncan's 多重比较。
2 结果与分析
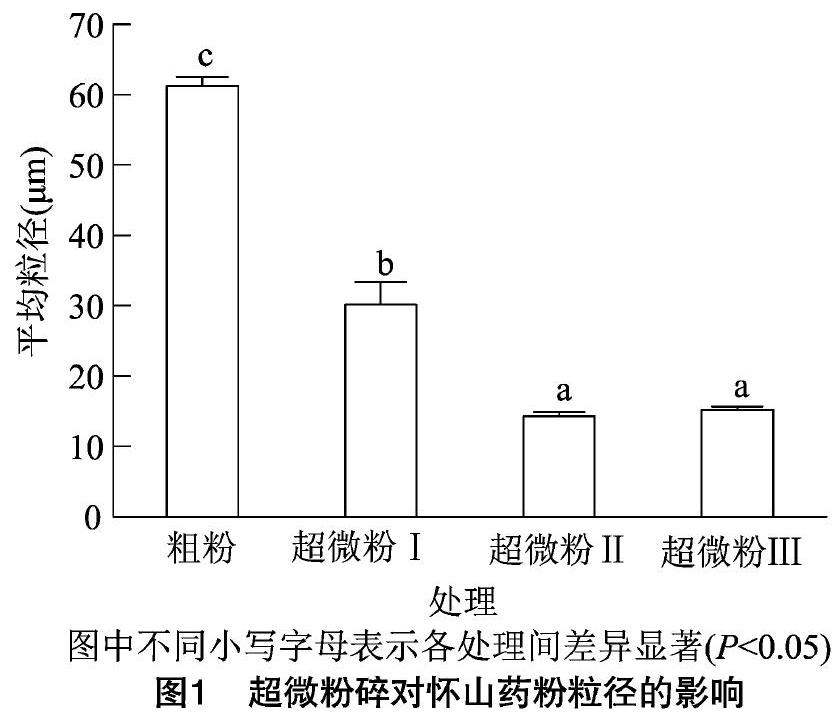
2.1 超微粉碎对怀山药粉粒径的影响
不同超微粉碎时间对怀山药粉粒径的影响如图1所示。超微粉碎显著降低了怀山药粉的粒径(P<0.05)。此外,粉碎后的超微怀山药粉粒度分布更加均匀。随着超微粉碎时间的延长,怀山药粉的粒径呈下降趋势,其中超微粉碎5、10 min之间没有显著性差异。超微粉碎5 min时,粒径达到 14.26 μm,已达到超微粉的粒径要求(超微粉粒径要求为10~25 μm)。王萍等采用振动磨粉碎机发现超微粉碎5 min获得的菠萝蜜粉粒径较小[19];而张雪等采用低温球磨机发现超微粉碎3 h后怀山药粉才达到超微粉的要求[11]。因此本试验中采用的振动式超微粉碎机在减少能耗的同时,能获得粒径较小且分布均匀的怀山药粉。
2.2 超微粉碎对怀山药粉抗氧化性的影响
研究结果表明,怀山药在抗氧化方面具有很好的效果。超微粉碎前后对怀山药粉抗氧化性的测定结果如图2所示。超微粉碎显著提高了怀山药粉的DPPH自由基清除率(图2-A)(P<0.05),超微粉碎5 min怀山药粉的DPPH自由基清除率比普通粉碎显著提高37.20百分点。长时间超微粉碎的过程会带来怀山药粉自身的氧化,这可能是超微粉碎 10 min 比超微粉碎5 min其DPPH自由基消除率显著下降的原因。不同超微粉碎时间怀山药粉Fe2+螯合能力如图2-B所示。结果显示,超微粉碎也显著改善了怀山药粉Fe2+螯合能力(P<0.05)。随着超微粉碎时间的延长,怀山药超微粉对Fe2+螯合能力呈现逐渐上升的趋势,超微粉碎5 min时,怀山药粉Fe2+螯合能力达到25.24%,比普通粉碎显著提高了8.83百分点。
王博等研究了气流式超微粉碎对杂粮粉DPPH自由基清除率的影响,结果表明微粉碎可以显著提高薏米粉与荞麦粉的自由基清除率[9]。普通粉碎仅使得较少的抗氧化活性物质释放出来,而超微粉碎使粉体粒径显著下降,粉体颗粒结构被破坏,使样品中處于结合状态或被包埋的多酚、黄酮等抗氧化物质被释放,因此超微粉碎能提高样品的抗氧化性能[20]。
2.3 超微粉碎对怀山药粉体外模拟消化的影响
体外模拟消化模型是评价食物中活性成分最终能被人体吸收利用的简单快速的方法,本试验研究了超微粉碎对怀山药中多糖经体外模拟胃消化后含量的变化规律,结果如图3所示。胃消化起始阶段,怀山药超微粉的多糖得率明显高于普通粉碎,表明超微粉碎促进了怀山药粉中多糖的溶出,这与之前研究结果[11]一致。然而在整个胃消化过程中,怀山药粗粉与超微粉的多糖得率几乎没有变化。这可能是因为胃消化不能将山药多糖分解,从而使得多糖释放量趋于平缓[21]。
膳食中营养成分的吸收主要发生在肠消化阶段,体外模拟肠消化过程中怀山药粉多糖释放量的变化规律如图4所示。模拟肠消化过程中,普通粉碎与超微粉碎怀山药中多糖得率呈下降趋势,主要是消化酶参与了多糖的消化吸收。在肠消化0~2 h过程中,怀山药超微粉多糖得率始终高于普通粉碎,一方面可能由于超微粉碎降低了粉体粒径有利于多糖的溶出,另一方面可能是在肠消化过程中,超微粉碎延缓了怀山药中多糖的释放。研究表明,许多天然产物多糖对肠道功能能够产生积极的影响,如促进肠道蠕动[22]。本试验结果表明,怀山药超微粉在胃肠消化中多糖得率明显高于普通粉碎,这对于开发山药营养代餐粉具有重要的指导意义。
2.4 超微粉碎对怀山药粉胰脂肪酶活性的影响
消化酶活性是影响机体对营养物质消化吸收的重要因素。胰脂肪酶是水解肠道中脂肪的关键酶,能催化甘油三酯水解为甘油和脂肪酸。通过抑制胰脂肪酶的活性可以有效地降低膳食脂肪的水解作用[23],因此寻求高效的胰脂肪酶抑制剂对预防和治疗肥胖具有重要的实际意义。超微粉碎前后怀山药粉的胰脂肪酶活性变化如图5所示。结果显示,超微粉碎可以显著提高怀山药粉的胰脂肪酶活性抑制率,随着超微粉碎时间的延长,怀山药粉的胰脂肪酶活性抑制率呈现上升趋势。其中,经过超微粉碎5 min,怀山药粉的胰脂肪酶活性抑制率较高,抑制率达到51.24%,比普通粉碎显著提高30.19百分点。研究表明,超微粉碎可以显著增加功能性成分的溶出,如皂苷类、多酚类物质[24],而多酚类化合物能有效抑制胰脂肪酶的活性[25]。并且,超微粉碎能使得普通粉体中未暴露的活性基团充分暴露出来,能表现出普通粉碎所不具备的特殊性能。最新研究表明,超微粉碎可以显著提高杂粮粉的胰脂肪酶活性抑制率,比较得出青稞超微粉的抑制率最高[9]。此外,不同浓度山药多糖使胰脂肪酶活性降低,并且随着铁棍山药多糖浓度的升高,胰脂肪酶的活性也随之下降,呈现出一定的剂量依赖性[26]。此外,超微粉碎不仅有利于原料中营养成分的溶解,而且有利于生物活性成分的提取,从而发挥其功能活性。相比于普通粉碎,超微粉碎得到的丝瓜果皮提取物对白细胞和炎症细胞中的谷氨酸-丙酮酸转氨酶、肿瘤坏死因子-α、白细胞介素-1β和前列腺素2含量具有良好的抑制作用[27]。本试验结果表明,怀山药超微粉比普通粉表现出较高的胰脂肪酶活性抑制率,这为开发适合年轻人青睐的山药减肥餐提供了理论基础。
3 结论
本试验采用振动式超微粉碎,研究了怀山药粉在超微粉碎前后抗氧化活性和体外模拟消化特性的变化。本试验结果表明,超微粉碎能显著提高怀山药DPPH自由基清除率和Fe2+螯合能力,超微粉碎 5 min,怀山药粉的DPPH自由基清除率比普通粉碎显著提高37.20百分点。经体外模拟消化后,怀山药超微粉多糖得率显著高于普通粉。此外,超微粉碎可以显著提高怀山药粉的胰脂肪酶活性抑制率,超微粉碎5 min胰脂肪酶活性抑制率较高。
参考文献:
[1]陆海波,赵 华,田 梁,等. 怀山药黄酒酿造工艺[J]. 食品与发酵工业,2016,42(1):76-80.
[2]周 玥,郭 华,周 洁.铁棍怀山药中主要营养成分的研究[J]. 中国食物与营养,2011,17(3):69-71.
[3]詹 彤,陶 靖,王淑如. 水溶性山药多糖对小鼠的抗衰老作用[J]. 药学进展,1999,23(6):356-360.
[4]王永明. 山药提取物对4周大强度训练大鼠血清和部分组织抗氧化能力影响的研究[D]. 开封:河南大学,2010.
[5]杨春瑜,柳双双,梁佳钰,等. 超微粉碎对食品理化性质影响的研究[J]. 食品研究与开发,2019,40(1):229-233.
[6]孙军涛,张智超,肖付刚,等. 玉米芯水热预处理酶解糖化[J]. 江苏农业学报,2019,35(3):696-700.
[7]胥 佳,魏嘉颐,李锦麟,等. 超微粉碎处理对葡萄籽中原花青素和脂肪酸成分的影响[J]. 中国农学通报,2011,27(17):92-97.
[8]Zhang M,Zhang C J,Shrestha S. Study on the preparation technology of superfine ground powder of Agrocybe chaxingu Huang[J]. Journal of Food Engineering,2005,67(3):333-337.
[9]王 博,姚軼俊,李枝芳,等. 超微粉碎对4种杂粮粉理化性质及功能特性的影响[J]. 食品科学,2019:41(19):111-117.
[10]刘亚男. 怀山药全粉的制备及其性质研究[D]. 洛阳:河南科技大学,2017.
[11]张 雪,陈复生,邹 建,等. 超微粉碎对小米、怀山药物化性质及功能成分影响的研究[J]. 食品科技,2019:44(6):176-182.
[12]Park J H,Jeon G I,Kim J M,et al. Antioxidant activity and antiproliferative action of methanol extracts of 4 different colored bell peppers (Capsicum annuum L.)[J]. Food Science and Biotechnology,2012,21(2):543-550.
[13]王 迪. 干燥与烫漂方式对黄秋葵品质及抗氧化能力的影响[D]. 南京:南京师范大学,2016.
[14]Zhang H,Jiang L,Ye S,et al. Systematic evaluaton of antioxidant capacities of the ethanolic extract of different tissues of jujube (Ziziphus jujuba Mill.) from China[J]. Food and Chemical Toxicology,2010,48(6):1461-1465.
[15]Rufián-Henares J A,Delgado-Andrade C. Effect of digestive process on Maillard reaction indexes and antioxidant properties of breakfast cereals[J]. Food Research International,2009,42(3):394-400.
[16]Pastoriza S,Delgado-Andrade C,Haro A,et al. A physiologic approach to test the global antioxidant response of foods. The GAR method[J]. Food Chemistry,2011,129(4):1926-1932.
[17]芦 宇,焦天慧,李萌萌,等. 生姜山药复合粉工艺优化及其体外模拟消化研究[J]. 中国食品学报,2018,18(11):87-95.
[18]王 秋. 谷物杂粮超微混合粉营养、功能特性及其应用的研究[D]. 哈尔滨:哈尔滨商业大学,2015.
[19]王 萍,陈芹芹,毕金峰,等. 超微粉碎对菠萝蜜超微全粉品质的影响[J]. 食品工业科技,2015,36(1):144-148.
[20]Zhong C,Zu Y G,Zhao X H,et al. Effect of superfine grinding on physicochemical and antioxidant properties of pomegranate peel[J]. International Journal of Food Science & Technology,2016,51(1):212-221.
[21]闵芳芳,聂少平,万宇俊,等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学,2013,34(21):24-29.
[22]吴光杰,田颖刚,谢明勇,等. 车前子多糖对便秘模型小鼠通便作用的研究[J]. 食品科学,2007,28(10):514-516.
[23]Sternby B,Hartmann D,BorgstroM B,et al. Degree of in vivo inhibition of human gastric and pancreatic lipases by Orlistat(Tetrahydrolipstatin,THL)in the stomach and small intestine[J]. Clinical Nutrition,2002,21(5):395-402.
[24]张美霞,任晓霞. 超微粉碎过程对金银花中功能成分的影响[J]. 食品科学,2016,37(8):51-56.
[25]张 忠. 多酚对胰脂肪酶活性的抑制作用[J]. 食品工業,2013(8):168-170.
[26]于海芬. 铁棍山药多糖的纯化、结构及胃肠调节活性研究[D]. 天津:天津科技大学,2019.
[27]Chou L H,Liu H L,Kao T H. Effect of micronization process on the functional component content and anti-inflammatory activity of Luffa cylindrical peel[J]. Journal of Functional Foods,2016,27,150-159.毛晓娟,刘家祥,任 妮,等. 基于物联网的数字温室环境自动调控系统设计[J]. 江苏农业科学,2020,48(21):229-232.

