新疆野苹果和栽培苹果特异性SSR标记开发及应用
于少帅 赵文霞 姚艳霞 淮稳霞 覃伟权 阎伟


摘要:根据全基因组测序已完成的栽培苹果基因组,设计、筛选针对新疆野苹果的特异性SSR引物。通过PCR扩增、基因测序筛选了15对可以在新疆野苹果和栽培苹果中扩增出稳定性高且具备多态性目的条带的特异性SSR引物;其中8对仅能在栽培苹果中扩增出特异性目的条带。15对特异性SSR引物对新疆野苹果和栽培苹果不同居群的SSR分析表明,新疆野苹果遗传多样性较为丰富,与栽培苹果不同居群分化程度较为显著,基因流水平较低。聚类分析表明,这15对特异性SSR引物可以将新疆野苹果和栽培苹果不同居群清晰区分。本研究利用新开发的SSR引物不仅可以揭示新疆野苹果和栽培苹果的遗传多样性和系统发育关系,对初步了解SSR变异位点的生物学功能以及丰富新疆野苹果和栽培苹果基因组的认识也有一定的作用,从而为更好地有效利用相关资源提供研究基础。
关键词:新疆野苹果;栽培苹果;SSR标记;遗传多样性
中图分类号:S661.101 文献标志码:A 文章编号:1002-1302(2020)21-0068-06
新疆野苹果(Malus sieversii)属第三纪孑遗植物,是林果产业可持续发展的重要天然种质基因库。近年来,受人类活动的干扰和苹果小吉丁虫等病虫害威胁,新疆野苹果自然种群无法更新,大面积衰败和死亡。因此,探究新疆野苹果林生态退化机制,筛选抗病虫害、抗逆性新疆野苹果株系,加强新疆野苹果资源的保护和利用已成为新疆野苹果生产上亟待解决的迫切问题。这对于新疆野果林的生态保育与修复、苹果优质新品种培育和我国果品产业的可持续健康发展具有一定的理论意义和应用价值。
近年来,新疆野苹果的生存状态受人类活动、病虫害等影响严重[1-3]。自然条件下植物的健康状况往往不是受单一因子的影响,而是受病害、虫害、生境、植物自身特征等多种因子综合影响[4]。研究发现,受苹果小吉丁虫危害枯死的新疆野苹果枝干上分布着大量苹果腐烂病菌,苹果小吉丁虫往往和苹果腐烂病等混合发生,复合危害新疆野苹果林的生存状态[3]。因此,在新疆野苹果保育过程中采取单一的防治手段较难起到较为理想的保护、防治效果。在寻找引起新疆野苹果种群退化的关键因子,保护新疆野苹果的同时,保护、选育和栽培具有抗逆性新疆野苹果遗传资源应该是控制其种群衰退最为经济有效的措施。
新疆野苹果的遗传变异和系统发育研究表明,新疆伊犁哈萨克自治州巩留县、新源县等地的新疆野苹果种群存在丰富的遗传多样性,种群内部遗传分化程度较高。新疆野苹果种群内不同个体叶形等表型性状的变异与简单重复序列(simple sequence repeats,SSR)标记的位点有一定的相关性[5-9]。Klabunde等用11对SSR引物对152份不同苹果叶斑病抗性的巴西栽培苹果接穗的遗传多样性进行评估发现,不同抗性栽培苹果间存在丰富的遗传多样性,其中在苹果叶斑病抗病、感病品种间遗传结构差异显著,有120个等位位点是抗病品种独有的[10]。作为一种分辨率高、遗传信息量大、操作相对简单的标记方法,SSR标记被广泛应用于新疆野苹果遗传结构、系统发育和表型性状相关性研究中[5,7-8,11-13]。但是,应用于新疆野苹果遗传变异研究的SSR引物均为非特异性引物,SSR引物扩增序列的功能未知,因此,新疆野苹果种群或个体间遗传差异的具体序列及生物学作用难以确定。
因新疆野苹果全基因组尚未测序,对于其基因的认识尚不全面。本研究根据全基因组测序已完成的栽培苹果基因组,筛选与苹果抗逆性相关的功能基因序列。根据选择的模板设计SSR引物,筛选在新疆野苹果和栽培苹果中具备扩增特异性、稳定性和多态性的SSR引物。通过新开发的SSR引物,丰富对新疆野苹果基因组的了解。通过开发的特异性SSR引物对新疆野苹果或栽培苹果进行遗传多样性分析,可以明确新疆野苹果种群或个体间在基因水平或生物学功能方面的差异。
1 材料与方法
1.1 试验材料
1.1.1 样品调查采集 新疆野苹果枝叶样品分别于2016年8月至2017年9月采自新疆维吾尔自治区伊犁哈萨克自治州巩留县和新源县,栽培蘋果枝叶样品于2017年7月至8月采自山东省青岛市和烟台市。包括11类44份样品,每个类群采4份样品,样品信息如表1所示。
1.1.2 试剂和仪器 植物基因组DNA提取试剂盒、SYBR Green I染料购自北京艾德莱生物科技有限公司,2×Taq Mix购自北京博迈德基因技术有限公司,Hi-Di去离子甲酰胺、POP-7 Polymer、GS-500LIZ 分子量内标购自美国应用生物系统公司,LongGene A200型基因扩增仪、DYY-6C型电泳仪购自北京市六一仪器厂,乙醇等其他化学试剂购自国产分析纯。
1.2 试验方法
1.2.1 DNA提取 样品干燥粉碎后取0.1 g,通过十六烷基三甲基溴化铵(CTAB)法提取新疆野苹果和栽培苹果叶片基因组DNA,用1%琼脂糖凝胶电泳和核酸蛋白检测仪检测DNA质量与浓度,-20 ℃ 保存备用。
1.2.2 SSR引物设计 采用NCBI上已报道的栽培苹果品种金冠基因组为模板设计SSR引物。栽培苹果品种金冠基因组序列号为NC024253[14]。根据已报道的栽培苹果品种金冠的苹果基因组,筛选与苹果抗逆性相关的基因片段,用SSRHunter软件对获得的与苹果抗逆性相关的基因片段进行扫描获得微卫星片段。用扫描获得的微卫星片段为模板,采用Primer Pemier 5软件设计了49对SSR引物,初步筛选获得34对能扩增出SSR片段的引物,34对引物信息如表2所示。引物合成及DNA测序由北京睿博解码生物科技有限公司完成。
1.2.3 PCR扩增 毛细管电泳PCR反应体系是 30 μL,包括1 μL DNA模板、1 μL forward/reverse 引物(10 μmol/L)、15 μL 2× PCR Master Mix (包括 0.05 U/μL Taq DNA polymerase、4 mmol/L MgCl2、0.4 mmol/L dNTPs),剩余用ddH2O补齐。PCR反应条件为95 ℃ 5 min;然后是95 ℃ 30 s、52 ℃ 30 s和 72 ℃ 30 s,循环35次;最后72 ℃延伸10 min。PCR扩增结束后,取0.3 μL PCR产物用ABI 3730XL DNA analyzer进行毛细管电泳分析。DNA测序PCR反应体系25 μL:1 μLDNA模板、0.5 μL forward/reverse 引物(10 μmol/L)、12.5 μL 2×PCR Master Mix (包括 0.05 U/μL Taq DNA polymerase、4 mmol/L MgCl2、0.4 mmol/L dNTPs),最后用ddH2O补齐。PCR扩增条件是95 ℃ 5 min;然后是95 ℃ 30 s、52 ℃ 30 s和72 ℃ 30 s,循环35次;最后72 ℃延伸10 min。
1.3 数据处理和分析
利用GeneMarker 2.2.0软件通过植物分析类型GS500大小的标准对等位基因进行定位。SSR位点的多态性通过多态性等位基因百分比和等位基因数量来评估。不同类群间的遗传多样性通过观察杂合度(Ho)和期望杂合度(He)来评估,通过Na、Ne、香农指数(I)和Nei's遗传多样性指数(H)来分析,这些参数由POPGENE1.32软件完成[15]。基因分化水平通过基因分化指数(Fst)和基因流(Nm)来评估。基于Nei's无偏差遗传距离和简单匹配系数(SM)通过UPGMA法则计算。利用MEGA 7.0软件和NTSYSpc 2.10e软件(Exeter Software,Setauket,NY)构建系统发育树[16]。
2 结果与分析
2.1 SSR引物PCR扩增分析
通过PCR扩增验证新设计的SSR引物的特异性、稳定性和多态性。结果表明,34对SSR引物能在新疆野苹果或栽培苹果中稳定扩增出SSR目的条带,而其他SSR引物为非特异性扩增。34对引物中,8对引物只能在栽培苹果中扩增出SSR目的条带,引物信息如表2所示;26对引物既能在栽培苹果又能在新疆野苹果中扩增出SSR目的条带。这26对既能在栽培苹果又能在新疆野苹果中扩出目的条带的SSR引物中,具有多态性的引物有15对,引物信息如表2所示,其他11对引物无多态性。
2.2 新疆野苹果、栽培苹果遗传分化和SSR位点多态性分析
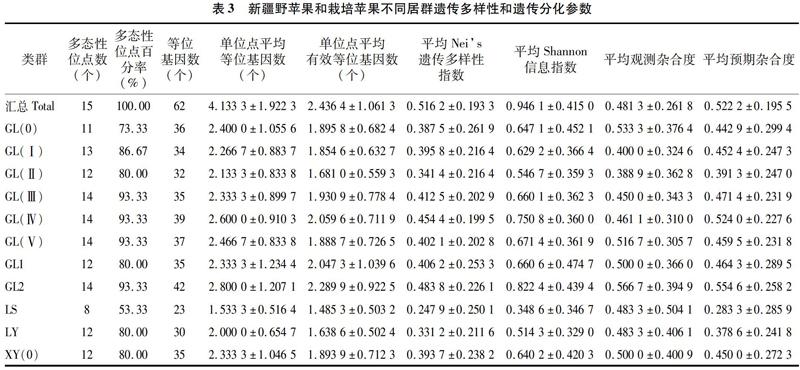
在新疆野苹果和栽培苹果11个居群44个个体中,15对SSR引物共扩增出62个等位基因,平均每个位点扩增出4.13个等位基因。根据基因多样性Na、Nei指数、香农指数、He、Ho等遗传多样性参数可知,检测的新疆野苹果样品遗传多样性较为丰富。一般认为Fst值为0~0.05时,遗传分化低;Fst值为0.05~0.25时,为中等程度遗传分化;Fst值>0.25,表明其具备显著的遗传分化水平[17]。11个居群间的遗传分化指数(Fst)为0.250 3,基因流(Nm)为0.749 0,说明居群间具有较高程度的分化水平,基因流较低,11个居群的分化水平较为显著,结果如表3所示。15对SSR引物在44份样品中共扩增出62个等位基因,平均每对引物扩增出4.13个等位基因。引物XS72-1-1和XS71-1-4扩增出的等位基因个数相对较多,分别为9个和8个;引物XS24-1-5-2扩增出的等位基因个数相对较少,仅有2个等位基因,结果如表4所示。引物XS72-1-1和XS71-1-4所在基因序列编码的蛋白分别为类转录因子TCP8X4型和类TMV抗性蛋白N,SSR引物XS24-1-5-2所在基因序列编码的蛋白则为转录因子RAX3[14]。
2.3 新疆野苹果和栽培苹果系统发育分析
系统发育分析表明,新疆野苹果和栽培苹果Nei's无偏差遗传距离在-0.001 5~0.808 4之间,如表5所示。新疆新源县的新疆野苹果XY(0)与新疆巩留县的新疆野苹果GL2的遗传距离值最小,2个新疆野苹果居群具有较高的遗传相似性。新疆野苹果GL(0)种群与山东青岛的栽培苹果LS种群的遗传距离值最大,说明2个种群遗传分化较大。基于Nei's无偏差遗传距离通过UPGMA法构建了新疆野苹果和栽培苹果不同种群的系统发育树。通过新开发的15对SSR引物,可将11个新疆野苹果和栽培苹果居群清晰分开,共形成2个大的进化分枝。采自山东烟台、青岛的栽培苹果种群LS和LY单独位于一个进化分枝,采自新疆新源和巩留的新疆野苹果种群单独聚于一个进化分枝(图1)。基于SM相似性系统构建的UPGMA系统发育树表明,不同种群新疆野苹果和栽培苹果44个个体聚于不同的进化分枝,可以清晰区分。采自新疆巩留和新源的新疆野苹果36个个体聚在一个进化分枝,栽培苹果8个个体聚于一个进化分枝(图2)。
3 结论与讨论
本研究根据栽培苹果金冠的基因组,选择与苹果抗逆性相关的DNA序列为模板设计SSR引物[14]。最终,成功设计并筛选到15对SSR引物可在新疆野苹果和栽培苹果中稳定扩增出特异性、多态性的目的条带;8对SSR引物仅能在栽培苹果中特异性扩增出SSR目的条带,并且差异的SSR目的条带编码的蛋白产物也是已知的。因此,通过新开发的SSR引物 可以初步筛选出一些抗源材料或抗性基因,这些材料对于新疆野果林生态恢复和优良抗性品种创制具有一定的作用。通过15对SSR引物对我国不同地区新疆野苹果和栽培苹果进行遗传多样性和系统发育分析,揭示了新疆野苹果和栽培苹果种群内存在丰富的遗传多样性。新疆野苹果和栽培苹果遗传关系较近,但遗传分化较为明显。新疆野苹果不同种群亲缘关系较近,遗传分化不明显。栽培苹果不同类群遗传关系较近。
研究表明,新疆野苹果2个居群的Nei's无偏差遗传距离为负值,2个类群分别是1个采自新源的新疆野苹果居群和1个采自巩留的新源野苹果居群。已有研究表明,生活在天山公路两边的马鹿种群之间遗传距离为负值,种群间杂合度、基因型数量无差异;马鹿栖息地被公路隔绝,栖息地内杂合度、基因型数量降低,马鹿迁徙交流受公路影响而导致种群退化[18]。受人类活动影响,近交导致种群内杂合度降低,遗传距离为负值。由此可见,适当增加不同种群新疆野苹果间的基因交流,有利于增加不同居群的杂合度,增加基因型数量,且能有效防止种群退化现象的发生。
目前引起新疆野苹果枯死的胁迫因子尚不清楚,因此,同一灾害条件下,表现出健康状态的个体所具有的抗性类型也不明确。通过不同症状新疆野苹果个体的分子遗传变异特征,或许可以找到一些与新疆野苹果抗逆相关的线索。DNA分子标记在不同抗逆性植物乃至栽培苹果的遗传多样性和系统发育研究中有很好的应用[19-24]。DNA分子标记有显性分子标记和共显性分子标记2种,共显性标记揭示的遺传信息更全面、细腻,其中,由于植物体内存在大量的简单重复序列,因此,共显性的SSR标记揭示的遗传信息更为丰富,并且检测成本低、周期短,对DNA质量要求不苛刻,操作相对简便[25]。SSR标记在不同抗性植物乃至栽培苹果的分子遗传检测中有很好的应用[8,10,26]。
本研究采用SSR分子标记用于新疆野苹果不同抗性材料的分子遗传和系统发育研究。但目前用于新疆野苹果遗传多样性分析的SSR引物扩增的目的片段均为非特异性扩增,目的条带的功能及编码的蛋白尚不明确,因此通过SSR引物对新疆野苹果或栽培苹果不同种群、不同个体进行分析,所揭示的遗传差异片段具备的生物学功能有待确定。而本研究基于确切基因模板设计的SSR引物,所得序列编码的蛋白均已知,如SSR引物XS72-1-1和XS71-1-4所在基因序列编码的蛋白分别为类转录因子TCP8X4型和类TMV抗性蛋白N,SSR引物XS24-1-5-2所在基因序列编码的蛋白为转录因子RAX3[14]。基于本研究设计的15对SSR分子标记,不仅可以揭示新疆野苹果或栽培苹果不同种群、不同个体间丰富的遗传多样性及彼此之间的系统发育关系,而且差异片段的生物学功能也一目了然,有利于深刻了解植物间的遗传变异。
参考文献:
[1]王春晓,赵 褔,赵健桐,等. 新疆发生苹果小吉丁虫 [J]. 新疆农业科学,1995(5):225-226.
[2]刘 华,臧润国,丁 易,等. 天山西部新疆野苹果种群特征[J]. 林业科学,2010,46(11):1-7.
[3]刘爱华,张新平,温俊宝,等. 天山野苹果林苹果小吉丁与苹果腐烂病复合危害研究[J]. 新疆农业科学,2014,51(12):2240-2244.
[4]Agrios G N. 植物病理学[M]. 3版. 沈崇尧,译. 北京:中国农业出版社,2009:121-130.
[5]Zhang C Y,Chen X S,He T M,et al. Genetic structure of Malus sieversii population from Xinjiang,China,revealed by SSR markers[J]. Journal of Genetics and Genomics,2007,34(10):947-955.
[6]张春雨,陈学森,林 群,等. 新疆野苹果群体遗传结构与遗传多样性的SRAP分析[J]. 园艺学报,2009,36(1):7-14.
[7]Dong Y,Zhang J,Ren Y C,et al. Stduy on genetic diversity of natural population in Malus sieversii with microsatellite[J]. Journal of Plant Genetic Resources,2013,14(5):771-777.
[8]左力辉,张文林,邱彤,等. 新疆野苹果叶形性状变异及其与SSR标记关联分析[J]. 园艺学报,2015,42(4):759-768.
[9]张艳敏,冯涛,张春雨,等. 新疆野苹果研究进展[J]. 园艺学报,2009,36(3):447-452.
[10]Klabunde G H F,Junkes C F O,Tenfen S Z A,et al. Genetic diversity and apple leaf spot disease resistance characterization assessed by SSR markers[J]. Crop Breeding and Applied Biotechnology,2016,16(3):189-196.
[11]Omasheva M E,Chekalin S V,Galiakparov N N. Evaluation of molecular genetic diversity of wild apple Malus sieversii populations from Zailiysky Alatau by microsatellite markers][J]. Genetika,2015,51(7):759-765.
[12]秦 伟,刘立强,廖 康,等. 新疆苹果种质资源亲缘关系的SSR分析[J]. 新疆农业科学,2011,48(1):48-52.
[13]秦 伟,沙 红,刘立强,等. 新疆野苹果资源遗传多样性SSR分析[J]. 果树学报,2012,29(2):161-165.
[14]Velasco R,Zharkikh A,Affourtit J,et al. The genome of the domesticated apple (Malus×domestica Borkh.)[J]. Nature Genetics,2010,42(10):833-839.
[15]Yeh F C,Boyle T J B. Population genetic analysis of co-dominant and dominant markers and quantitative traits [J]. Belgian Journal of Botany,1997,129:157.
[16]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[17]Freeland J R,Kirk H,Petersen S D,et al. 分子生態学[M]. 9版. 戎 俊,译. 北京:高等教育出版社,2015:55-58.
[18]周璨林. 天山马鹿种群数量、遗传结构、家域及系统发育关系研究[D]. 乌鲁木齐:新疆大学,2015:84-85.
[19]Bagnaresi P,Biselli C,Orrù L,et al. Comparative transcriptome profiling of the early response to Magnaporthe oryzae in durable resistant vs susceptible rice (Oryza sativa L.) genotypes[J]. PLoS One,2012,7(12):e51609.
[20]Chmielarz M,Sobkowiak S,Debski K,et al. Diversity of phytophthora infestans from Poland[J]. Plant Pathology,2014,63 (1):203-211.
[21]Kasso D,Jean-Philippe B,Jean-Louis D,et al. Forest refugia revisited:nSSRs and cpDNA sequences support historical isolation in a wide-spread African tree with high colonization capacity,Milicia excelsa (Moraceae)[J]. Molecular Ecology,2010,19(20):4462-4477.
[22]Pan D,Wei Y M,Chen G Y,et al. Sequence-related amplified polymorphism (SRAP) of wild emmer wheat (Triticum dicoccoides) in Israel and its ecological association[J]. Biochemical Systematics and Ecology,2010,38(1):1-11.
[23]López-Pujol J,Bosch M,Simon J,et al. Population genetics and conservation priorities for the critically endangered island endemic Delphinium pentagynum subsp. formenteranum (Ranunculaceae) [J]. Biodiversity and Conservation,2003,12(9):1937-1951.
[24]Wei T,Ou B,Li J B,et al. Transcriptional profiling of rice early response to Magnaporthe oryzae identified OsWRKYs as important regulators in rice blast resistance[J]. PLoS One,2013,8(3):e59720.
[25]朱玉賢,李 毅. 现代分子生物学[M]. 2版.北京:高等教育出版社,2002:147-159.
[26]朱元娣,曹敏格,许 正,等. 基于ITS和matK序列探讨新疆野苹果与中国苹果的系统演化关系[J]. 园艺学报,2014,41(2):227-239.练景龙,张笑晗,代春艳,等. 高亚麻酸油菜3种不饱和脂肪酸含量的遗传分析[J]. 江苏农业科学,2020,48(21):84-92.

