口腔鳞状细胞癌中转化因子2β的表达及潜在的临床意义
郝福 宁毅 孙睿 郑晓旭
1.山西医科大学口腔医学院·口腔医院 太原 030001;
2.山西省人民医院口腔颌面外科 太原 030012;
3.马里兰大学医学院附属医院肾内科 巴尔的摩 21201
鳞状细胞癌(squamous cell carcinoma,SCC)是头颈部常见的恶性肿瘤,约占口腔和口咽部恶性肿瘤的90%,其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)约占口腔颌面部恶性肿瘤的80%[1]。唇、口腔癌的发生率和死亡率分别为全球癌症总数的2.0%和1.9%,它们在南亚和太平洋岛屿等地区具有较高的发生率,同时它们也是导致印度和斯里兰卡男性癌症患者死亡的主要原因[2]。不同国家OSCC的发病率不同,但在发展中国家更为常见[3]。近年来OSCC在诊断和治疗方面均取得了很大的进步,但患者的5年生存率仍未见明显提高[4]。如何提高OSCC患者的预后是临床治疗的热点和难点,因此,探索更多与OSCC相关的分子靶点对于OSCC的诊治具有重要的临床意义。
转化因子2β(Transformer 2β,Tra2β)蛋白是一种富含丝氨酸/精氨酸的RNA结合蛋白,它不仅可参与前体信使RNA(messenger RNA,mRNA)的选择性剪接,还可通过与微小RNA(micro-RNA,miRNA)相互作用来调控靶蛋白的表达水平[5-6]。Tra2β蛋白不仅是维持正常生理机能不可或缺的因素,而且与神经前体细胞凋亡、中风以及肿瘤形成等密切相关[7-8]。Tra2β基因敲除实验表明,Tra2β蛋白对于小鼠胚胎和大脑的正常发育至关重要[9]。Tra2β蛋白的编码基因Tra2b在人体中的表达具有组织特异性,并且它在乳腺癌、肺癌、宫颈癌等多种癌症中明显扩增,而Tra2β蛋白表达上调已在多种癌症中被证实,并可能通过调控细胞增殖、凋亡、转移和衰老等过程来参与肿瘤的形成[10-15]。一些RNA序列已被证实为Tra2β蛋白的作用靶点[16],此外,基于剪接体的抗癌药物已步入临床研发阶段,并且作用于Tra2β蛋白的小分子抑制剂也已经被发现,这可能为癌症的治疗提供了一个新的研究思路[17-18]。
1 材料和方法
1.1 一般资料
研究对象为山西省人民医院口腔颌面外科接受根治性手术治疗的原发性OSCC患者。
纳入标准:首次治疗的病例;组织病理学确诊的病例;有完整医疗记录的病例;患者知情同意。排除标准:术后复发和术前接受过放化疗或其他抗癌治疗的病例。标本:2011—2013年64例原发性OSCC患者的石蜡标本和2017—2019年22例原发性OSCC患者的组织标本,其中22例OSCC组织标本取材部位为:牙龈SCC(9例);舌SCC(5例);腭SCC(1例);颊SCC(6例),口底SCC(1例)。
本研究经山西省人民医院伦理委员会批准(2019省医论伦审字5号)并获得患者书面知情同意。
1.2 实验方法
1.2.1 免疫组化 染色方法:采用免疫组化Envision二步法。试剂采用兔超敏二步法检测试剂盒(北京中杉金桥公司,中国)。制备约2 μm厚的石蜡切片,60 ℃干燥箱烤片2 h。二甲苯浸泡30 min、3次,乙醇梯度水化,每次5 min。3%过氧化氢溶液孵育20 min,磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗5 min、3次。高压加热法修复抗原,PBS洗5 min、3次。孵育一抗:ab66901+Tra2β(Abcam公司,美国)1:300稀释,4 ℃过夜。PBS洗5 min、3次,加二抗:滴加试剂盒中试剂1(Ploymer Helper),37 ℃水浴箱孵育30 min,PBS洗5 min、3次。滴加试剂2(ploy-HRP anti-Rabbit IgG),37 ℃水浴箱孵育20 min,PBS洗5 min、3次。3’3-二氨基联苯胺(diaminobezidin,DAB)显色约1 min。苏木素复染约30 s。无水乙醇梯度脱水,封片观察。阴性对照:用PBS替代Tra2β。
结果分析:2名病理科医生在双盲下对每张染色切片打分及评价。DAB显色结果呈棕黄色即可判为阳性。每例至少评价1 000个细胞,计数5个高倍视野。按细胞着色强度和着色密度分别进行评分。着色强度评分:无着色计0分,轻度着色(浅黄色)计1分,中度着色(棕黄色)计2分,强着色(棕褐色)计3分。着色密度评分:阳性细胞百分率≤5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分。将2项结果相乘得总评分,总评分范围:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中阳性(++),6分以上为强阳性(+++)。
1.2.2 Western blot实验 充分研磨组织标本并在蛋白裂解液(武汉博士德公司,中国)和苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(北京索莱宝公司,中国)中充分裂解,冰上静置20 min。4℃,12 000g离心20 min,收集上清液。聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)试剂盒(武汉博士德公司,中国)测定蛋白浓度。分离胶浓度选择10%的十二烷基硫酸钠-聚丙烯酰胺凝胶(dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)(武汉博士德公司,中国)。一抗Tra2β蛋白:ab171092+Tra2β(Abcam公司,美国),浓度为1:2 500;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH):Ab181602+GAPDH(Abcam公司,美国),浓度为1:8 000,4 ℃冰箱中过夜,它们的二抗为:Goat anti-Rabbit IgG(武汉博士德公司,中国)且浓度均为1:8 000。伯乐成像仪成像,image J软件行灰度分析。
1.2.3 实时荧光聚合酶链反应(real-time polymerase chain reaction,RT-PCR) RNA提取试剂盒(北京Takara公司,中国)提取总RNA,紫外线分光光度计测定总RNA浓度。反转录试剂盒(北京Takara公司,中国)按总RNA为1 μg反转录,反应体系20 μL。SYBR Green扩增试剂盒(北京Takara公司,中国)进行扩增,GAPDH为内参基因,反应体系25 μL:TB Green Premix Taq Ⅱ12.5 μL,上下游引物各1 μL,DNA模板1.5 μL,灭菌水9 μL,引物序列和产物长度见表1。Tra2β mRNA的相对表达量用2-ΔΔCT计算,癌旁组织中的相对表达量认为是1倍。

表1 RT-PCR引物序列及产物长度Tab 1 Sequence of RT-PCR primers and length of products
1.2.4 细胞培养 将37 ℃恒温水浴锅中快速解冻的Hela细胞悬液加入15 mL离心管,加入10倍体积的培养液,混匀。1 000 r·min-1离心5 min,弃上清液,加入新的培养液重悬细胞。细胞计数,将重悬的细胞加入培养瓶中,37 ℃、5% CO2的培养箱中培养,2 d更换1次培养液,待细胞生长达80%左右即可进行细胞传代和蛋白提取。
1.3 统计学分析
SPSS 16.0软件分析数据:计量资料用均数±标准差表示。Tra2β蛋白的表达与临床病理参数的关系采用Spearman秩相关检验或者χ2检验。Western blot和RT-PCR分析采用独立样本t检验。预后采用Log-rank检验并做出Kaplan-Meier生存曲线。多因素生存分析用Cox比例风险模型统计。P<0.05,差异有统计学意义。
2 结果
2.1 OSCC中Tra2β蛋白的表达及其与临床病理参数的关系
笔者利用免疫组化探索Tra2β蛋白在OSCC中的表达情况并研究Tra2β蛋白表达与患者临床病理参数之间的关系。结果表明,OSCC中Tra2β蛋白有表达并且主要定位于细胞的细胞核内,DAB染色核呈棕黄色即为阳性细胞(图1A为阴性对照,图1B~D依次为弱阳性、中阳性和强阳性表达)。此外,Tra2β蛋白阳性表达与肿瘤的分化程度(P<0.001)和临床分期(P=0.046)有关,而与患者的年龄、性别、淋巴结转移和病变部位无显著的相关性(详见表2)。
2.2 OSCC肿瘤和癌旁组织中Tra2β蛋白的表达情况
免疫组化结果表明,Tra2β蛋白在OSCC中有表达,为进一步验证Tra2β蛋白与OSCC发生发展有关,笔者利用Western blot实验验证Tra2β蛋白在OSCC肿瘤和癌旁组织中的差异性表达。如图2A可见,Tra2β蛋白在肿瘤组织中的表达高于癌旁组织。已知Tra2β蛋白在Hela细胞中有表达,笔者通过检测Hela细胞中Tra2β蛋白的表达来验证所用抗体的有效性[19],如图2B可见,Tra2β蛋白在Hela细胞中表达。
Tra2β蛋白在22例OSCC肿瘤中的相对表达量(0.613±0.080)高于在癌旁组织的相对表达量(0.072±0.011),差异有统计学意义(P<0.001)(图2C)。GAPDH为内参蛋白。
2.3 OSCC肿瘤和癌旁组织中Tra2β mRNA的表达情况
RNA结合蛋白和miRNA是转录后调控基因表达的2类重要因子。Tra2β蛋白不仅可参与前体mRNA的选择性剪接,还可以通过与miRNA相互作用来调控靶基因的表达[5-6]。Bcl2 mRNA中与Tra2β蛋白的结合位点和与miR-204的结合位点部分重叠,因此,它们可能通过竞争与Bcl2α mRNA 3’非编码区的结合来调节Bcl2α mRNA的稳定性,从而调控Bcl2的表达[20]。
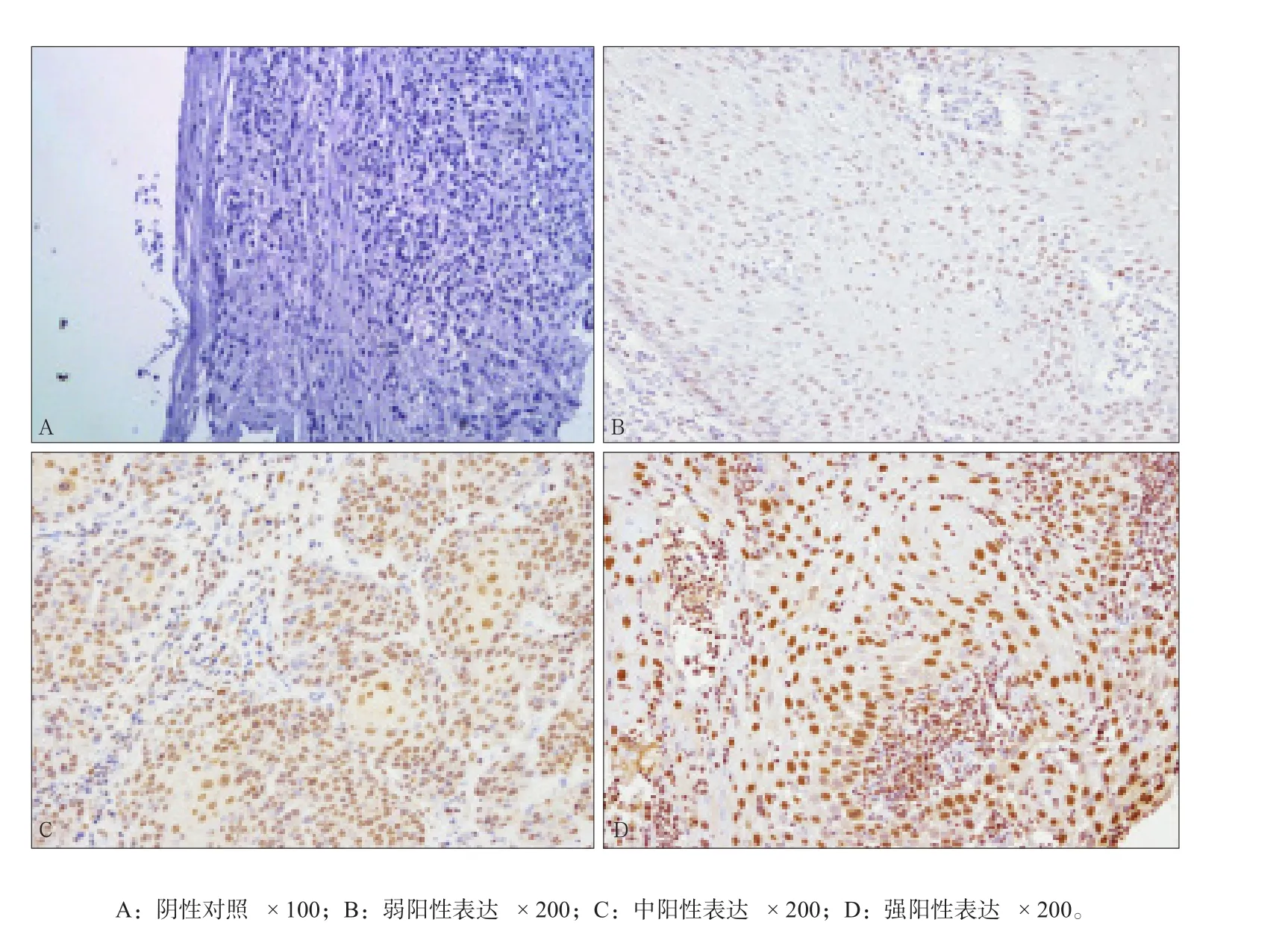
图1 Tra2β蛋白在OSCC中表达的免疫组化染色Fig 1 Immunohistochemical staining of Tra2β protein expression in OSCC
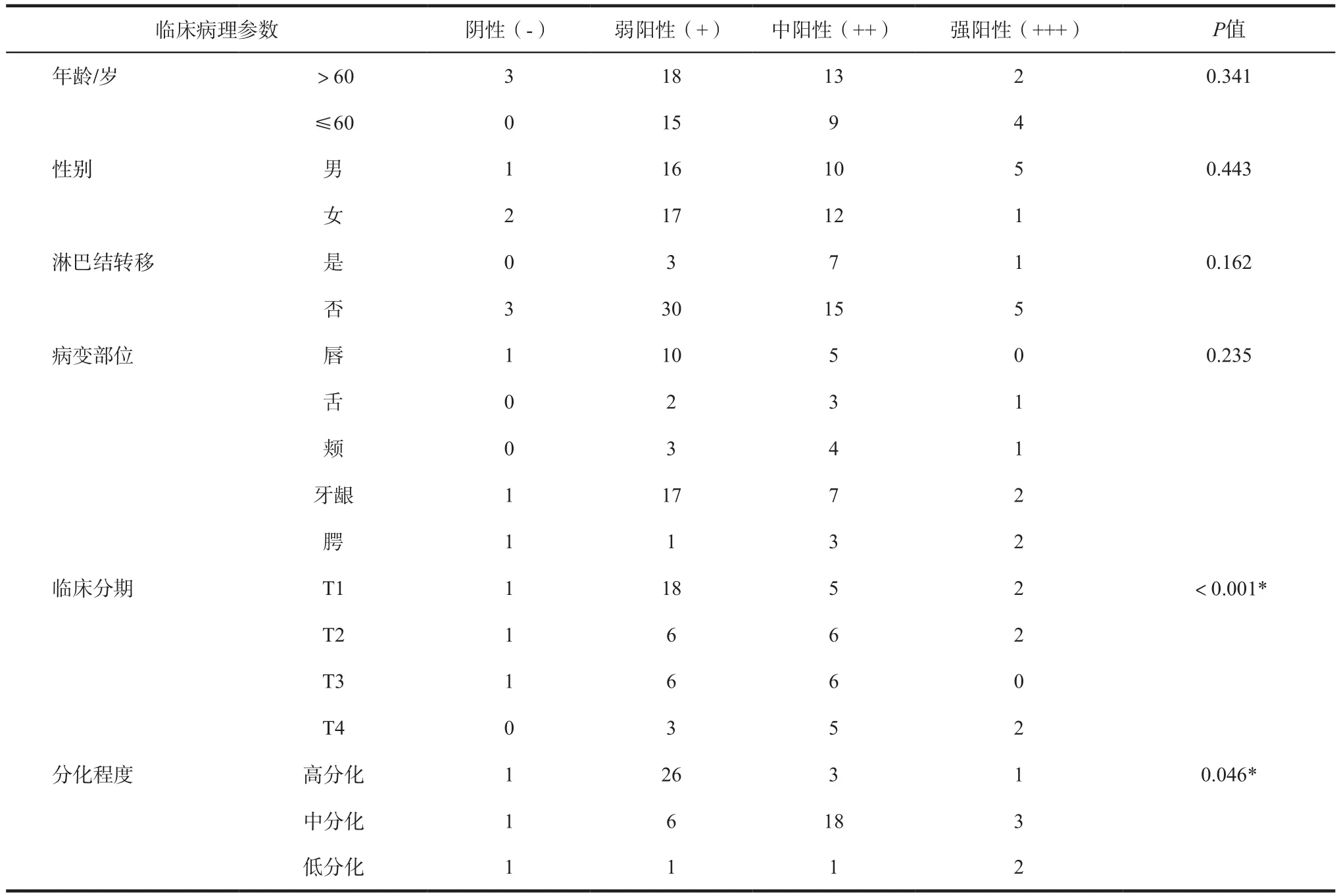
表2 Tra2β蛋白表达与64例OSCC临床病理参数的关系Tab 2 Relationship between the expression of Tra2β protein and clinical pathological data of 64 OSCC
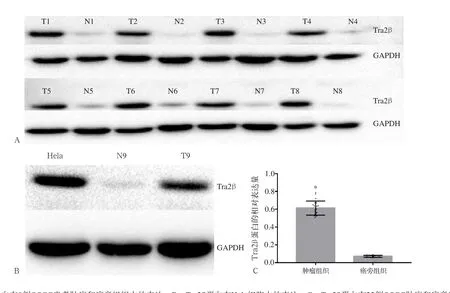
图2 Tra2β蛋白在OSCC肿瘤和癌旁组织中的表达Fig 2 The expression of Tra2β protein in tumor and paracancerous tissues in OSCC
利用miRNA数据库TargetScan Human Release 7.1和miRPathDB v1.1预测miR-204的靶基因时发现,Tra2b可能为miR-204-3p的靶基因[21]。有文献[22]报道,miR-204在OSCC中表达下调。为进一步预测miR-204和Tra2β mRNA之间是否具有相关性,笔者利用RT-PCR验证OSCC肿瘤和癌旁组织中Tra2β mRNA的差异性表达情况,以期初步证明miR-204和Tra2β mRNA间的负相关性。结果表明,22例OSCC肿瘤中Tra2β mRNA的相对表达量(1.586±0.298)高于癌旁组织的相对表达量(P<0.001,图3)。GAPDH为内参基因,Tra2β mRNA在癌旁组织中的相对表达量为1倍。
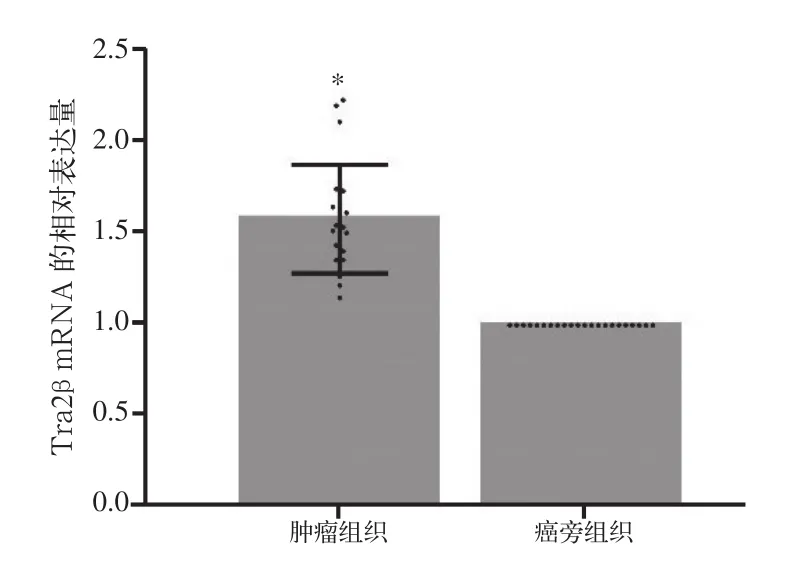
图3 Tra2β mRNA在22例OSCC肿瘤和癌旁组织中的相对表达量Fig 3 The relative expression of Tra2β mRNA in tumors and paracancerous tissues of 22 OSCC
2.4 Tra2β蛋白阳性表达对OSCC患者生存率及预后的影响
Kaplan-Meier分析结果表明,Tra2β蛋白高表达组OSCC患者的生存率低于低表达组,经Logrank检验,χ2=9.472,P=0.002,差异有统计学意义(图4)。Cox多因素和单因素分析结果一致,均表明Tra2β蛋白可作为评估OSCC患者预后的评估指标(P=0.006)。
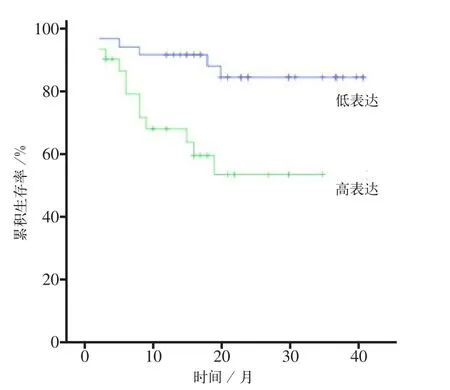
图4 Tra2β蛋白表达对OSCC患者生存率的影响Fig 4 Effect of Tra2β protein expression on survival rate of OSCC patients
3 讨论
OSCC是一种受多因素影响的疾病,其与表观遗传修饰、非编码RNA等多种因素有关[23-24]。与绝大多数实体肿瘤一样,早期诊断和治疗是提高OSCC患者预后的关键因素之一,因此,探索更多与OSCC发生发展相关的分子靶点就显得尤为重要。Tra2β蛋白作为一种选择性剪接因子,可以通过参与前体mRNA的选择性剪接来调控靶基因的表达,此外,其异常表达已在多种癌症中被证实并可能与细胞增殖、凋亡、转移和衰老等过程密切相关[10-15]。此外,蛋白质作为一种潜在的生物标志物较DNA和RNA更具有吸引力[25]。目前已知Tra2β蛋白的编码基因Tra2b在多种肿瘤中明显扩增[10],目前尚无文献报道Tra2β在OSCC中的表达及其潜在的临床意义。本实验表明,Tra2β蛋白在OSCC中有表达,并且它在肿瘤中的表达高于癌旁组织,此外,Tra2β蛋白阳性表达不仅与OSCC的分化程度和临床分期有关,而且与患者的预后相关,这提示Tra2β蛋白可能在OSCC的发生发展及对预后的判断方面有着重要的作用,但其具体的作用机制仍有待进一步探索和研究。
RNA结合蛋白和miRNA是调节转录后基因表达的重要因子,它们不仅可协同影响mRNA的稳定性和翻译,而且可以通过相互竞争与miRNA的结合来调节靶基因的表达[26]。Tra2β蛋白可以通过与miR-204竞争和Bcl2 mRNA 3’非编码区(untranslated regions,UTR)的结合来调控细胞凋亡,还可以通过作用于miR-335来抑制细胞增殖[6,20]。Bcl2 mRNA与Tra2β蛋白的结合位点和与miR-204的结合位点部分重叠,Tra2β蛋白可通过与miR-204竞争与Bcl2α mRNA 3’ UTR的结合来调节Bcl2α mRNA的稳定性,进而调控Bcl2蛋白的表达[20]。笔者利用miRNA数据库预测miR-204作用的靶基因时发现,Tra2b可能为miR-204-3P的一个靶基因[21]。因此,Tra2β对Bcl2介导的细胞凋亡调控机制可能比Tra2β蛋白和miR-204之间的竞争关系更为复杂。实验表明,OSCC中Tra2β mRNA呈高表达,结合已发表的文献[22]可知Tra2β mRNA和miR-204在OSCC中的表达呈负相关性。由此可见,Tra2β和miR-204对OSCC细胞凋亡的调控机制可能更为复杂。
局限性:1)实验研究的对象数量不足;2)石蜡标本缺乏对应的癌旁口腔黏膜组织,因此,未通过免疫组化验证Tra2β蛋白在肿瘤和癌旁组织中的差异性表达;3)未对OSCC中Tra2β mRNA和miR-204之间的相关性和可能的作用机制进行进一步的研究。未来笔者将着眼于研究miR-204和Tra2β对OSCC细胞凋亡的调控机制。
4 结论
Tra2β对OSCC的发生发展和预后具有重要的临床意义,它可能为OSCC诊断和治疗提供了一个新的分子靶点。

