中国明对虾急性肝胰腺坏死病(AHPND)和池塘水体中弧菌的检测分析
陈晓玲,邱 亮,魏海英,王君霞,孙成峰,许传堂
(1.日照市海洋与渔业研究所,山东 日照 276826;2.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术试点国家实验室海洋渔业功能实验室,农业农村部海水养殖病害防治重点实验室,青岛市海水养殖流行病学与生物安保重点实验室,山东 青岛 266071)
中国明对虾(Fenneropenaeuschinensis)又被称为东方对虾,是我国重要的经济养殖虾类之一[1]。然而,近年来多种病毒性和细菌性疾病的暴发给全球对虾养殖业造成了严重的损失。其中,一种细菌性疾病在亚洲和拉丁美洲等地区的养殖对虾中普遍流行,依据组织病理学特征,这种疾病被命名为急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease,AHPND)[2]。AHPND是目前导致对虾大量死亡和减产的原因之一,其代表性症状是肝胰腺的萎缩和发白,出现在对虾放苗后的前30 d,死亡率可以达到100%[3-4]。组织病理学分析显示,在AHPND感染的早期,能观察到肝胰腺小管的上皮细胞脱落;在感染的后期,能观察到肝胰腺小管细胞的坏死以及溶血性渗透现象[5-7]。我国最早于2010年由国家虾蟹产业技术体系首席科学家何建国教授团队在海南省发现了AHPND的病例[8],同年,马来西亚也报道了此病[4,6];随后,2011年和2012年,越南及泰国相继发现了该病[2,6,9];2013年菲律宾和墨西哥的养殖对虾也受到了该病的困扰[10-11]。2016年,日照地区首次检测出中国明对虾感染AHPND,且造成了一定的经济损失。因此,对日照地区进行AHPND的监测和预防对于该地区的对虾养殖业极其重要。
弧菌病是对虾养殖过程中危害较大且较为常见的细菌性疾病之一,该病在全国各养虾地区普遍流行[12-13]。近年来,专家学者对发病池塘的池水和病虾进行弧菌检测,得出的结果显示大多数发病池塘中的弧菌数量都严重超标。已报道的相关病原主要包括哈氏弧菌(Vibrioharveyi)、溶藻弧菌(Vibrioalginolyticus)、创伤弧菌(Vibriovulnificus)、副溶血弧菌(Vibrioparahaemolyticus)等[14-17],而副溶血弧菌则被认为是引发AHPND的病原之一[6,18-19]。因此,有效的监测水体中弧菌的数量将是防控AHPND暴发的一个关键因素。本文中使用的TCBS培养基为特殊选择性培养基,用来监测中国明对虾池塘水体中弧菌数量,取得了明显的效果,为有效控制对虾AHPND的暴发提供了依据。
1 材料与方法
1.1 AHPND的检测
1.1.1 样品来源
此次调查选取日照对虾试验站中全部的8口中国明对虾池塘作为取样点(无论发病与否,每个池塘都进行取样)。依据随机取样的原则,每次每口池塘抽取一定数量的中国明对虾样品(其中稚虾150尾,成虾30尾)。将采集到的不同虾池中的样品分别暂存到聚四氟乙烯袋中,编号并进行充氧,保证其活性,运输到实验室中取样。此次调查取样从2018年4月放苗开始,一直持续到9月清塘收虾,每个月的每周都进行取样,共采集样品192份。
1.1.2 样品前处理
取对虾的肝胰腺、胃和肠进行研磨,研磨后的组织放入无菌的离心管中于-20℃冰箱冷冻保存或直接放入95%酒精中固定保存。
1.1.3 对虾总DNA提取
取研磨好的组织样品约20 mg,按照TaKaRa MiniBEST Universal Genomic DNA提取试剂盒(TaKaRa,大连)的说明书步骤进行总DNA的提取,于-20℃保存。
1.1.4 AHPND致病基因的检测
根据Dangtip等[20]报道的方法,用两对引物采用套式PCR的方法对AHPND的致病基因进行检测。套式PCR扩增体系为:10×Buffer(Mg2+Plus)2.5 μL,dNTPs(10 mmoL/L)2.0 μL,Ex Taq DNA酶(5 U/μL)(TaKaRa,大连)0.25 μL,待检样品DNA 1.0 μL,上、下游引物(10 mmol/L)各2.0 μL(表1),加灭菌水补足至25.0 μL。第一轮扩增程序:94℃ 2 min;94℃ 30 s,55℃ 30 s,72℃ 90 s,进行30个循环;72℃延伸2 min,4℃保温。第二轮扩增程序:94℃ 2 min;94℃ 20 s,55℃ 20 s,72℃ 20 s,进行25个循环;72℃延伸2 min,4℃保温。PCR扩增产物用1%琼脂糖凝胶电泳进行检测,阳性产物送至生工生物工程(上海)股份有限公司测序,测序结果与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中AHPND的致病基因序列进行比对,进一步验证结果的准确性。
1.2 弧菌检测
1.2.1 水样来源
以日照对虾试验站中全部的8口中国明对虾池塘作为取样点,从2018年4月放苗开始,到9月收虾,每个月取一次水样(其中8月为高温季节,多取一次水样),于每口池塘的表层及中层的位置分别取2份水样,每个池塘共计4份水样(池塘的弧菌数为这4个水样的平均值),总共采集224份水样。
1.2.2 TCBS平板检测
弧菌检测方法采用TCBS平板计数法,即取100 μL养殖用水,均匀涂抹在TCBS琼脂平板培养基上,置于恒温培养箱中,35℃倒置培养15 h,计数,计算得出每mL水体中的弧菌数量,对可疑菌落可进一步用菌落PCR进行鉴定。TCBS培养基购自北京路桥公司;弧菌科微量生化鉴定管购自杭州天和微生物试剂有限公司。
1.2.3 16S rRNA菌落PCR
菌落PCR扩增体系:10×Buffer(Mg2+Plus)2.5 μL,dNTPs(10 mmol/L)2.0 μL,Ex Taq DNA酶(5 U/μL)(TaKaRa,大连)0.25 μL,引物16S-F、16S-R(10 mmol/L)各2.0 μL(表1),挑取单菌落作为模板,加灭菌水补足至25.0 μL。扩增程序:94℃ 10 min;94℃ 45 s,55℃ 45 s,72℃ 90 s,进行35个循环;72℃延伸10 min,4℃保温。检测到的阳性PCR产物送去生工生物工程(上海)股份有限公司测序,将测序得到的16S rRNA序列分别与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中核酸数据进行 BLAST 分析,选取同源性最高的序列及几种常见模式弧菌的16S rRNA,采用Mega 6软件邻接法构建系统发育树。

表1 引物序列
2 结果与分析
2.1 AHPND的套式PCR检测结果及分析
2018年4—9月,从试验站的中国明对虾池塘共采集对虾样品192份,对全部样品进行AHPND的套式PCR检测和测序验证,统计结果见表2。AHPND阳性样品第一轮扩增片段大小为1 269 bp,第二轮扩增片段大小为230 bp,部分样品的PCR检测结果如图1所示。将测序所得序列与NCBI数据库中AHPND致病基因的序列进行比对,结果显示PCR扩增出的阳性产物与NCBI数据库中AHPND致病基因的序列相似性为98%~99%。从表2的检测结果可以发现,7月和8月是AHPND的高发期,阳性检出率分别为15.6%、25.0%;其他月份没有检出AHPND,阳性检出率为0%。另外,此次AHPND的检出主要在K1池塘和K6池塘,其他池塘未有AHPND检出。检测到AHPND后,K1和K6池塘通过及时控料、调水、生物防控等措施,使疫情得到了较好的控制,但中国明对虾的成活率仍然受到了一定程度的影响。
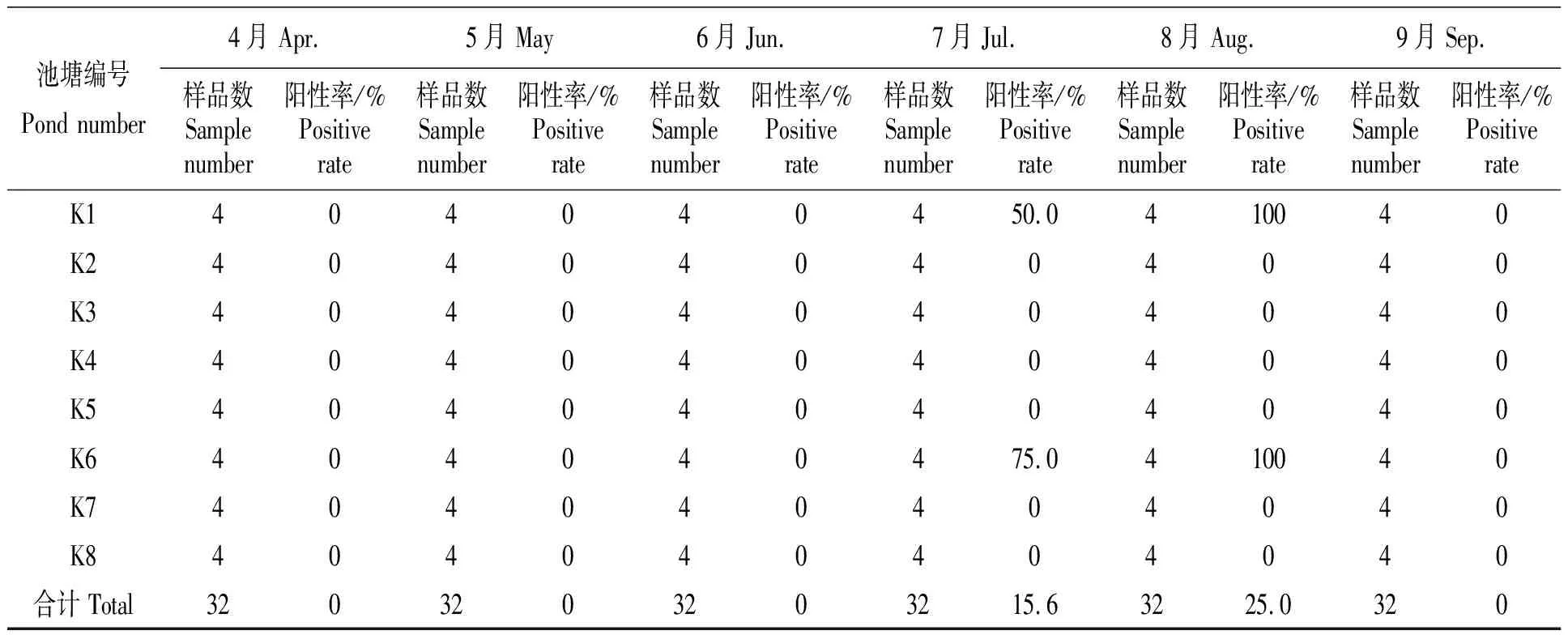
表2 试验站中国明对虾池塘的AHPND检测结果
2.2 水体中弧菌数量变化
2018年4—9月,从日照对虾试验站中国明对虾的8口池塘共取水样224份,对全部水样进行TCBS平板检测,计算出每1 mL养殖水体中所含的弧菌菌落数,试验统计结果见图2(由于4月无弧菌检出,未在图中列出)。从图中可以看出池塘中弧菌数量的变化范围为0~8.6×103cfu·mL-1。其中,在4月刚放完虾苗后的水样中,8口池塘均未检测出弧菌;从5月开始检测到弧菌的存在,但数值都比较低,均在1×103cfu·mL-1之内;6月大部分池塘的弧菌数量都有所增加,平均数值在1.23×103cfu·mL-1左右;7月随着温度升高,弧菌数量呈现明显增长的趋势,这种情况一直持续到9月,变化范围为1.04×103~8.6×103cfu·mL-1,其中K1和K6两个养殖池塘的弧菌数值偏高,这与2.1结果中AHPND的PCR检测结果相一致,通过施用微生态制剂进行水质调控,9月这两个池塘的弧菌数量得到显著的控制。
注:M表示DNA Marker DL2000;1~11:第一轮PCR结果;12~23:第二轮PCR结果。
Notes:M was DNA Marker DL2000;1~11:The first round PCR results;12~23:The second round PCR results.
2.3 16S rRNA 菌落PCR序列分析
2.3.1 16S rRNA电泳扩增结果
TCBS平板检测结果一般显示两种颜色的弧菌菌落,包括黄色菌落的溶藻弧菌和绿色菌落的副溶血弧菌。然而,从6月开始,试验结果中出现了带有黑色菌落的平板,其在数量的分布上不属于优势菌落,这种情况一直持续到9月。为了进一步了解此黑色菌落的属性,试验将平板上的黑色菌落,用灭菌的接种环挑取在新的TCBS平板上划线进行纯化培养后,将黑色菌落经两次纯化后,挑取作为模板进行16S rRNA 菌落PCR,部分菌落PCR检测结果如图3。
注:M表示DNA Marker DL1000;1~8:样品编号。
Notes:M was DNA Marker DL1000;1~8:No.of samples.
2.3.2 16S rRNA序列的遗传进化树
将图3中阳性样品的测序结果用BLAST进行比对,选取同源性高的序列构建系统进化树(图4),由系统进化树看出,通过分离得到的黑色菌落序列与溶藻弧菌的遗传距离比较近,聚集为一个分支,序列相似性为97%~99%。
3 讨论
本文在2018年4月至9月期间,对日照对虾试验站的中国明对虾养殖池塘中弧菌数量和AHPND的发病情况进行了调查与分析。结果显示,养殖初期虾池中的弧菌数量较低,尤其是4月刚投放虾苗时,弧菌检测数量为0,随着温度的升高,在养殖中后期弧菌数量呈上升趋势,且有2口池塘的弧菌数量明显偏高,而其他池塘中的弧菌数量的数值都偏低。虽然有研究表明,传统虾池对虾弧菌病发生的水体弧菌临界浓度为1.0×105cfu·mL-1[21],远超于本文结果(0~8.6×103cfu·mL-1),但是从本文的试验结果来看,当弧菌数量接近1.0×104cfu·mL-1时,中国明对虾池塘中有2口池塘暴发了AHPND,且造成了一定的经济损失,由此可见随着虾池中弧菌数量的增多,AHPND暴发的可能性也会随之升高。近年,弧菌引发的病害引起国内外专家学者的重视。2013年,国际水产联盟(GAA)和联合国粮农组织(FAO)先后宣布,导致AHPND的病原体是副溶血弧菌的特异变种[6,22]。本文中7、8月弧菌数量有明显增长的趋势,但通过各种水质改良剂、微生态制剂改善水质,弧菌的数量得到了有效的控制,避免了AHPND的大规模暴发,挽回了一定的经济损失。而本次试验中TCBS平板中的黑色菌落,经菌落PCR测序后的进化分析发现,其与溶藻弧菌在遗传进化上比较相近。
近年来,弧菌病作为对虾养殖中危害较为严重的疾病之一,出现逐年严重的趋势。针对这一态势,相关渔业部门及养殖户要引起足够的重视,提高防控意识。1)为防治对虾弧菌病,应尽可能消除传染源及切断传染途径,创造良好的养殖环境,定期检测水体和虾体中的弧菌数量以及虾体中AHPND的致病基因,这样才能最大限度阻止对虾弧菌病的暴发,提高养殖成功率。2)弧菌病的病原被认为是一种条件致病菌,只有当环境恶化或处在应激状况时才会出现致病性[13],因此要做到及时监测水质情况,防止病菌大量繁殖和传播。3)创造良好的水环境,每次进水必须经过过滤和消毒处理。消毒后,应向池中加入有益菌、藻类等生物种类,以期在养殖池内形成稳定的微生态群落,完成物质能量转化,建立更加稳定的水环境[23]。4)可投喂乳酸菌、酵母菌等可抑制对虾肠道内弧菌繁殖的益生菌,定期施用一些芽孢杆菌也有益于养殖池水质的维持[24]。

