异丙酚下调PKM2抑制人肺腺癌细胞系增殖、迁移和侵袭
胡智慧,李建芹,韩鲁军,张 静,张红欣
(1.石家庄市第一医院 肿瘤科一病区, 河北 石家庄 050011; 2.黄骅市人民医院 肌电图室, 河北 沧州 061300)
异丙酚(propofol)是一种常用的静脉麻醉剂。越来越多的证据表明异丙酚有许多非麻醉作用[1]。近年来,异丙酚被报道具有许多潜在的抗癌特性,如抑制癌细胞的增殖、黏附和转移以及诱导细胞凋亡[2]。因此,异丙酚是癌手术中较好的麻醉剂。但关于异丙酚在肺癌细胞中的抗肿瘤活性的机制研究却很少。丙酮酸激酶M2(pyruvate kinase M2,PKM2)可催化磷酸烯醇丙酮酸转化为丙酮酸,这是糖酵解途径的最后一步[3]。PKM2的表达与食管鳞癌的耐药有关,且与在非小细胞肺癌中的下调增加了放射敏感性有关[4]。本研究拟以肺腺癌细胞系Anip973为研究对象,检测其中PKM2的表达,观察异丙酚、敲减PKM2、过表达PKM2对Anip973细胞增殖、迁移和侵袭的影响,揭示其机制可能与异丙酚抑制PKM2有关,将为异丙酚治疗肺腺癌提供依据。
1 材料与方法
1.1 材料
人肺腺癌细胞系A549、Anip973(上海ATCC细胞库);异丙酚(AstraZeneca公司);DMEM培养基、胎牛血清、胰蛋白酶和MTT(Gibco公司);LipofectamineTM2000、BCA蛋白定量试剂盒和反转录试剂盒(TaKaRa公司);PVDF膜(Roche公司);Matrigel基质胶、Transwell小室(Corning公司);SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液(上海碧云天生物技术公司)。
1.2 方法
1.2.1 细胞的培养及分组处理: 将人肺腺癌细胞A549、Anip973用含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2的恒温培养箱中常规培养,待细胞增殖至汇合度75%左右,用胰蛋白酶消化约1 min,按照1∶3的比例更换培养基,每2~3 d传代1次。将正常培养的Anip973细胞标记为对照组。异丙酚(60、100和120 μmol/L)处理24 h的Anip973细胞标记为0 μmol/L组、异丙酚60 μmol/L组、异丙酚100 μmol/L组、异丙酚120 μmol/L组;选择最适浓度异丙酚120 μmol/L处理的Anip973细胞标记为异丙酚组;将si-NC、si-PKM2、pcDNA3.1、pcDNA3.1-PKM2、异丙酚+pcDNA3.1、异丙酚+pcDNA3.1-PKM2按脂质体LipofectamineTM2000说明书操作转染至Anip973细胞,部分组用异丙酚120 μmol/L 处理,分别标记为si-NC组、si-PKM2组、pcDNA3.1组、pcDNA3.1-PKM2组、异丙酚+pcDNA3.1组、异丙酚+pcDNA3.1-PKM2组,转染6 h后,更换新鲜培养基继续培养48 h。
1.2.2 MTT法检测细胞增殖:细胞中加入20 μL MTT(5 g/ L)溶液,培养4 h,然后弃去上清,每孔加入150 μL DMSO,振荡,使结晶溶解,在490 nm波长下检测细胞吸光度值(A)。细胞抑制率=[1-A490样品/A490对照]×100%。细胞的增殖力与细胞活力成正比。
1.2.3 Transwell小室法检测细胞的迁移、侵袭:将细胞以106个/孔接种于细胞6孔板,培养至汇合度75% 时,更换无血清培养基培养过夜。调整细胞至105个/mL,取100 μL加入上室内,600 μL含血清的培养基加入下室,培养过夜。取出小室,用棉签擦去上室内的细胞,PBS洗涤,甲醇固定30 min,0.1%结晶紫染色20 min,PBS洗涤。显微镜下观察小室下表面附着的迁移细胞数,随机选5个视野计数,取平均值。
将Transwell小室上表面铺适量厚度的基质胶,然后按照上述操作方法操作。最后显微镜下观察小室下表面附着的侵袭细胞。
1.2.4 RT-qPCR实验检测细胞中PKM2的mRNA的表达:细胞遵照RNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按反转录试剂盒按照说明书操作合成cDNA。最后按RT-qPCR试剂盒说明书操作进行PKM2检测。用2-△△Ct计算PKM2的表达。引物信息:PKM2(5′-3′):上游引物CCATTACCAG CGACCCCACAG,下游引物GGGCACGTGGGCGGT ATCT;GAPDH(5′-3′):上游引物TCCCTCAAGATT GCTAGCAA,下游引物AGATCCACAACGGATACATT。
1.2.5 Western blot检测细胞中PKM2、E-cadherin和MMP-2蛋白表达:收集细胞,加入裂解液,冰上裂解30 min。12 000 r/min离心10 min。取上清置于离心管,加入5×SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗,4 ℃过夜孵育,洗膜,加Ⅱ抗,4 ℃ 2 h。加发光液,曝光。
1.3 统计学分析

2 结果
2.1 不同浓度的异丙酚对肺腺癌细胞A549、Anip973增殖的影响
与异丙酚0 μmol/L组相比,异丙酚60 μmol/L组、异丙酚100 μmol/L组、异丙酚120 μmol/L组A549、Anip973细胞的抑制率均显著升高(P<0.05)。选用对异丙酚较为敏感的Anip973做后续使用;选用作用时间24 h,抑制率约为50%作用的异丙酚浓度(120 μmol/L)用作后续实验(表1)。
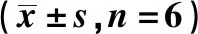
表1 不同浓度异丙酚对细胞A549、Anip973增殖的影响Table 1 Effects of different concentrations of propofol on proliferation of A549 and Anip973 cells
*P<0.05 compared with propofol 0 μmol/L group.
2.2 异丙酚对肺腺癌细胞Anip973迁移、侵袭的影响
与对照组相比,异丙酚组Anip973细胞的迁移细胞数和侵袭细胞数均显著降低,E-cadherin蛋白表达量显著升高,MMP-2蛋白表达量显著降低(P<0.05)(图1,表2)。
2.3 异丙酚对肺腺癌细胞Anip973中糖酵解途径关键酶PKM2表达的影响
与对照组相比,异丙酚100 μmol/L组、异丙酚120 μmol/L组Anip973细胞中PKM2 mRNA和PKM2蛋白表达量均显著降低(P<0.05)(图2,表3)。
A.Transwell assay(×200); B.expression of migration-related proteins图1 异丙酚对细胞Anip973迁移、侵袭的影响Fig 1 Effects of propofol on migration and invasion of Anip973 cells
表2 异丙酚对细胞Anip973迁移、侵袭的影响Table 2 Effects of propofol on migration and invasion of Anip973
*P<0.05 compared with control group.

图2 异丙酚对PKM2表达的影响Fig 2 Effects of propofol on PKM2 expression

表3 异丙酚对细胞Anip973中PKM2表达的影响Table 3 Effect of propofol on the expression of PKM2
*P<0.05 compared with control group.
2.4 抑制PKM2表达对肺腺癌细胞Anip973增殖、迁移、侵袭的影响
与si-NC组相比,si-PKM2组Anip973细胞中PKM2、MMP-2蛋白表达显著降低,E-cadherin蛋白表达显著升高,24、48和72 h时,细胞活性显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)(图3,表4)。
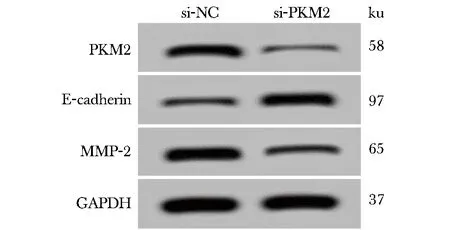
图3 PKM2及迁移相关蛋白的表达Fig 3 Expression of PKM2 and migration-related proteins
2.5 过表达PKM2能逆转异丙酚对肺腺癌细胞Anip973增殖、迁移、侵袭的影响
与pcDNA3.1组相比,pcDNA3.1-PKM2组Anip973细胞中PKM2 mRNA和蛋白表达均显著升高;与对照组相比,异丙酚组细胞中E-cadherin、MMP-2蛋白表达均无显著差异;24、48和72 h时,细胞活性显著降低,迁移细胞数和侵袭细胞数均显著降低;与异丙酚+pcDNA3.1组相比,异丙酚+pcDNA3.1-PKM2组细胞中E-cadherin、MMP-2蛋白表达均无显著差异;24、48和72 h时,细胞活性显著升高,迁移细胞数和侵袭细胞数均显著升高(P<0.05)(图4,表5,6)。
3 讨论
异丙酚虽为常用的麻醉剂,但近期大量研究报道其与多种肿瘤的发生发展具有重要作用, 其中包括肺腺癌[5]。异丙酚可上调肺癌细胞中miR-486的水平,呈剂量依赖性抑制细胞活力,促进细胞凋亡,提示异丙酚可能通过有效抑制肺癌细胞活力和诱导细胞凋亡而成为肺癌手术的理想麻醉剂[6]。异丙酚可抑制肺癌细胞的迁移和侵袭,抑制AQP-3和MMP-9的蛋白表达[7]。异丙酚可抑制肺癌细胞的活力、迁移和侵袭,上调E-钙粘蛋白,下调N-cadherin,vimentin和Snail表达[8],此外,异丙酚还可促进miR-1284的表达, 而抑制miR-1284可逆转异丙酚诱导的细胞活力、迁移和侵袭的降低,并上调FOXM1表达,FOXM1敲低可通过异丙酚治疗联合miR-1284抑制降低细胞活力、迁移和侵袭,提示异丙酚可通过调节miR-1284抑制肺癌细胞的细胞活力,迁移,侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)过程。本研究通过MTT法、Transwell小室法及RT-qPCR检测异丙酚处理的肺腺癌细胞A549、Anip973发现,异丙酚可呈浓度依赖性抑制肺腺癌细胞增殖,且最适浓度为120 μmol/L;进一步研究发现,异丙酚可抑制肺腺癌细胞的增殖、迁移和侵袭;深入研究发现,异丙酚可呈浓度依赖性上调PKM2的表达,推测异丙酚对肺腺癌细胞的作用与PKM2有关。
表4 抑制PKM2表达对细胞Anip973增殖、迁移、侵袭的影响Table 4 Effect of inhibition of PKM2 expression proliferation, migration and invasion of Anip973 cells n=6)
*P<0.05 compared with si-NC group.
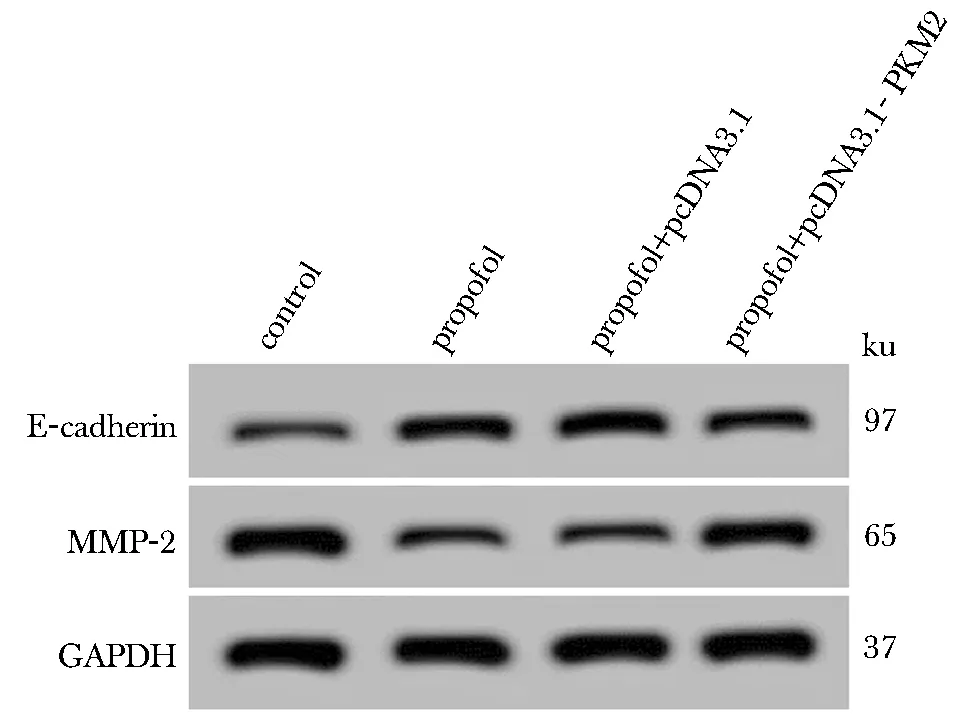
图4 迁移相关蛋白的表达Fig 4 Expression of migration-related proteins
表5 PKM2 mRNA、蛋白的表达 Table 5 Expression of PKM2 mRNA and protein
*P<0.05 compared with pcDNA3.1 group.
丙酮酸激酶(pyruvate kinase,PK)是“华宝效应”的关键调节因子,催化磷酸烯醇丙酮酸去磷酸化为丙酮酸[9]。有4种PK同工酶,分别为L、R、M1和M2。 L和R同种型主要在肝脏和红细胞中表达[10],而同工酶PKM1和PKM2最初来源于PKM基因[11],在胚胎发生过程中,PKM2逐渐被PKM1取代。相反,PKM1在肿瘤发生期间明显降低,而PKM2的表达增加。越来越多的证据表明PKM2活性与肿瘤的发生和发展密切相关,PKM2活性更有利于肿瘤细胞对促进肿瘤增殖和侵袭以及维持肿瘤恶性表型相关[12]。PKM2在肺腺癌患者组织中的表达显著升高,且与患者的低存活率关系密切,敲减PKM2可抑制肺腺癌细胞的增殖、迁移和侵袭、葡萄糖摄取、ATP生成和脂肪酸合成、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,而细胞的线粒体呼吸能力增加,阐明PKM2在细胞和分子水平上影响肺腺癌细胞增殖的机制是重要的,从而提供PKM2靶向基因治疗开发所需的基础数据[13]。
表6 过表达PKM2能逆转异丙酚对细胞Anip973增殖、迁移、侵袭的作用Table 6 Over-expression of PKM2 reversed the proliferation, migration and invasion of propofol to Anip973 cells n=6)
*P<0.05 compared with control group;#P<0.05 compared with propofol+pcDNA3.1 group.
PKM2的表达可增强致瘤性[14],表明PKM2的激活剂可能具有抗肿瘤特性,并且PKM2激活剂可抑制肺腺癌细胞的体外增殖和裸鼠体内肿瘤的生长,提示PKM2激活剂作为肿瘤细胞代谢调节剂是有效的,具有肺癌和潜在的其他恶性肿瘤的抗肿瘤活性。本研究检测了异丙酚处理的肺腺癌细胞Anip973中PKM2的表达发现,异丙酚可呈浓度依赖性抑制PKM2的表达,并且敲减PKM2可抑制肺腺癌细胞的增殖、迁移和侵袭,与Parnell在肺癌中关于PKM2功能的实验结果相悖,这为PKM2在肺腺癌中的功能研究提供理论依据。深入研究发现,过表达PKM2可逆转异丙酚对肺腺癌细胞Anip973增殖、迁移、侵袭的影响,这说明不仅异丙酚可抑制PKM2的表达,反过来,PKM2也可逆向影响异丙酚对肺腺癌的功能研究。
综上所述,异丙酚可抑制肺腺癌细胞系的增殖、迁移和侵袭,其机制也许与直接抑制PKM2表达有关,为异丙酚用于癌的治疗提供依据。

