白芷 白术 白附子提取物对酪氨酸酶抑制作用的比较△
陈革豫,朱周静,田航周,刘思雨,康翰林,王琪玉,王征
1.陕西国际商贸学院/陕西省中药绿色制造技术协同创新中心,陕西 咸阳 712046;2.陕西中医药大学/陕西省中药资源产业化协同创新中心,陕西 咸阳 712083
“美容美白”是每个时代亘古不变的话题,尤其在当下,寻找中药美白活性成分,开发毒副作用较小且美白功效明确的美白产品逐渐成为中药美白的研究热点[1-7]。于静等[1]经翻阅古籍并查阅了104部中医中药著作,共查出用于美白的外用古方119个,白芷是历代医家喜用的美白中药之一,但这些美容方剂的现代应用颇少,究其原因,主要是其美白机制尚不清楚,具体的美白活性成分尚不明确,另外,这些美白中药中部分毒性成分的存在阻碍了其在化妆品中的应用[8]。酪氨酸酶是黑色素生成的关键酶,近年来,对于酪氨酸酶抑制剂的研究也较为多见[2,4],其对延缓褐变和抑制黑色素形成具有重大意义[9-10]。基于此,本研究选取了白芷、白术、白附子3种出现频次较高的中药,比较了其对酪氨酸酶的抑制作用,试图追踪中药美白活性成分,以揭示中药美白的作用机制以及物质基础。
1 方法原理
在一定条件下,L-多巴能在酪氨酸酶的作用下生成多巴醌,该物质在475 nm处有最大吸收峰,而底物L-多巴和酪氨酸酶吸收较小。若将中药提取物加入其中,如果中药提取物能够抑制酪氨酸酶的活性,势必会影响多巴醌的生成。测定加入中药提取物前后多巴醌的生成情况,就可以判定中药提取物对酪氨酸酶的抑制作用强弱。多巴醌生成减少越多,说明中药提取物对酪氨酸酶的抑制作用越强,这样可以比较中药提取物对酪氨酸酶的抑制作用。对酪氨酸酶抑制作用强的中药就可能作为美白的关键中药。以此为指引进一步分析就可以追踪到中药美白的活性成分。
2 材料
2.1 仪器
UV-2600型紫外-可见分光光度计[龙尼柯(上海)仪器有限公司];GT10-1型高速台式离心机、DT5-2型低速台式离心机(北京时代北利离心机有限公司)。
2.2 试药
L-多巴(上海源叶生物科技有限公司,纯度:99%);磷酸二氢钠(国药集团化学试剂有限公司);磷酸氢二钠(天津市河东区红岩试剂厂);所用试剂均为分析纯;水为二次蒸馏水。
药材购买于北京同仁堂西安西大街分店,经陕西国际商贸学院医药学院雷国莲教授鉴定均为正品药材(符合《中华人民共和国药典》2015年版规定)。白芷Angelicadahurica(Fisch.ex Hoffm.)Benth.et Hook.f.产地四川;白术AtractylodesmacrocephalaKoidz.产地浙江;白附子TyphoniumgiganteumEngl.产地河南。所有药材先用蒸馏水洗去尘土,80 ℃烘干6 h备用。
3 方法与结果
3.1 中药提取物的制备
各中药提取物中浸出物含量应符合《中华人民共和国药典》2015年版中的相关规定。
3.1.1中药水提液的制备 准确称取各中药10.00 g,加水150 mL,浸泡30 min,大火煎煮至沸,改用文火微沸30 min,用4层纱布滤过,得滤液。滤渣再加水100 mL,煎煮2次,每次20 min,合并3次滤液。浓缩至约50 mL,静置,次日8000 r·min-1高速离心(离心半径为10 cm)30 min,取上清液定容于50 mL的量瓶中,制成相当于生药0.2 g·mL-1的溶液待用,用时稀释10倍,相当于生药0.02 g·mL-1。
3.1.2中药醇提液的制备 准确称取各中药10.00 g,加入适量70%的乙醇,50 ℃超声1 h,趁热滤过,取滤液,倒入量筒中,量取体积,加入3倍量的无水乙醇,沉淀24 h。然后将提取物放入离心机4500 r·min-1(离心半径为16 cm)离心30 min,取上清液,放入旋转蒸发仪中,50 ℃蒸至无醇味,定容至50 mL量瓶中,制成相当于生药0.2 g·mL-1的溶液待用,用时稀释10倍,相当于生药0.02 g·mL-1。
3.2 L-多巴的制备
精密称取L-多巴0.148 g,加入pH 6.8的磷酸盐缓冲液(PBS)定容至100 mL,备用。分别取上述配制好的L-多巴1、2、3、4、5、6 mL定容至10 mL量瓶中,备用。
3.3 酪氨酸酶的制备
参照文献[3]方法,进行酪氨酸酶的制备。新鲜土豆去皮,洗净,切块,称取土豆10 g,待用。研钵洗净,取pH 6.8的PBS 10 mL,全部放入冰箱中-20 ℃冷冻30 min,取出,将冷冻好的土豆和冷冻过的PBS放在一起,捣碎,于离心机中4500 r·min-1(离心半径为16 cm)离心10 min,取上清液,定容至100 mL量瓶中,即得酪氨酸酶溶液,现配现用。
3.4 吸收波长的考察
精密量取pH 6.8的PBS 1 mL、L-多巴1 mL、纯化水1 mL、酪氨酸酶溶液1 mL于试管中,常温反应40 min,得反应液,对该反应液、L-多巴及酪氨酸酶溶液这3种溶液进行全波长扫描,测定吸光度(A)。结果见图1。在本实验条件下,L-多巴和酪氨酸酶反应后在475 nm处有最大吸收峰,而此时L-多巴和酪氨酸酶本身的吸收均较小,故选择475 nm为检测波长。
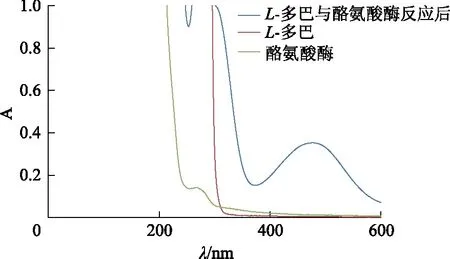
图1 L-多巴、酪氨酸酶反应前后的紫外吸收光谱
3.5 反应时间的考察
精密量取pH 6.8的PBS 1 mL、L-多巴1 mL、纯化水1 mL、酪氨酸酶溶液1 mL于试管中,考察反应不同时间(10、20、30、40、50、60 min),反应物在475 nm处的A,结果见图2。表明当反应时间为40 min时,A最大,故选择常温反应40 min。
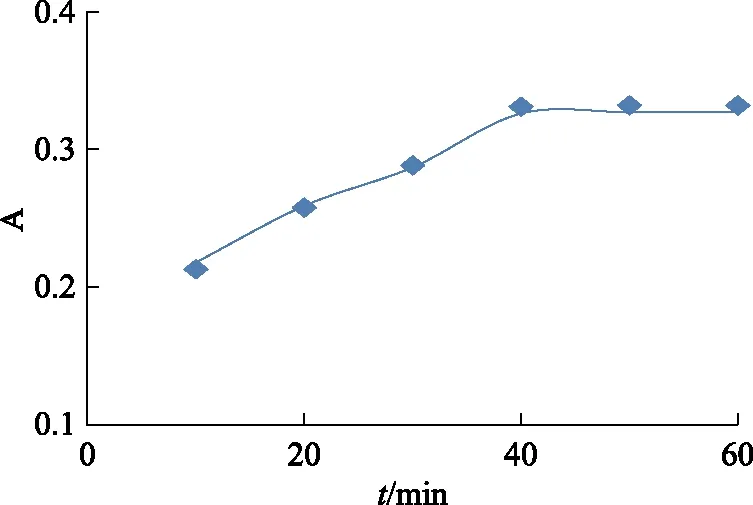
图2 酪氨酸酶催化氧化L-多巴反应时间的考察
3.6 精密度试验
精密吸取pH 6.8的PBS 1 mL、L-多巴1 mL、纯化水1 mL、酪氨酸酶溶液1 mL于试管中,按照实验方法进行测定,分别测量6次,记录A,其RSD为0.42%,表明该方法的精密度良好。
3.7 重复性试验
精密吸取6份同质量浓度的白芷水提液1 mL,按3.4项下的方法操作,分别记录其3、4组的A,其RSD分别为0.68%、1.53%,表明该方法重复性良好。
3.8 线性关系的考察
精密吸取pH 6.8的PBS缓冲液1 mL,不同浓度的L-多巴溶液1 mL、纯化水1 mL、酪氨酸酶溶液1 mL于试管中,用紫外分光光度法在475 nm下测定A,以L-多巴溶液的浓度为横坐标X,A为纵坐标Y绘制标准曲线。在试验条件下,L-多巴溶液浓度为0.75~4.51 mmol·L-1时符合比尔定律,线性回归方程为Y=0.117 9X+0.271,r=0.999 3。
3.9 白芷、白术、白附子3种中药提取物对酪氨酸酶抑制作用的比较
如表1所示,精密量取PBS 1 mL、L-多巴1 mL、纯化水1 mL、酪氨酸酶1 mL于试管中,常温下反应40 min,于475 nm处测吸收值,记为A1。A1值即为在本实验方法下加入中药提取液之前L-多巴在酪氨酸酶的作用下反应后所得产物的吸收值。精密量取PBS 1 mL、L-多巴1 mL、纯化水2 mL于试管中,常温下反应40 min,于475 nm处测吸收值,记为A2。A2值即为在本实验方法下L-多巴和酪氨酸酶反应前可能产生的吸收值。精密量取PBS 1 mL、L-多巴1 mL、中药提取液1 mL、酪氨酸酶1 mL于试管中,常温下反应40 min,于475 nm处测吸收值,记为A3。A3值即为在本实验方法下加入中药提取液之后L-多巴在酪氨酸酶的作用下反应后所得产物的吸收值。精密量取PBS 1 mL、L-多巴1 mL、纯化水1 mL、中药提取液1 mL于试管中,常温下反应40 min,于475 nm处测吸收值,记为A4。A4值即为在本实验方法下加入中药提取液之后但未加酪氨酸酶时可能产生的吸收值。按公式(1)计算中药提取液对酪氨酸酶的抑制率(IR)。
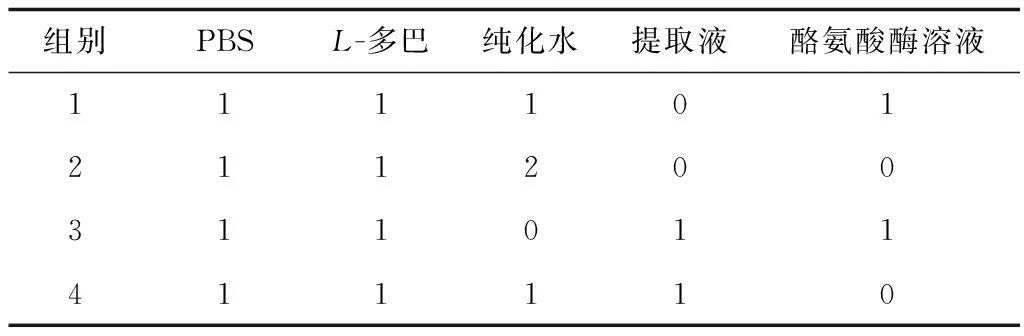
表1 酪氨酸酶活性抑制实验反应体系 mL
IR=[(A1-A2)-(A3-A4)]/(A1-A2)]×100%
(1)
3.9.1白芷、白术、白附子水提液对酪氨酸酶抑制作用的比较 按表1方法进行实验,分别对未加入中药提取液及加入白芷、白术、白附子水提液后酪氨酸酶催化L-多巴的反应后产物进行全波长扫描,结果见图3。结果表明,加入白芷、白术和白附子水提液后在475 nm处的A均有所降低,其中白芷水提液加入后降低最多。
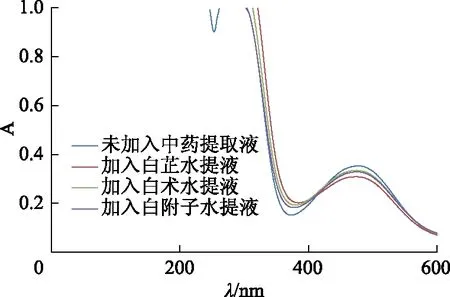
图3 加入中药水提液前后的紫外吸收光谱
3.9.2白芷、白术、白附子醇提液对酪氨酸酶抑制作用的比较 按表1方法进行实验,分别对未加入中药提取液及加入白芷、白术、白附子醇提液后酪氨酸酶催化L-多巴的反应产物进行全波长扫描,结果见图4。结果表明,加入白芷、白术和白附子醇提液后在475 nm处的A均有所降低,其中白芷醇提液加入后降低最多。
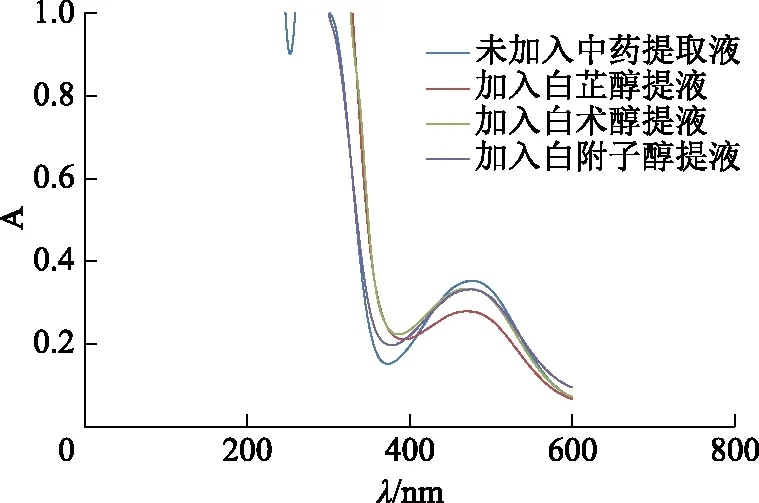
图4 加入中药醇提液前后的紫外吸收光谱
3.9.3白芷、白术、白附子各水提液和醇提液对酪氨酸酶抑制作用的比较 按表1方法分别测定了加入白芷、白术、白附子水提液和白芷、白术、白附子醇提液前后酪氨酸酶催化L-多巴的反应产物在475 nm处的A,结果见表2。
表2 各中药提取液对酪氨酸酶的抑制作用
4 讨论与展望
本研究就历代医家喜用的美白中药白芷、白术、白附子在同一实验方法下测定了其各自水提液和醇提液对酪氨酸酶的抑制作用,结果表明,白芷对酪氨酸酶的抑制作用的确是这三者中最高的。该研究方法简单易行,可以对比多种中药提取物对酪氨酸酶的抑制作用,从而筛选出可能具有美白作用的中药,进一步分离可以追踪到活性较好、安全性较高的天然美白活性成分,为中药美容美白的研究提供了参考。

