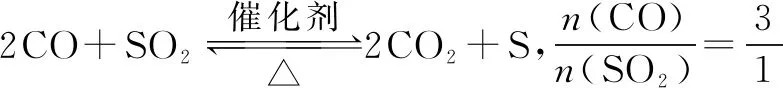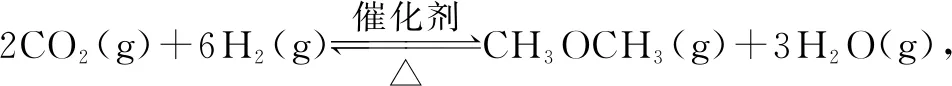化学反应速率和化学平衡图像分类突破
穆玉鹏
(山东省博兴第一中学 256500)
一、速率—压强(或温度)图像

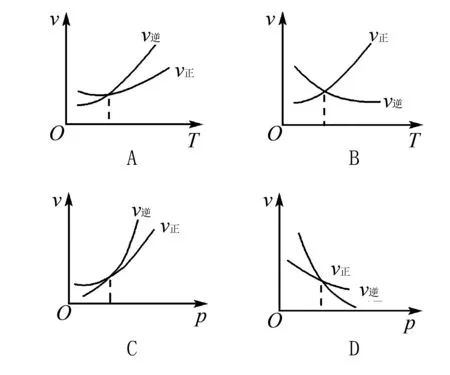
解析根据化学反应特点,升温平衡向正向移动,但v正、v逆均增大,加压平衡向逆向移动,v逆>v正.
答案:C
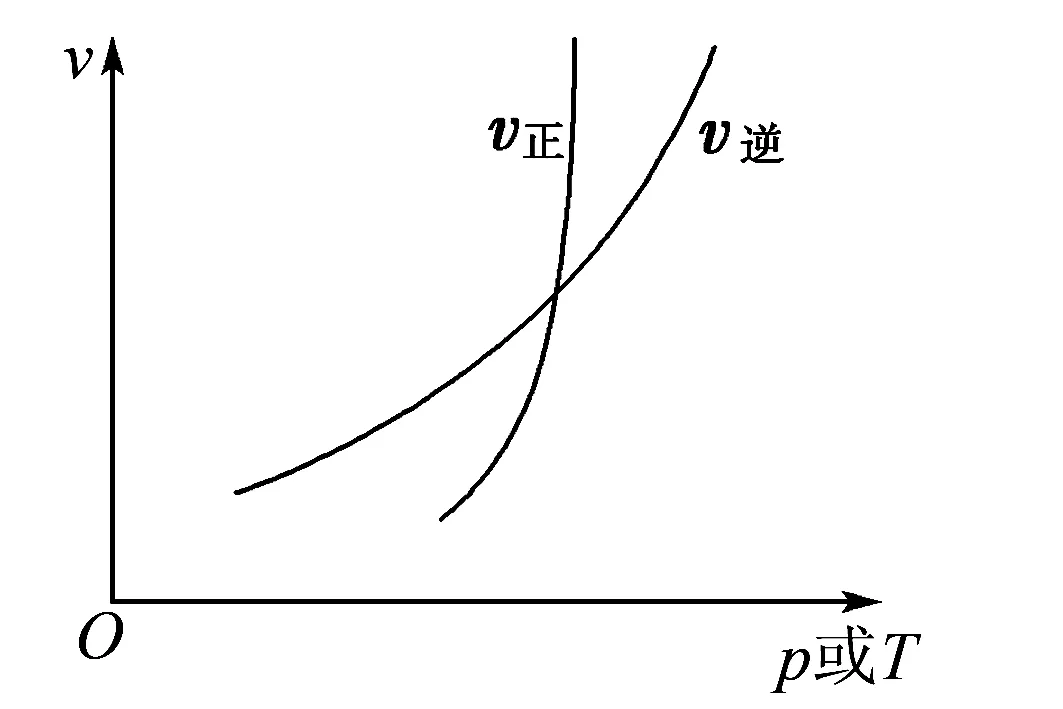
评注曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度.图中交点是平衡状态,压强或温度增大,正反应速率增大得快,平衡正向移动.
二、转化率(或百分含量)—时间—温度(或压强)图像
例2现有下列两个图像:

下列反应中符合上述图像的是( ).



ΔH<0


答案:B

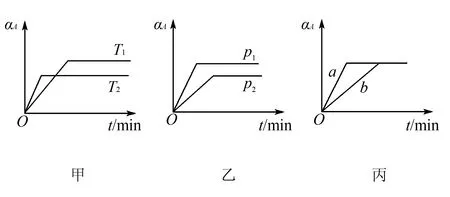
方法规律:
(1)“先拐先平,数值大”原则
分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化.
①若为温度变化引起,温度较高时,反应达平衡所需时间短.如甲中T2>T1.
②若为压强变化引起,压强较大时,反应达平衡所需时间短.如乙中p1>p2.
③若为使用催化剂引起,使用适宜催化剂时,反应达平衡所需时间短.如图丙中a使用催化剂.
(2)正确掌握图像中反应规律的判断方法
①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为放热反应.
②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为气体体积缩小的反应.
③若纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应.
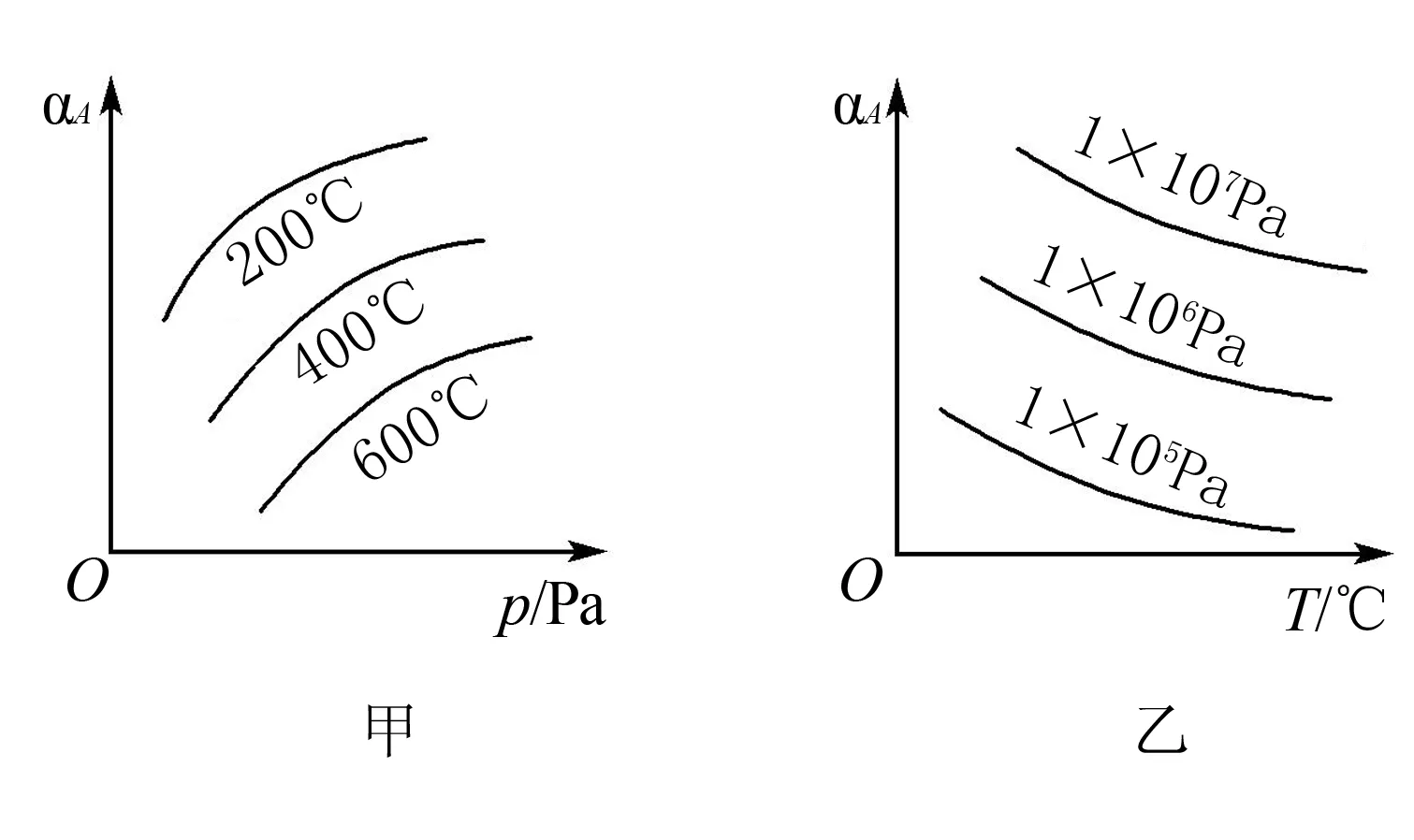
三、恒温线或恒压线图像

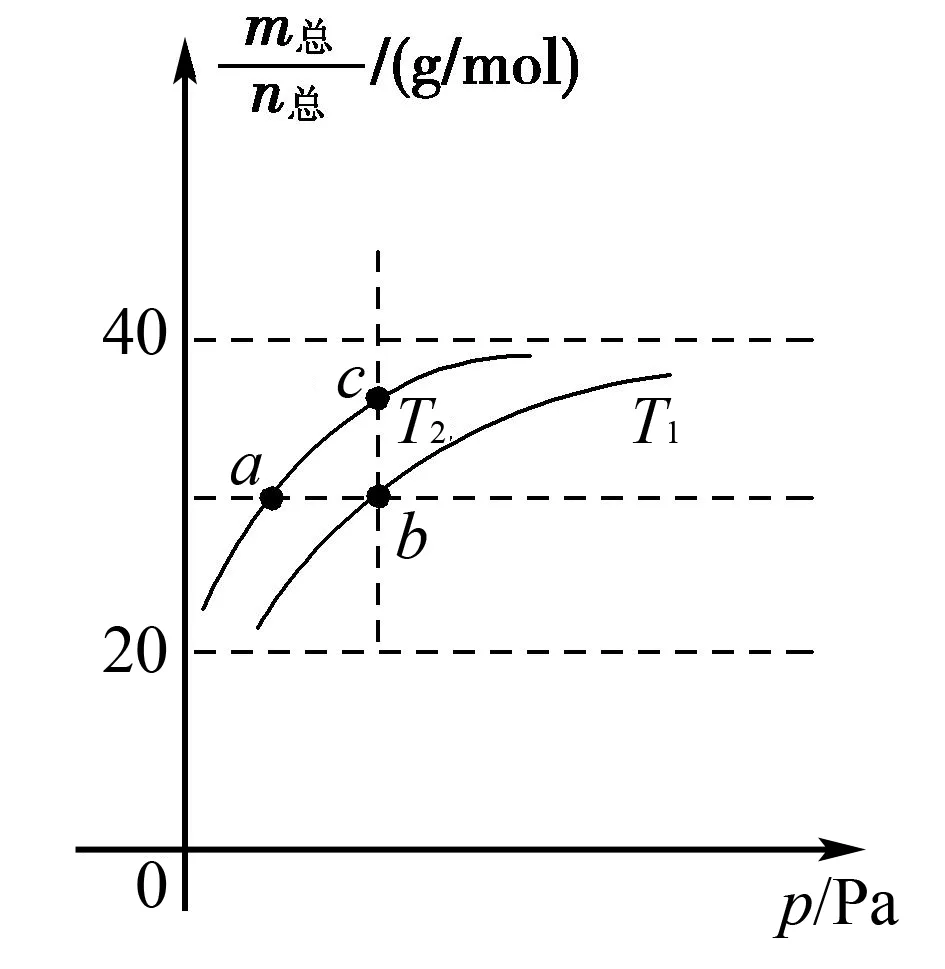
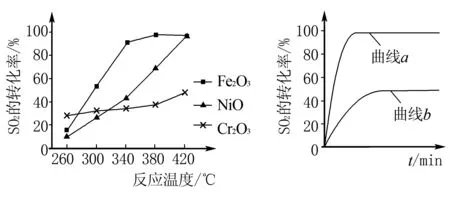
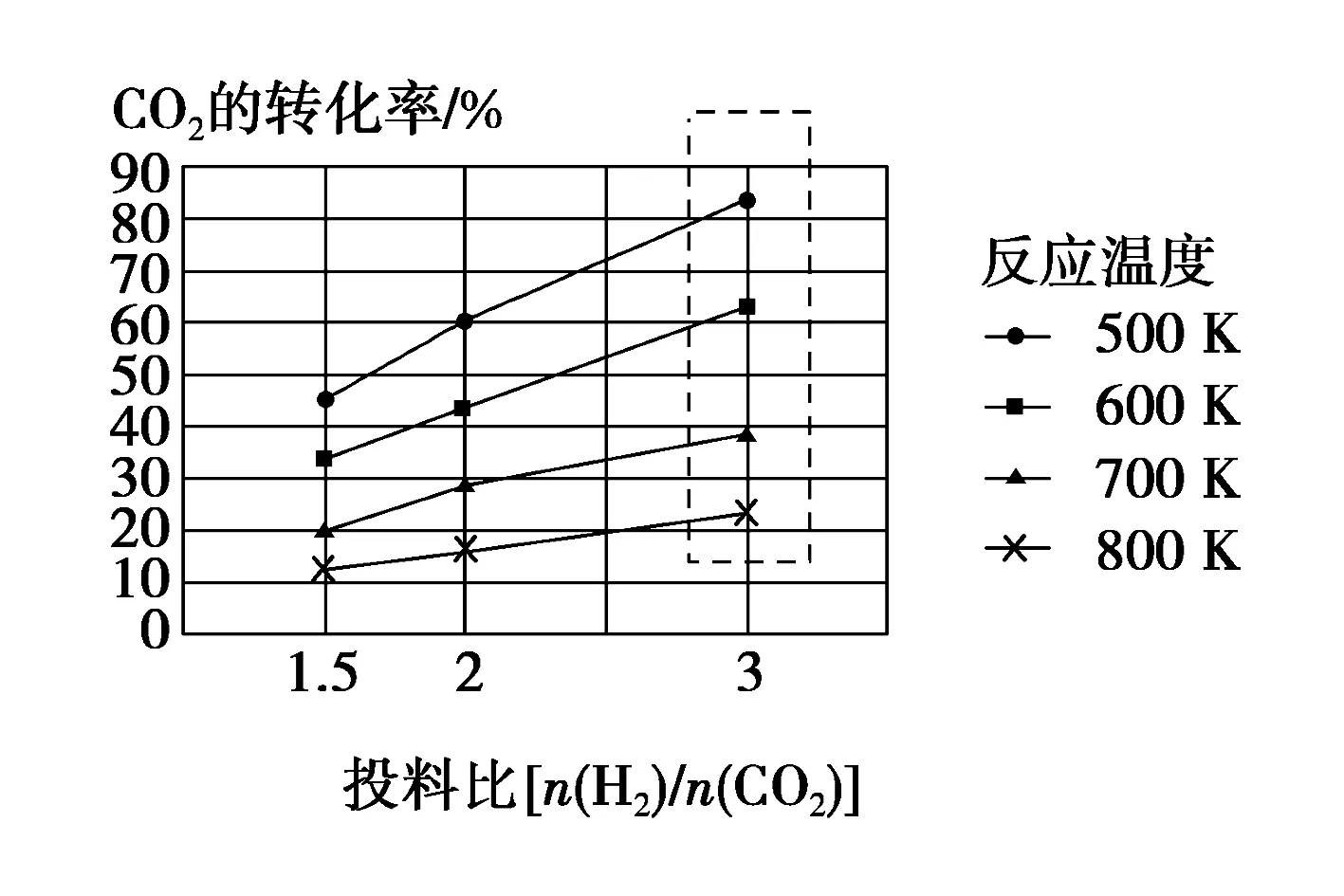
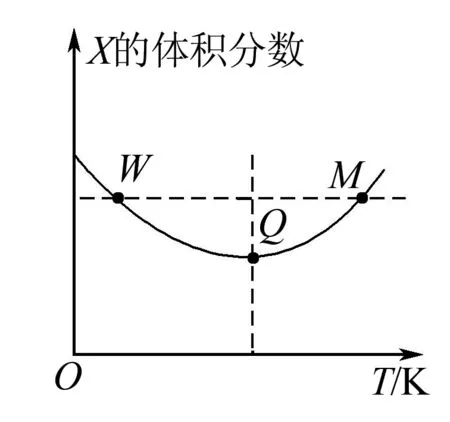
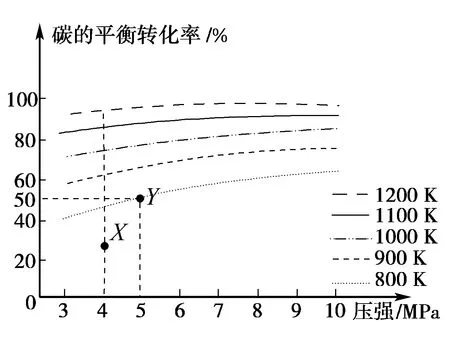
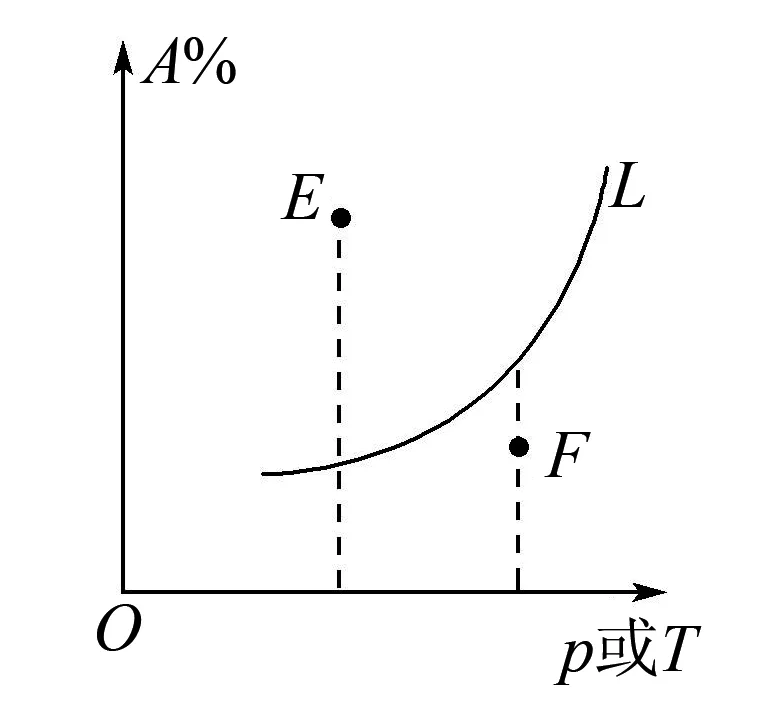
A.温度:T1 B.平衡常数:K(a)=K(b) C.反应速率:vb>va 答案:C 方法规律: (1)“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系.如甲中任取一条温度曲线研究,压强增大,αA增大,平衡正向移动,正反应为气体体积减小的反应,乙中任取横坐标一点作横坐标垂直线,也能得出结论. (2)通过分析相同压强下不同温度时反应物A的转化率的大小来判断平衡移动的方向,从而确定反应的热效应.如利用上述分析方法,在甲中作垂直线,乙中任取一曲线,即能分析出正反应为放热反应. A.Q点时,Y的转化率最大 B.升高温度,平衡常数增大 C.W点X的正反应速率等于M点X的正反应速率 D.平衡时,再充入Y,达到平衡时Z的体积分数一定增大 解析从开始到Q点转化率逐渐增大,从Q点到M点升高温度,平衡向左移动,X的转化率降低,Q点最大,A正确;分析图像,Q点后升高温度,X的体积分数增大,说明升温平衡左移,平衡常数减小,B错误;M点温度高,故反应速率快,C错误;平衡时再充入Y,平衡右移,n(Z)增大但n(Y)也增大,故Z的体积分数不一定增大,D错误. 答案:A A.上述正反应为吸热反应 B.在4 MPa、1200 K时,图中X点v(H2)正 D.工业维持6 MPa、1000 K而不采用10 MPa、1000 K,主要是因为前者碳的转化率高 解析A项,由图观察,温度越高,碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,正确;B项,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,错误;C项,此时碳转化率为50% 起始量/mola2a0 转化量/mol 0.5aa0.5a 平衡量/mol 0.5aa0.5a 答案:A 左上方(E点),A%大于此压强或温度时平衡体系中的A%,E点必须向正反应方向移动才能达到平衡状态,所以,E点v正>v逆;则右下方(F点)v正 例6一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收.反应为 ΔH=-270 kJ·mol-1 (1)其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是____. 图1 图2 (2)某科研小组用Fe2O3作催化剂.在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2).则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为____. 解析(1)从图1中可以看出,相比NiO和Cr2O3,用Fe2O3作催化剂时,在较低温度下,SO2的转化率已达很高,这样既能去除SO2,又能节省能源. 答案:(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2转化率,从而节约能源 (2)a ①相同温度下,[n(H2)/n(CO2)]越大,α(CO2)越大. ②相同投料比[n(H2)/n(CO2)]相同时,温度越高,α(CO2)越小,可知该反应为放热反应(ΔH<0). 总之,化学平衡图像问题的特点是,图像是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象,考查了学生的观察能力、类比能力和推理能力.其解题的基本思路总结为: 学生要综合利用上述信息,总结积累解题方法,灵活运用来解题.

四、反应过程中组分含量或浓度与温度的关系图像

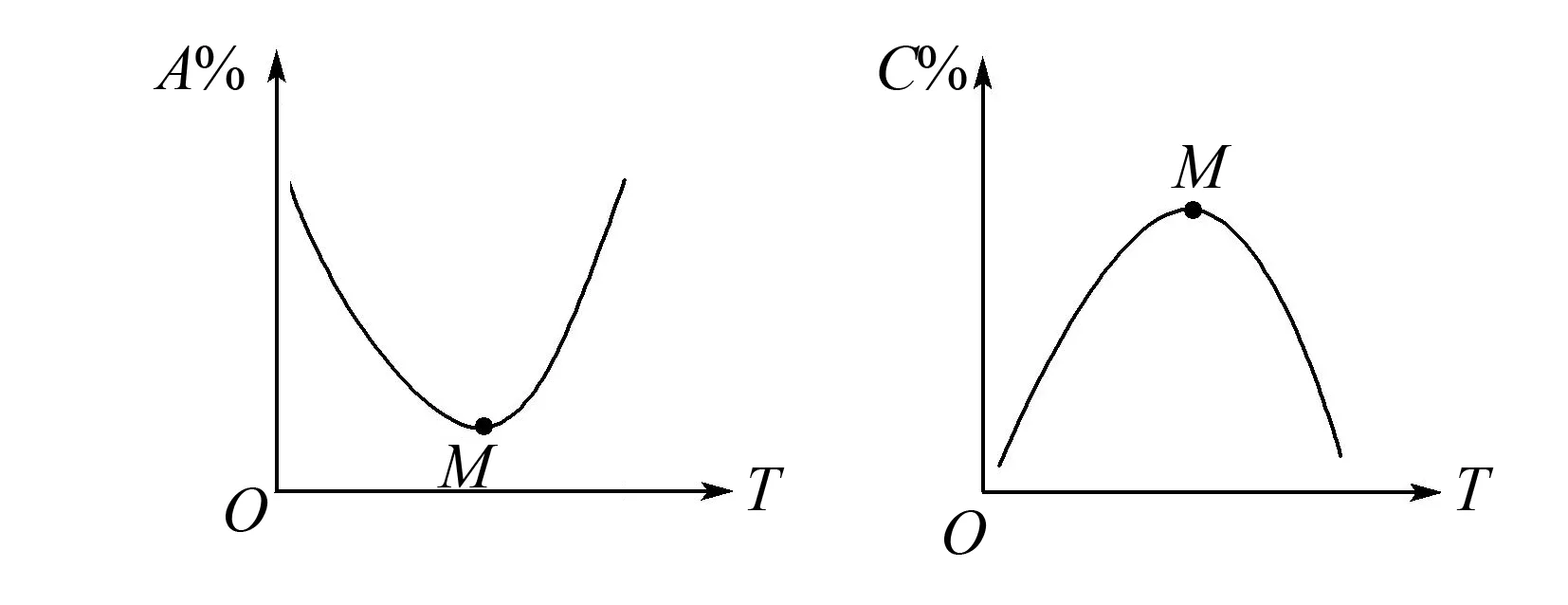

五、组分含量或转化率与温度或压强关系(非平衡点与平衡点分析)


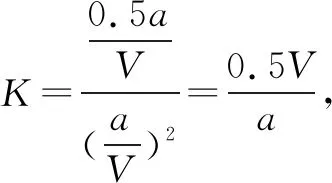

六、化工生产中的转化率或产率与投料比、温度、催化剂关系的有关的图像