高中化学之盐类的水解教学探究
胡风英
[摘要]盐类的水解是高中化学的重要内容,也是高考的必考内容,因其知识点多且抽象而对分析能力要求较高,不少学生在学习过程中感觉较为吃力,解题时往往顾此失彼,出错率较高。鉴于此,有必要对“盐类的水解”的教学过程进行梳理与总结,并围绕具体例题进行讲解,以深化学生对相关知识的理解,帮助学生积累分析“盐类的水解”问题的经验与技巧。
[关键词]高中化学;盐类的水解;教学探究
[中图分类号]G633.8 [文献标识码]A [文章编号]1674-6058(2020)02-0067-02
盐类的水解涉及较多知识点,如有弱才水解,无弱不水解;越弱越水解,弱弱都水解;谁强显谁性,等强显中性;等等。显然这些知识与规律靠死记硬背是不行的,只有深入理解,才能准确、灵活地将其应用于解题中。因此,教师在教学中既要做好教学策略的总结与应用,又要对学生的学习、解题进行指导,使学生彻底掌握这一重点知识。
一、夯实基础,掌握原理
基础知识是分析与解答盐类水解试题的依据,其重要性可想而知。为使学生切实打牢基础,一方面,教师应透彻讲解盐类水解原理,即盐电离出的弱碱阳离子或弱酸阴离子和水电离的OH-或H+结合成电解质分子。为了让学生正确理解盐类水解的原理,教师还应特别强调:其一,盐类水解为中和反应的逆反应;其二,盐类水解为可逆反应,但所占比例非常小。另一方面,讲解温度、浓度、pH值对盐类水解的影响,让学生掌握如下规律:温度一定时,浓度越小,水解程度越大;浓度一定时,温度越高,水解程度越大;改变pH值会促进或抑制水解,应用时具体情况具体分析。
【例1】已知在25℃条件下,有甲、乙、丙三个烧杯,分别盛有25 mL的0.1 mol/L的盐酸、0.1 mol/L的氨水、0.1 mol/L的NH4Cl,现将甲烧杯中的溶液全部倒人乙烧杯中,则所得混合溶液的pH值和丙溶液的pH值相比()。
A.前者大 B.后者大 C.兩者相等 D.不确定
解析:该题考查水解的影响因素,其中甲、乙两个烧杯中的溶液混合后,溶液体积为原来的两倍,盐酸和氨水发生反应会生成0.05 mol/L的NH4Cl溶液。氯化铵是强酸弱碱盐,因其水解常数是一定的,其浓度越小,氢离子和氨水浓度也越小,即对应的酸性越弱,因此,混合溶液的pH值大于丙溶液的pH值,正确答案为A。
该题很好地考查了浓度和盐类水解的关系,以及学生分析问题的能力。可见,教学中教师讲解基础知识后,还应引导学生应用知识。
二、精讲例题,加深理解
例题讲解是盐类水解教学中的重要环节。通过例题讲解可使学生感受盐类水解知识的应用性,更加清晰地理解盐类水解的本质,同时掌握分析问题的思路与方法。高中化学课堂教学时间有限,为了获得预期的例题讲解效果,一方面,要提高例题讲解效率,为此,日常教学中教师应结合经验做好例题的积累,尤其要做好例题的筛选,选择涉及知识点多、代表性较强的例题,保证例题质量。另一方面,讲解例题应全面、细致,既要引导学生联系相关知识,又要鼓励学生反思,明确薄弱知识点,及时查漏补缺。
【例2】下列溶液具有相同的物质的量浓度,则pH从小到大排列正确的是()。
解析:该题涉及的物质较多,需要对比各选项中物质的水解程度,进而做出判断,很好地考查了学生的基础知识掌握情况。A选项中,由于H2SiO3的酸性较H2CO3弱,由“越弱越水解”可知溶液的碱性为Na2SiO3>Na2CO3,而NH4Cl水解显酸性,因此A选项正确;B选项中,NaHCO3的水解大于电离,显碱性,CH3COOH显酸性,C2H5OH不影响水的电离,因此B选项错误;C选项中,FeCl3和Na2SO3水解,分别使溶液显酸性和碱性,而KCl溶液显中性,因此C选项错误;D选项中,正确的顺序应为:H2SO4
B.pH=12的一元强碱和pH=2的一元酸等体积混合:c(H+)=c(OH-)
C.0.1 mol/L的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol/L的硫酸钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
解析:该题考查的知识点较多,需要对各选项的内容逐一进行分析,重点考查学生运用盐类水解知识分析问题的能力。A选项中,由pH=7,得c(H+)=c(OH-),再由电荷守恒得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),A选项正确。B选项中,一元酸的酸性强弱未知,若为强酸,则正确;若为弱酸,则一元酸会有所剩余,溶液呈现碱性,综合来看,B选项错误。C选项中,因NH4+发生水解反应,溶液呈现酸性,溶液中离子间的关系为c(NH4+)>c(SO42-)>c(H+),C选项正确。D选项中,由电荷守恒可得关系:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-),由物料守恒可得关系:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],两式联立将c(Na+)消去可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),D选项错误。综上,正确答案为AC。
比较盐溶液各离子浓度之间的关系时,除了要掌握水解知识外,学生还应掌握相关的守恒关系,包括物料守恒、电荷守恒、质子守恒等,能根据给出的溶液正确写出对应的守恒关系式,并能合理拆分,灵活应用。
四、加強训练,提升能力
学生理解能力、解题能力的提升是一个缓慢的过程,需进行长期训练,因此,教学中教师应将提升学生能力作为教学的重要内容严加落实。一方面,结合盐类水解的教学进度以及课时安排,组织开展专题训练活动,进一步强化学生所学知识。同时,为拓展学生思维,鼓励学生在训练中尝试采用多种解题方法,以实现高效、迅速解题。另一方面,引导学生端正学习态度,尤其针对训练中的错题,应及时摘抄到错题集中,做好错因分析,记录解题思路,起到提醒、警示作用,避免在今后的解题中再犯同样的错误。
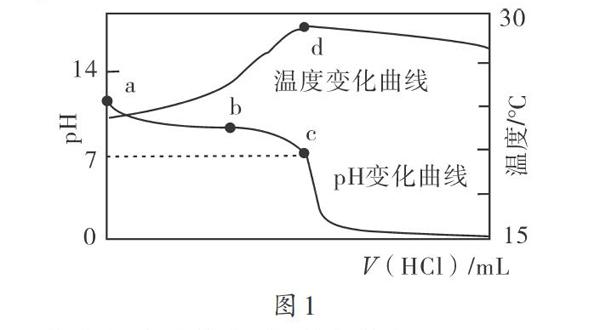
【例4】将1 mol/L的盐酸滴人20 mL 1 mol/L的氨水中,溶液pH值和加人盐酸的体积如图1所示,则()。
A.a点水电离出的氢离子浓度为1x10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度有所降低,因为NH3·H2O电离吸热
解析:该题将盐类水解和图像结合在一起,解题时只有明确化学反应过程,读懂图像,才能做出正确判断。a点pH值处在7和14之间,可知水电离出的c(H+)>1x 10-14,A项错误;b点加人盐酸的体积未知,无法比较,B项错误;c点溶液为中性,由电荷守恒关系c(OH-)+c(Cl-)=c(H+)+c(NH4+),可得c(Cl-)=c(NH4+),C项正确;d点后反应物的离子浓度越来越少,所以溶液的温度在降低,D项错误。
盐类的水解教学中,为提升学生的解题能力应选择具有一定难度的题目,对学生进行强化训练,综合锻炼学生的分析、解题能力。该题配合图像创设问题,很好地考查了学生的盐类水解知识以及读图、识图能力。学生只有准确理解横轴、纵轴表示的含义,才能正确解题。
五、结论
盐类的水解教学中,为使学生能够理解所学知识,灵活、准确、高效地解答相关题型,促进学生解题能力以及学习成绩的提升,教师应做好该部分的教学探究,具体可归结为:
1.无论解答何种题型都会应用到基础知识,因此,教学中要严把基础知识关,不仅要认真讲解教材内容,更要引导学生脚踏实地、一步一个脚印地彻底搞清楚、弄明白盐类水解的基础知识。
2.认真对待例题和习题教学,提高例题讲解质量与效率。同时,在习题训练中,应做好训练题目的筛选,鼓励学生多进行总结与反思,自己归纳错因与解题技巧,如此学生才能在解题中游刃有余。
[参考文献]
[1]叶虹.“盐类的水解”专题复习中概念转变的教学研究[D].南京:南京师范大学,2017.
[2]辛慧敏.“盐类的水解”专题学生学习困难分析与教学对策研究[D].大连:辽宁师范大学,2017.
[3]朵建荣.问题式教学法在高中化学课堂中的应用:以盐类的水解第三课时教学为例[J].中国教育技术装备,2016(9):148-149.
[4]高会.《盐类的水解》教学设计[C]//河北省教师教育学会.河北省教师教育学会2014年教学案例.石家庄:[出版者不详],2015.
[5]潘亚峰.浅析高中化学“盐的水解”的疑难问题及解决方法[J].课程教育研究,2014(18):192-193.
[6]靳卫霞.基于观念建构的“盐类的水解”教学设计与实施[D].济南:山东师范大学,2013.
[7]肖宏伟素养为本”的化学教学设计与实施初探:以“盐类的水解”为例[J].中学化学教学参考,2019(9):19-22.
[8]宋靳红.渗透核心素养的概念转变教学:以“盐类的水解”为例[J].中学化学教学参考,2019(8):47-49.

