多中心耐利奈唑胺凝固酶阴性葡萄球菌耐药机制及同源性分析*
周万青,宋熙晶,生媛,姜飞,徐杰,张之烽,沈瀚
(1. 南京大学医学院附属鼓楼医院a. 检验科,b. 医院感染管理科,南京 210008;2. 东南大学医学院,南京210009;3. 徐州医科大学附属医院检验科,江苏徐州221002;4. 苏州大学附属第一医院临床检测中心,江苏苏州 215006)
利奈唑胺(linezolid)是一种人工合成的噁唑烷酮类抗菌药物,2000年获得美国食品药品监督管理局批准,用于治疗革兰阳性球菌引起的感染,并对凝固酶阴性葡萄球菌、耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)和肠球菌等有较好的治疗效果[1]。利奈唑胺为细菌蛋白质合成抑制剂,作用于翻译系统的起始阶段,抑制mRNA与核糖体连接,从而影响细菌蛋白质合成和细菌生长。
凝固酶阴性葡萄球菌分布广泛,大多无致病性。随着各类广谱抗菌药物的使用和各种侵袭性操作,该类菌的临床分离率和耐药性逐年升高[2]。而耐利奈唑胺凝固酶阴性葡萄球菌检出率不断增加且呈地区性播散[3-4]。造成菌株对利奈唑胺耐药的主要机制是23S rRNA第V功能区突变、cfr基因对核糖体大亚基23S rRNA发生甲基化作用、optrA基因、核糖体蛋白L3、L4位点突变[5]。南京大学医学院附属鼓楼医院2012—2014年发现存在利奈唑胺耐药头状葡萄球菌的院内播散流行,并发现cfr合并23S rRNA突变是造成菌株耐药的决定因素[6]。而对于利奈唑胺耐药凝固酶阴性葡萄球菌在江苏省内的流行性及耐药决定基因尚缺乏数据,为此,本研究收集2017—2018年江苏省3家三级甲等医院临床及环境分离的38株利奈唑胺耐药凝固酶阴性葡萄球菌,进行耐药机制和同源性的分析。
1 材料与方法
1.1菌株来源及鉴定 收集2017—2018年南京大学医学院附属鼓楼医院(GLH)、徐州医科大学附属医院(XYFY)和苏州大学附属第一医院(SDFY)临床分离利奈唑胺耐药凝固酶阴性葡萄球菌32株,各单位菌株数分别为21株、10株和1株,样本来源分别为血液30例,脑脊液和分泌物各1例;采集同期南京大学医学院附属鼓楼医院ICU病区(GLHICU)环境样本并分离获得利奈唑胺耐药凝固酶阴性葡萄球菌6株。所有菌株经菌落形态、革兰染色、凝固酶试验、过氧化氢试验鉴定为凝固酶阴性葡萄球菌,后经Vitek 2 Compact GP鉴定板卡、质谱和16S rRNA基因测序确认,其中头状葡萄球菌32株,人葡萄球菌4株,表皮葡萄球菌1株,缓慢葡萄球菌1株。cfr阳性头状葡萄球菌、粪肠球菌ATCC 29212及金黄色葡萄球菌ATCC 25923均为本院微生物室保存菌株。
1.2主要试剂及仪器 2×Taq Mix(DBI公司),PCR引物由上海生工公司合成,Vitek 2 Compact及配套GP鉴定卡、GP67药敏板卡以及利奈唑胺E-Test试纸条(法国生物梅里埃公司),脉冲场凝胶电泳(PFGE)琼脂糖(Bio-Rad公司),SmaⅠ内切酶(Fermentas公司),十二烷基肌氨酸钠、EDTA、Tris、溶葡萄球菌素、溶菌酶(上海生工生物公司),蛋白酶K(Merck公司),Qiagen DNA提取试剂盒(德国Qiagen公司),Lambda Ladder PFG marker(NEW ENGLAND BioLabs);PCR扩增仪(PE公司),CHEF Mapper XA电泳仪及GelDoc XR型凝胶成像分析系统(Bio-Rad公司)。
1.3药敏试验 用Vitek 2 Compact及配套GP67药敏卡对菌株进行药物敏感性测定,并采用E-test纸条法测定菌株对利奈唑胺的最低抑菌浓度(MIC),所有结果判读基于CLSI 2019判定标准[7]。
1.4细菌DNA的提取及PCR扩增 采用煮沸法提取菌株DNA作为PCR模板。根据文献[3, 8-9]合成23S rRNA第V功能区基因、cfr基因及optrA基因引物,见表1。PCR体系20 μL,包括2×Taq Mix 10 μL,DNA模板1 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 6 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 60 s,72 ℃ 60 s,30个循环;72 ℃ 7 min。PCR产物经10 g/L琼脂糖凝胶电泳观察。阳性产物送上海生工生物公司进行测序,结果在BLAST进行比对分析。
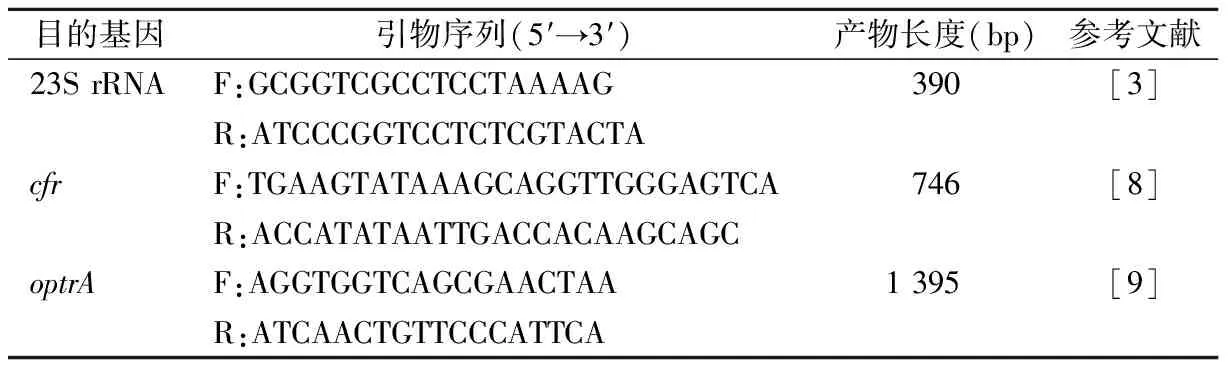
表1 靶基因PCR引物序列及产物大小
1.5PFGE 取经35 ℃培养14~18 h的菌株菌落均匀悬浮于已配制的PIV buffer(1 mol/L NaCl,10 mmol/L Tris-HCl,pH7.4)中,调节浓度至4.0麦氏浓度单位,取200 μL菌液与200 μL包埋胶[0.32 g PFGE电泳琼脂糖+20 mL TE(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)]混合至EP管中后进行浇孔灌模,成型后移至3 mL Lysis buffer[100 mmol/L EDTA,6 mmol/L Tris-HCl,1 mol/L NaCl,0.5%十二烷基肌氨酸钠pH7.4,0.2%去氧胆酸钠(内含25 μL 25 mg/L溶菌酶和10 μL 100 mg/L溶葡萄球菌素)]中37 ℃过夜;弃去过夜的Lysis buffer,加入含150 μL蛋白酶K(20 mg/mL)的3 mL ESP buffer(0.5 mol/L EDTA,1%十二烷基肌氨酸钠,pH8.0),56 ℃过夜;用预热的TE 10∶1洗胶块6次;用限制性内切酶SmaⅠ(30 U)30 ℃酶切消化基因组DNA,上梳子、浇板完成后,使用CHEF-Mapper XA系统进行电泳分析,设置参数电压6 V/cm、电泳温度14 ℃、夹角120°,21 h,脉冲为1~30 s,EB染色20~30 min,使用GelDoc XR型凝胶成像分析系统拍照。最终结果以Tenover为标准[10]。
2 结果
2.1药敏结果 38株菌对利奈唑胺、青霉素和苯唑西林均耐药,对万古霉素均敏感;对克林霉素、左氧氟沙星和环丙沙星耐药率在95%以上;临床分离株对奎奴普丁-达福普汀、四环素和利福平较敏感,环境分离株对左氧氟沙星和复方磺胺甲噁唑均耐药;头状葡萄球菌除对四环素和复方磺胺甲噁唑有较高敏感,对其余常规药物耐药率达75%以上,人葡萄球菌、表皮葡萄球菌和缓慢葡萄球菌均对庆大霉素敏感。见表2。利奈唑胺MIC分布为12~256 mg/L,其中256 mg/L及以上31株,12 mg/L 3株,64 mg/L 3株和24 mg/L 1株。
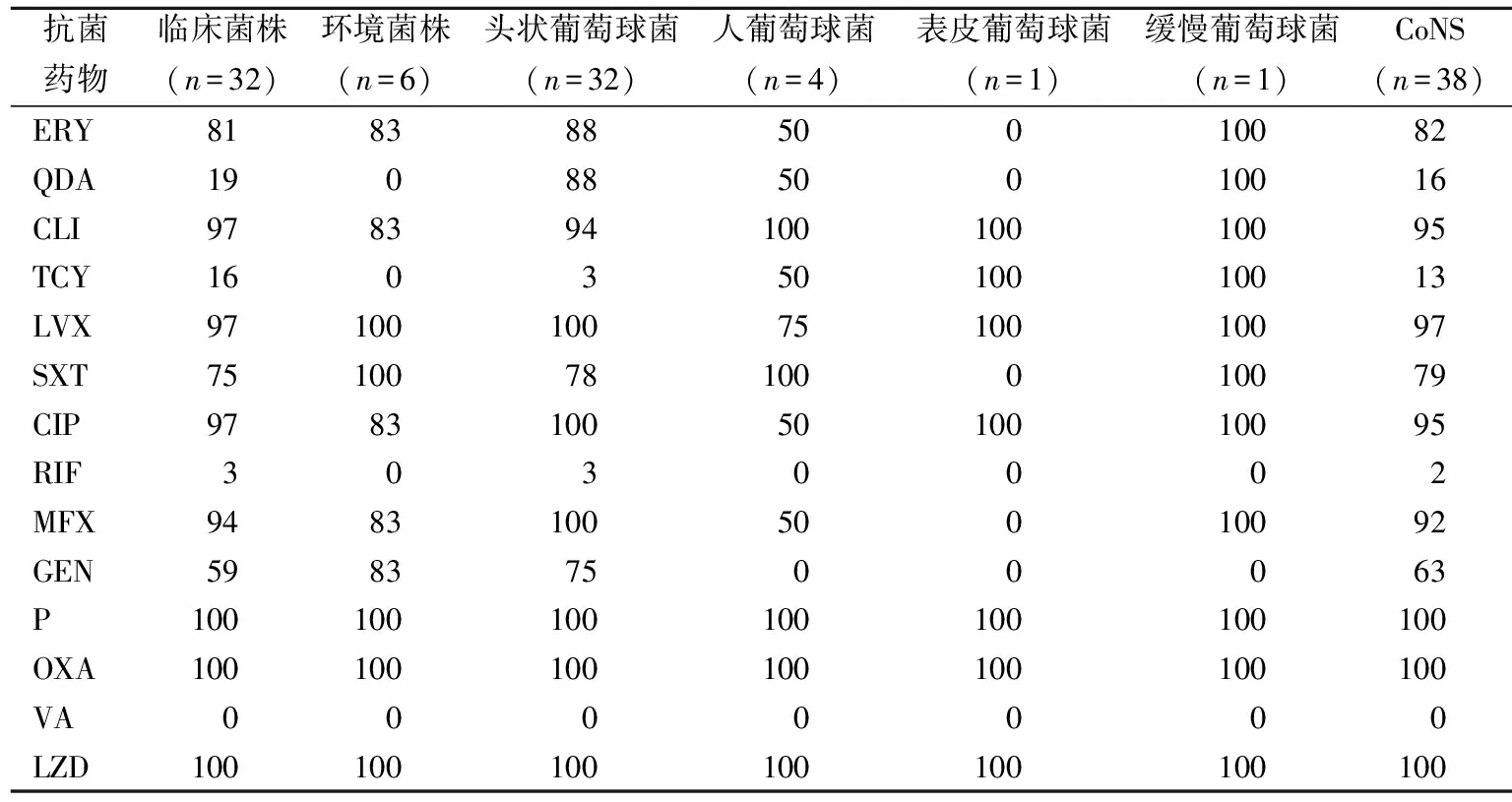
表2 临床和环境菌株常规药物耐药率(%)
注:ERY,红霉素;QDA,奎奴普丁-达福普汀;CLI,克林霉素;LVX,左氧氟沙星;TCY,四环素;SXT,复方磺胺甲噁唑;CIP,环丙沙星;RIF,利福平;MFX,莫西沙星;GEN,庆大霉素;P,青霉素;OXA,苯唑西林;VA,万古霉素;LZD,利奈唑胺;CoNS,凝固酶阴性葡萄球菌。
2.2耐药基因检测结果 PCR结果显示31株菌携带cfr基因(82%),其中头状葡萄球菌27株、人葡萄球菌2株、表皮葡萄球菌和缓慢葡萄球菌各1株;23S rRNA第V功能区基因扩增均阳性,35株菌株检出G2576T突变,其中2株人葡萄球菌同时检出G2576T和C2319T突变,另在表皮葡萄球菌和人葡萄球菌检出C2319T突变各1株,1株缓慢葡萄球菌未获成功测序;所有菌株均未检测出optrA基因。部分菌株的基因检测结果见图1。
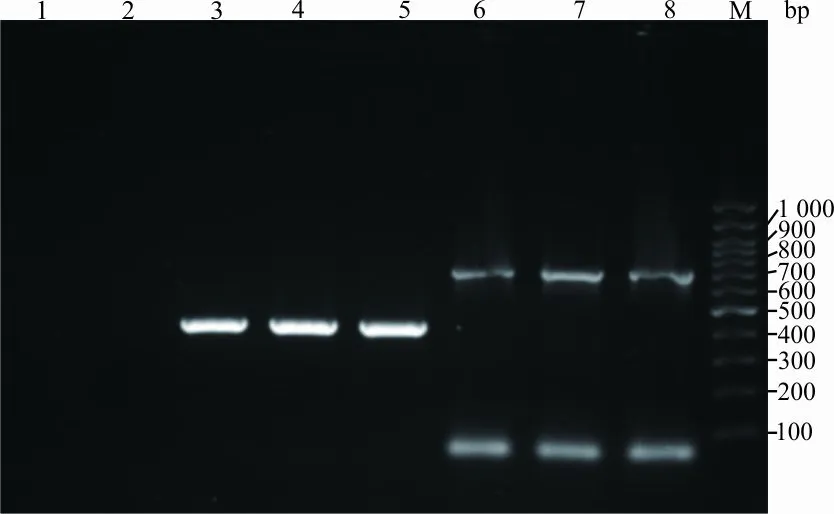
注:1,阴性对照;2,optrA基因;3—5,23S rRNA V区;6—8,cfr基因;M,100 bp DNA Ladder marker。
图1部分菌株的耐药基因扩增产物电泳分析
2.3PFGE结果分析 32株头状葡萄球菌PFGE具有高度的相似性,均为同一个克隆株,可分为4个不同的亚克隆,分别为A1、A2、A3和A4,菌株数分别为4株、26株、1株和1株。见图2。4株人葡萄球菌分别来自GLH临床分离株(1株)、XYFY临床分离株(2株)和GLH环境分离株(1株),其PFGE电泳图谱显示为同一克隆,其中GLH临床分离株和GLH环境分离株为AA1亚型,XYFY临床分离株分别为AA2和AA3亚型。见图3。

注:M,Lambda Ladder PFG marker;1—4、11,GLH临床分离株;5—8,XYFY临床分离株;9-10,GLH环境分离株;12,SDFY临床分离株。泳道1-12菌株克隆分型分别为A1、A2、A2、A3、A4、A2、A2、A2、A2、A2、A2、A3。
图2部分利奈唑胺耐药头状葡萄球菌菌株PFGE分析
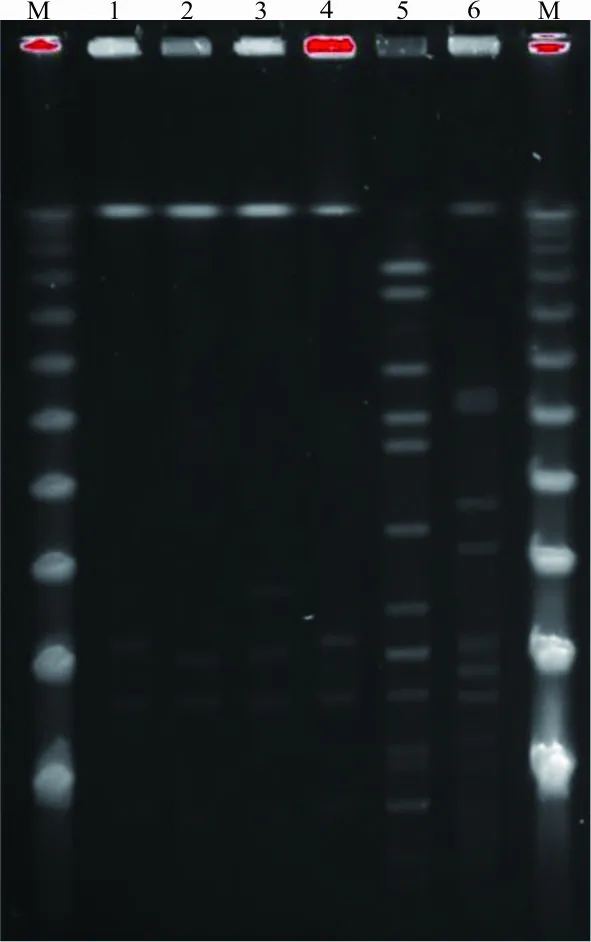
注:M,Lambda Ladder PFG marker;1—4,人葡萄球菌分离株;5,表皮葡萄球菌分离株;6,缓慢葡萄球菌分离株。泳道1—4人葡萄球菌克隆分型分别为AA1、AA2、AA3、AA1。
图3其他利奈唑胺耐药凝固酶阴性葡萄球菌PFGE分析
3 讨论
利奈唑胺自2007年在中国上市以来,我国多个城市陆续发现了利奈唑胺的耐药株,并以凝固酶阴性葡萄球菌为主[11]。本研究收集江苏地区利奈唑胺耐药凝固酶阴性葡萄球菌临床分离株32株,并对GLHICU环境采样获得的6株耐药菌株进行检测分析。临床检出耐药菌株中以血流分离最高,达93.8%(30/32),这与国内数据具有相似性[11-12]。药敏结果显示,38株耐利奈唑胺凝固酶阴性葡萄球菌均对青霉素和苯唑西林耐药,对克林霉素、左氧氟沙星和环丙沙星耐药率均等于或高于95%,呈现多重耐药;环境分离株对左氧氟沙星和复方磺胺甲噁唑均耐药;头状葡萄球菌除对四环素和复方磺胺甲噁唑有较高敏感,其他检测药物耐药率均较高。38株菌均未出现万古霉素耐药菌株,说明万古霉素可用于治疗耐利奈唑胺凝固酶阴性葡萄球菌相关感染。
葡萄球菌利奈唑胺耐药与23S rRNA突变或cfr基因共同介导有关[13],这与本研究结果一致。本调查显示cfr基因阳性检出率为81.6%(31/38),与陈宏斌等[11]报道相似。阳性检出菌种以头状葡萄球菌为主,占27株,其次为人葡萄球菌2株、表皮葡萄球菌和缓慢葡萄球菌各1株。临床菌株中存在人葡萄球菌和头状葡萄球菌各1株未检出cfr基因,而环境菌株中仅1株头状葡萄球菌检出该基因。由此可见,临床菌株中cfr的携带率明显高于环境菌株(93.8% vs 16.7%)。国内文献报道cfr可能存在于2种不同质粒,分别为pRM01和pHK01[11]。江苏地区耐药菌株中cfr基因的定位和可能传播机制尚待进一步验证。除cfr基因外,所有菌株23S rRNA第V功能区基因扩增均阳性,35株菌株检出G2576T突变,其中2株菌(人葡萄球菌)同时检出G2576T和C2319T突变,另在表皮葡萄球菌和人葡萄球菌检出C2319T突变各1株,1株缓慢葡萄球菌未获成功测序。23S rRNA第V功能区G2576T突变是介导阳性球菌利奈唑胺耐药主要决定因素[5]。38株菌中未检出optrA基因,有文献指出optrA基因在肠球菌检出率高[13]。GLH对2014—2017年度临床分离肠球菌利奈唑胺耐药调查显示,optrA是主要介导基因[14]。关于葡萄球菌携带optrA基因只在动物源中有报道,optrA基因是继cfr基因报道后的第2个可转移的利奈唑胺耐药基因,易通过质粒转移,其能否通过葡萄球菌实现人畜之间的传播仍需考证[13]。
本研究38株凝固酶阴性葡萄球菌包括32株头状葡萄球菌,其PFGE具有高度的相似性,均为同一个克隆株,4株人葡萄球菌为同一克隆株,可见3家医院间流行的利奈唑胺耐药凝固酶阴性葡萄球菌存在克隆播散。而且,GLH环境分离株存在与临床分离同一克隆的菌株。国外已有报道发现耐药菌株可在患者或院际间克隆传播[15],GLH 2012—2014年调查发现曾出现5株同一克隆株播散的利奈唑胺耐药头状葡萄球菌[6]。本次研究数据显示与之前流行菌株也为同一克隆。由此可见,江苏地区存在利奈唑胺耐药凝固酶阴性葡萄球菌的播散流行。医院应采取积极、严格的消毒和隔离等措施,加强感控和细菌耐药性监控力度,防止耐利奈唑胺凝固酶阴性葡萄球菌克隆播散的加重。

