绵羊肺炎支原体感染对绵羊肺泡巨噬细胞和小鼠巨噬细胞 Raw264.7 蛋白质组的影响
张颖 张凯 马金成 李小杰 马春骥 高力扬
摘要:【目的】评估小鼠巨噬细胞系Raw 264.7替代绵羊肺泡巨噬细胞用于研究绵羊肺炎支原体(MycoplasmaovipneumonZae,Mo)致病机制的可行性。【方法】从绵羊肺脏灌洗液中分离绵羊原代肺泡巨噬细胞,以绵羊原代肺泡巨噬细胞和小鼠巨噬细胞Raw 264.7细胞系为细胞模型,使用绵羊肺炎支原体Y98标准株分别感染(MOI=10)绵羊原代肺泡巨噬细胞和小鼠巨噬细胞Raw 264.7细胞系24h后,通过蛋白质组学或定时荧光定量PCR检测Mo刺激后两种细胞中部分蛋白或基因的相对表达量。【结果】从肺中成功分离出绵羊原代肺泡巨噬细胞,经免疫荧光鉴定显示其带有巨噬细胞特异性表面抗原CD14;经Mo感染后,绵羊原代肺泡巨噬细胞和小鼠巨噬细胞Raw 264.7中FADD、IL-1β、NOS2及THBS1等基凶的表达均发生显著变化,主要涉及Toll样受体信号通路、MAPK信号通路、白噬作用等生物过程且两种细胞各基凶的相对表达变化趋势基本一致。【结论】本研究初步表明选用小鼠巨噬细胞Raw 264.7细胞系替代绵羊原代巨噬细胞进行与Mo的互作研究具有一定的可行性,可为简化Mo致病机制研究模型提供理论基础。
关键词:绵羊肺炎支原体;绵羊肺泡巨噬细胞;Raw 264.7细胞;细胞模型
中图分类号:Q233
文献标志码:A
文章编号:1008-0384(2020)11-1244-08
0引言
【研究意义】绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)是造成绵羊传染性胸膜肺炎的主要致病菌[1],除绵羊外,Mo在山羊、大角羊及其他野生小反刍动物中均有发现[2-4]。Mo通过气溶胶或飞沫在羊群中传播,患病羊常表现出高热、咳嗽、贫血、生长发育迟缓,渐进性消瘦和肺间质增生等症状[5]。近年来,宁夏、甘肃、四川、新疆等地均有绵羊支原体肺炎的病例报道,其传染性强、发病率高、死亡率高,给羊养殖业带来了重大的经济损失[6,7]。然而,目前国内外有关Mo致病机理的研究较为有限,对防控Mo感染的研究尚未取得突破性进展。在Mo研究过程中,绵羊体型较大,使用成本较高,是Mo致病机理研究受限的因素之一。应用模式动物(如小鼠、斑马鱼、非洲爪蟾等)构建动物/细胞模型是一种非常典型的生物学研究模式,模式动物的生命活动过程在一定程度上可以成为人体、珍稀物种或体型庞大物种相应研究的参照。小鼠及小鼠的细胞系作为目前使用最广泛的哺乳动物/细胞模型,廉价易得,且生物学背景已被研究得较为详尽,因此将其替代绵羊作为动物/细胞模型用于研究Mo感染的致病机理具有积极的现实意义。【前人研究进展】巨噬细胞是机体固有免疫的重要参与者,它可以吞噬并杀伤入侵的病原微生物,释放炎症因子,还能通过抗原递呈调节T细胞而参与适应性免疫应答[8],在抵抗Mo感染的过程中发挥着重要的作用[9]。有研究显示,NOD2/c-Jun NH 2终端激酶能够触发绵羊肺炎支原体诱导的巨噬细胞白噬[10];肺炎支原体已被证明其能够与巨噬细胞相互作用,并诱导炎症细胞因子的产生。绵羊原代巨噬细胞难以分离、不易培养(容易污染)、不能传代,加大了Mo相关研究的难度,因此选择能够替代绵羊原代巨噬细胞的细胞模型对于加快Mo的研究进程尤为重要。【本研究切入点】小鼠巨噬细胞Raw 264.7细胞系具有遗传背景清晰、可传代及易培养等优点,已被广泛应用于病原与宿主巨噬细胞互作的研究中[11]。Jiang等用纯化的重组蛋白绵羊肺炎支原体上的延伸因子Tu(rEF-Tu)和热休克蛋白70(rHSP70)免疫BALB/c小鼠,结果显示:支原体衍生脂质相关膜蛋白能够通过TLR2信号诱导小鼠内膜巨噬细胞的分泌[12]。另外,Luo等利用小鼠巨噬细胞研究发现绵羊肺炎支原体能够诱导巨噬细胞发生白噬[10]。虽然已有研究将小鼠巨噬细胞用于绵羊肺炎支原体致病机理的研究中,但小鼠巨噬细胞模型能否替代绵羊原代巨噬细胞应用于绵羊支原体肺炎的研究尚缺少系统的报道。【拟解决的关键问题】本研究分别应用绵羊原代巨噬细胞和小鼠巨噬细胞Raw 264.7细胞系构建Mo感染模型,通过蛋白质组学或RT-PCR检测绵羊原代巨噬细胞和Raw 264.7细胞感染Mo后相关分子与通路的表达变化,从而探讨小鼠巨噬细胞Raw 264.7作为细胞模型应用于Mo相关研究的可行性。
1材料与方法
1.1试验材料
绵羊原代肺泡巨噬细胞(分离白1.5~2岁龄绵羊肺脏组织)、小鼠巨噬细胞Raw 264.7(购白中国科学院典型培养物保藏委员会细胞库);Mo标准株Y98由宁夏大学西部特色生物资源保护与利用教育部重点实验室保存;所用引物均由上海Sangon Biotech公司合成。
胎牛血清和DMEM均購白美国Gibco公司;青霉素-链霉素、马血清购白中国Hyclone公司;支原体培养基基础购白青岛海博生物有限公司;RNA提取试剂盒购白美国Omega公司;反转录试剂和SYBRPremix Ex TaqTM购白日本Takara公司;CD14抗体、β-actin抗体及荧光二抗等均购白Proteintech公司;激光共聚焦显微镜来源于德国Leica公司;实时荧光定量PCR使用QuantStudio?5系统完成。
1.2试验方法
1.2.1绵羊原代肺泡巨噬细胞的分离鉴定 取新屠宰绵羊的肺脏,向其支气管处灌入适量无菌PBS缓冲液冲洗肺脏内部,此过程中轻揉肺脏5~10min,充分冲洗出游离的绵羊肺泡巨噬细胞,反复冲洗4次后经单层无菌纱布过滤冲洗液,将滤液经300g离心5min收集细胞。然后,将收集的细胞经PBS清洗3次后用含有15%胎牛血清、2.5μg-mL-1两性霉素B、100μg·mL-1氨苄青霉素、25μg·mL-1庆大霉素的DMEM培养基重悬,置于37℃,含5%CO2培养箱中培养0.5h,收集上清液以除去先贴壁生长的成纤维细胞和沉淀的组织残渣。随后,将细胞上清液300g离心5min后用细胞培养液重悬并进行分皿培养,从而获得绵羊原代肺泡巨噬细胞。利用巨噬细胞特异性表面抗原CD14对分离得到的生长状态良好的绵羊原代肺泡巨噬细胞进行免疫荧光鉴定。
1.2.2Mo进入绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7后的定位 分别收集生长状态良好的绵羊原代肺泡巨噬细胞和小鼠巨噬细胞Raw264.7悬液,以1×104cell·mL-1的密度接种于铺有无菌细胞爬片的24孔板中培养6~8h,使其贴壁生长于细胞爬片上。将经DiO绿色荧光染料染色的Mo菌体(具体参照翊圣40725ES10产品说明书操作)分别加入至绵羊原代肺泡巨噬细胞和小鼠巨噬细胞Raw264.7中,置于37℃,含5%CO2的培养箱中共培养12h,随后,将细胞爬片用PBS清洗5次,每次5min,以除去吸附在细胞上的Mo。然后将爬片分别经4%多聚甲醛室温下固定30min;0.3%Triton X-100的PBS缓冲液室温下通透20min;BSA室温封闭30min后加入200μL以1:100比例稀释的β-actin抗体,4℃避光过夜孵育。次日将细胞爬片经PBS清洗后,加入300μL以1:1000比例稀释的荧光二抗,室温避光孵育1h,经PBS缓冲液清洗后加入适量抗荧光淬灭的DAPI染液染核封片,使用激光共聚焦显微镜观察并采集图像。
1.2.3Mo的培养及菌体收集 培养基配方为:支原体培养基基础(33g·L-1),灭活马血清(200 mL·L-1),青霉素(200IU·mL-1),5%醋酸铊(4mL·L-1),丙酮酸钠(2g·L-1),用1mol·L-1NaOH将pH调至7.4左右,混匀后-4℃保存备用。从-80℃超低温冰箱中取出1mL冻存的Mo标准株Y98菌液,按照1:5的比例加入到预先配好的液体培养基中,置于37℃恒温培养箱中培养3~5d,待生长稳定后12000r·min-1离心10min收集菌体,然后用PBS缓冲液离心洗涤3次进行后续试验。
1.2.4蛋白质组学分析 将生长状态良好,处于对数生长期的绵羊原代肺泡巨噬细胞经胰蛋白酶消化后制成悬液,以5×106cell·mL-1的密度接种于60mm细胞培养皿中,置于37℃,含5%CO2培养箱中培养6-8h使其贴壁生长,待细胞融合度达70%时,用Mo菌株感染绵羊原代肺泡巨噬细胞24h,提取细胞总蛋白。对提取后的蛋白样品进行还原烷基化处理,用考马斯亮蓝法测定蛋白浓度,通过iTRAQ的高效液相色谱.串联质谱法(HPIC-MSIMS)对每个蛋白样品进行液相分离和质谱分析。随后,采用MaxQuant软件对质谱数据进行分析,并对蛋白质进行鉴定和定量分析,以倍数上调>2倍或下调<0.5倍,且P<0.05的标准筛选差异蛋白质,并进行差异蛋白聚类分析及差异蛋白GO功能的富集分析,进一步利用KEGG数据库来确定差异蛋白中显著性富集的Pathway。
1.2.5细胞总RNA的提取及RT-PCR分析 将生长状态良好的Raw264.7细胞以5×106cell·mL-1的密度接种于60mm细胞培养皿中,置于37℃,含5%CO2的恒温培养箱中培养6~8h使其贴壁生长,待细胞融合度达70%时,用Mo菌株感染Raw264.7细胞24h。然后根据Omega 6834-01产品说明书提取总RNA并通过NanoDrop 8000和琼脂糖凝胶电泳检测提取RNA的浓度及纯度。根据逆转录试剂盒(TaKaRa PrimeScript TM RT reagent Kit)提供的条件获取cDNA,反转录反应体系(10μL):5×PrimeScriptBuffer 2μL; PrimeScript RT Enzyme Mix I 0.5μL;Oligo dT Primer 50 μmoI·L-1 0.5μL; Random 6 mers100μmol·L-1 0.5μL; Total RNA 1μg; RNase FreedH2O添加至10μL,反應条件:37℃反转录15min,85℃反转录酶失活5s,4℃延伸后放置于冰上;随后,根据试剂盒(TaKaRa TB Green ? Premix Ex TaqTMII)提供的条件进行定量PCR,反应体系(20μL):TB Green Premix Ex Taq II 10μL; PCR ForwardPrimer(10μmoI·L-1)0.8μL; PCR Reverse Primer(10μmol·L-1)0.8μL; cDNA 2μL; RNase Free dH2O添加至20μL,反应条件:95℃15s;95℃5s,60℃34s,40个循环;以GAPDH为内参基因,各处理进行3次重复,采用2-△△Ct值方法计算mRNA相对表达量。
1.3数据处理
数据采用SPSS17.0和Graph Pad Prism 7软件进行统计学分析及作图,数据以均值±标准差(mean±SD)表示,采用t检验,以P<0.05表示差异有统计学意义。
2结果与分析
2.1绵羊原代肺泡巨噬细胞的分离鉴定
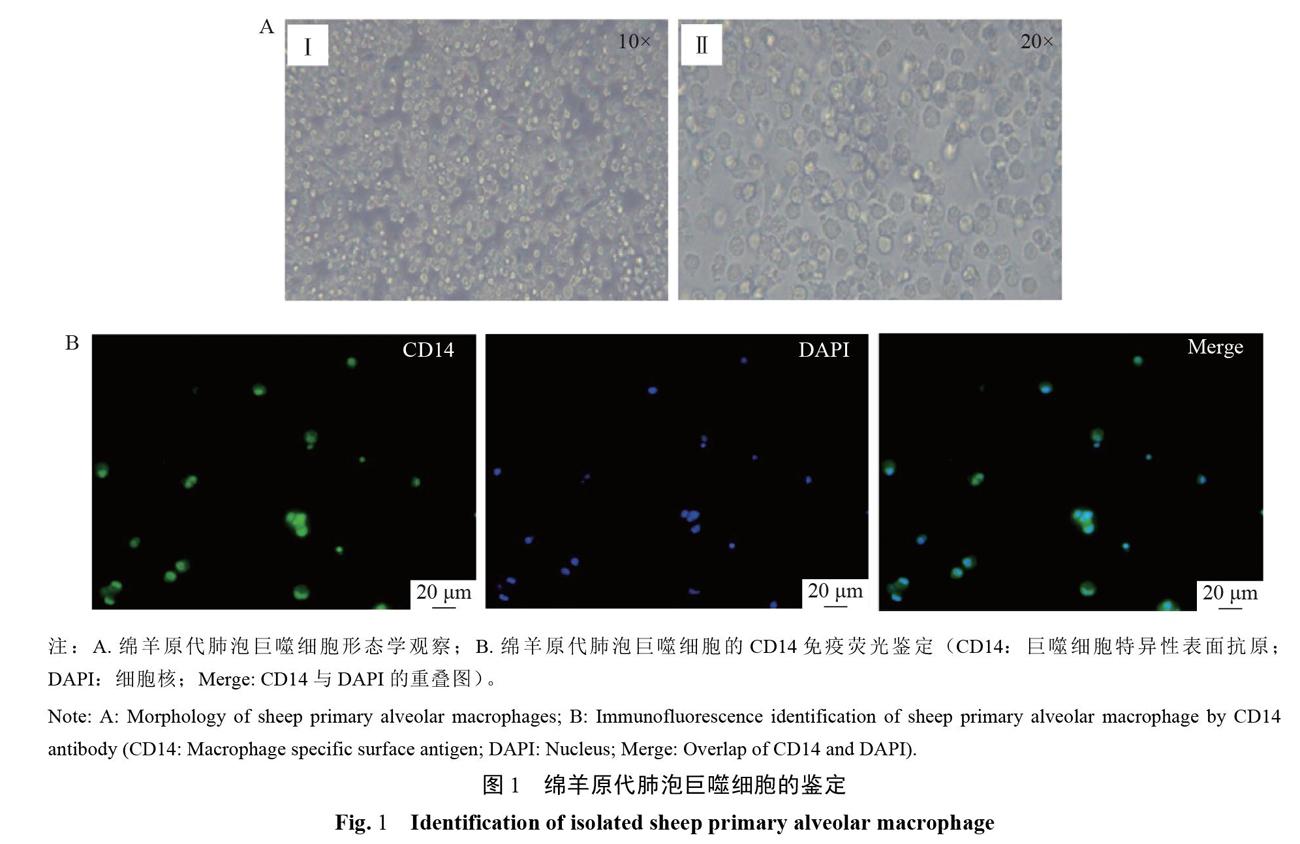
将分离得到的形态单一、生长良好的绵羊肺脏细胞置于倒置显微镜下观察其形态,结果如图1-A:分离到的绵羊原代肺泡巨噬细胞呈现明显的椭网形,细胞核质结构明显,表现出典型的巨噬细胞贴壁生长特性。为了进一步鉴定其是否为绵羊肺泡巨噬细胞,利用CD14抗体对分离得到的细胞进行免疫荧光标记,观察其是否存在巨噬细胞特异性表面抗原CD14,结果如图1-B:大部分细胞均被CD14抗体标记,说明分离到的绵羊原代肺泡巨噬细胞纯度较高,可以用于后续试验。
2.2Mo进入绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7后的定位
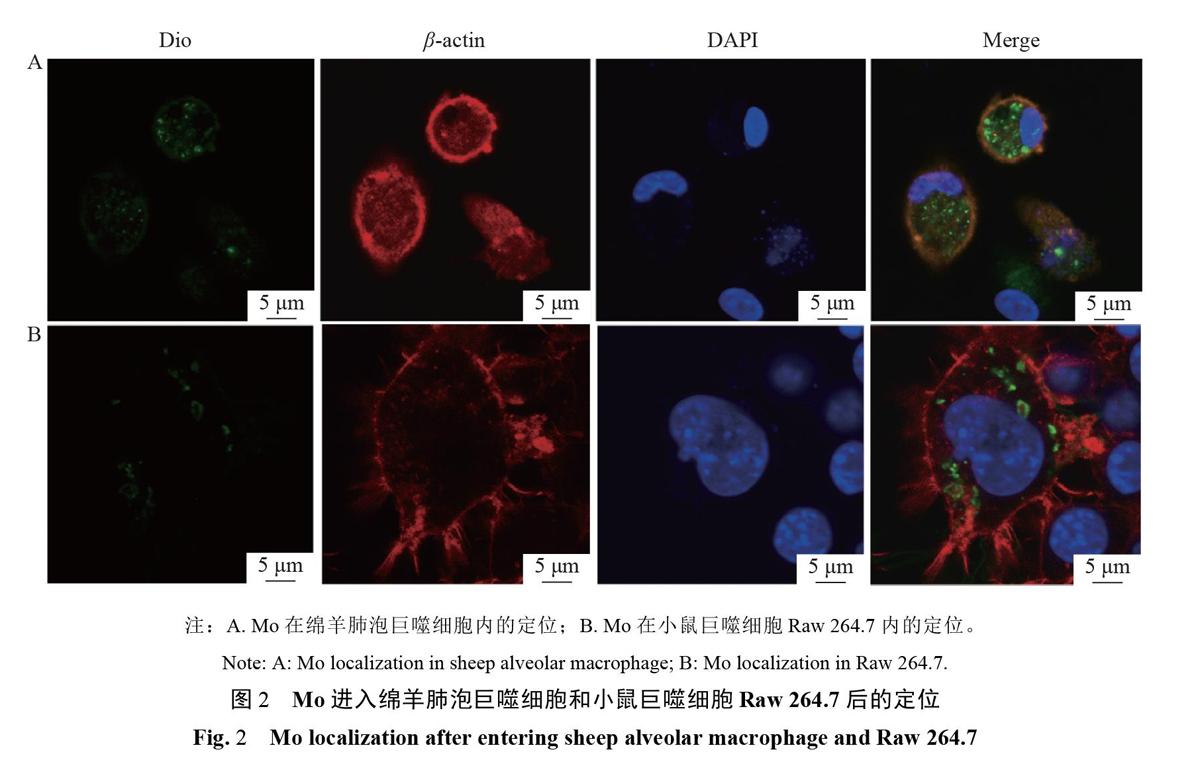
为了对比Mo感染绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7后在两种细胞内定位的差异,利用DiO绿色荧光染料标记Mo菌体,利用β-actin抗体分别标记绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7,使用激光共聚焦显微镜对细胞内Mo的分布进行观察。结果如图2。DiO标记(绿色)的Mo菌体均可以进入绵羊肺泡巨噬细胞和RAW264.7巨噬细胞中(红色为β-actin抗体标记的细胞骨架),且主要位于细胞质中。表明Mo进入巨噬细胞这一现象在小鼠巨噬细胞Raw264.7和绵羊肺泡巨噬细胞中具有一致性,推测Mo进入巨噬细胞这一现象可能与巨噬细胞来源无关。
2.3绵羊肺泡巨噬细胞感染Mo后相关分子表达变化
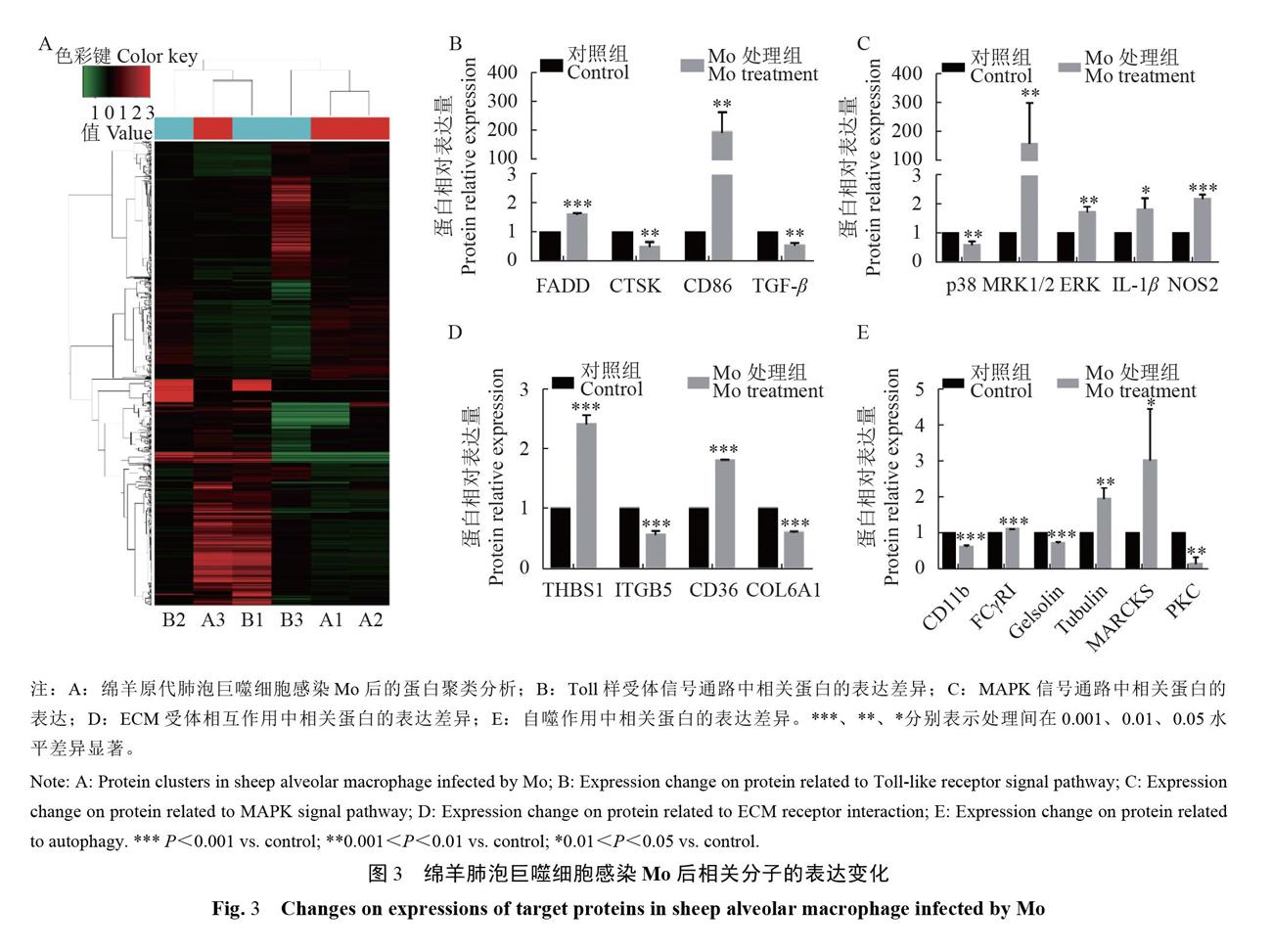
为了探究绵羊肺泡巨噬细胞感染Mo后相关分子的表达变化差异,以未感染Mo的绵羊原代巨噬细胞为对照组,以感染Mo的绵羊原代巨噬细胞为处理组,对其进行差异蛋白聚类分析(图3-A)及差异蛋白GO功能的富集分析,结果如图3-B~E:与对照组相比,Mo感染组Toll样受体信号通路中FADD、CD86等蛋白、MAPK信号通路中p38、ERK等蛋白、白噬作用中CD11b、PKC等蛋白及细胞与细胞外基质(ECM)受体相互作用中THBS1、CD36等蛋白的表达量发生显著变化。这些分子主要与巨噬细胞的免疫应答、凋亡以及自噬等生物过程相关。说明绵羊原代肺泡巨噬细胞感染Mo后其Toll样受体信号通路、MAPK信号通路、ECM受体相互作用及自噬作用途径可能被激活或被抑制。
2.4小鼠巨噬细胞Raw264.7感染Mo后相关分子的表达变化
为了进一步探究绵羊肺泡巨噬细胞感染Mo后发生显著变化的相关分子在小鼠巨噬细胞Raw264.7感染模型中的差异,采用RT-qPCR将筛选出的基因在Raw264.7细胞中进行分析,对每个目标基因分别进行3次独立检测。结果如图4-A-D:与对照组相比,Mo感染组FADD、CTSK、IL-1β、THBS1及MARCKS等基因的mRNA表达量发生显著变化。证明Toll样受体信号通路、MAPK信号通路、ECM受体相互作用及自噬作用途径同样参与了Mo感染小鼠巨噬细胞Raw264.7的过程,且与Mo感染绵羊肺泡巨噬细胞的结果基本一致,提示Raw264.7细胞具有替代绵羊肺泡巨噬细胞成为研究Mo致病机制细胞模型的可能性。
2.5绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7感染Mo后相关分子表达变化的比较
为了更加直观地表示绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7感染Mo后相关分子表达变化的差异,根据上述试验结果绘制了绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw264.7感染Mo后相关分子表达差异比较图(图5)。图中橙色代表上调表达的基因,绿色代表下调表达的基因。结果显示,与绵羊肺泡巨噬细胞相比,小鼠巨噬细胞Raw264.7感染Mo后,与巨噬细胞功能密切相关的部分信号通路中FADD、IL-1β、NOS2、THBS1、FcyR1、AAIAR CKS等分子的表达发生显著改变,且变化趋势与绵羊原代肺泡巨噬细胞感染Mo后的结果一致,这些分子主要涉及Toll样受体信号通路、MAPK信号通路及ECM受体相互作用,主要参与巨噬细胞的免疫应答、凋亡及自噬等相关生物过程,且Mo对两类细胞中这些通路的影响基本一致。小鼠巨噬细胞中ERK1/2、TGF-β、PKC、CD36基因的相对表达与绵羊巨噬细胞的蛋白表达变化不一致,猜想可能小鼠巨噬细胞和绵羊巨噬细胞受到Mo感染之后部分细胞因子的表达具有差异,也可能因为转录后调控使得基因表达与蛋白表达有部分差异,具体原因需要进一步试验证明。
3 讨论与结论
目前大量研究显示,动物支原体如人支原体[13]、羊支原体[14]、鸡毒支原体[15]、猪支原体[16]等均能够引起其宿主免疫反应导致呼吸道损伤。此过程中涉及多种信号通路的参与及调控。其中Toll样受体(Toll Like Receptor,TLR)作为主要的免疫识别受体,其在Mo感染宿主细胞过程中发挥着重要作用。TLR2和TLR4是支原体感染中关键的受体,可通过MyD88途径或TRIF途径激活免疫应答,在肺炎支原体感染中发挥双重作用[17],即诱导适当的免疫反应从而清除肺炎支原体或引起过度的炎症反应导致肺炎支原体并发症。Zhang等分別通过人支原体感染THP-1细胞、RAW264.7细胞和原发性腹膜巨噬细胞来分析TIPE2(肿瘤坏死因子α诱导蛋白)的表达变化,结果表明:免疫反应的负调节剂TIPE2能够通过MAPK信号通路负调节人支原体肺炎触发的免疫反应[18]。并且Hwang等证实NF-κB和MAPK信号通路参与了猪肺炎支原体诱导的Raw 264.7细胞促炎性细胞因子和NO的上调过程[19]。另外,Lu等的研究也显示巨噬细胞受到鸡毒支原体的感染会诱发其自噬的发生[20]。
本研究分别以绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw 264.7构建Mo感染的细胞模型,通过对Mo和细胞进行标记,发现荧光标记的Mo在两种细胞中具有相同的细胞定位。蛋白质组学或RT-qPCR对两种细胞感染Mo后免疫防御功能相关分子表达变化进行检测。结果表明在Toll样受体信号通路、MAPK信号通路等的研究中,两种细胞的部分蛋白或基因的相对表达变化基本一致,但也有少数基因,如ERK1/2、TGF-β、PKC、CD36具有细微差异,猜想可能与细胞本身或者细胞的转录翻译调控有关,具体造成差异的原因需要进一步探究。本研究提示使用Raw 264.7细胞系替代绵羊原代巨噬细胞用于研究Mo对巨噬细胞Toll样受体信号通路、MAPK信号通路及ECM作用的调控机制具有一定的可行性,但二者与Mo的其他互作机制差异则需要进一步的试验来探究。
参考文献:
[1]CARMICHAEL L E,ST GEORGE T D,SULLIVAN N D,et al.Isolation, propagation, and characterization studies of an ovineMycoplasma responsible for proliferative interstitial pneumonia[J].The Cornell Veterinarian,1972,62(4): 654-679.
[2]BESSER T E,FRANCES CASSIRER E,HIGHLAND M A,et al.Bighorn sheep pneumonia: Sorting out the cause of a polymicrobialdisease [J]. Preventive Veterinary Medicine,2013,108(2/3):85-93.
[3]BESSER T E,CASSIRER E F,POTTER K A, et al. Epizooticpneumonia of Bighorn sheep following experimental exposure toMycoplasma ovipneumoniae [J]. PLoS One,2014,9(10): e110039.
[4]ABDEL HALIUM M M, SALIB F A,MAROUF S A, et al. Isolationand molecular characterization of Mycoplasma spp. in sheep and goatsin Egypt [J]. Veterinary World,2019,12(5):664-670.
[5]STIPKOVITS L,BELAK S,PALFI V,et al. Isolation of Mycoplasmaovipneumoniae from sheep with pneumonia[J]. Acta Vet Acad SciHung,1975,25(2-3):267-273.
[6]王華.杨发龙.王永.等.山羊支原体性肺炎流行病学调查[J].中国畜牧兽医,2011,38(1):210-214.
WANG H, YANG F L,WANG Y, et al. Epidemiological investigationof caprine Mycoplasma pneumoniae in Sichuan Province [J]. ChinaAnimal Husbandry & Veterinary Medicine, 2011, 38(1):210-214.(in Chinese)
[7]GONCALVES R, MARIANO I. NUNEZ A. et al. Atypical non-progressive pneumonia in goats [J]. The Veterinary Journal, 2010,183(2):219-221.
[8]ELLIOTT M R,KOSTER K M, MURPHY P S. Efferocytosissignaling in the regulation of macrophage inflammatory responses [J].The Journal of Immunology, 2017,198(4):1387-1394.
[9]NIANG M. ROSENBUSCH R F, LOPEZ-VIRELLA J, et al.Expression of functions by normal sheep alveolar macrophages andtheir alteration by interaction with Mycoplasma ovipneumoniae [J].Veterinary Microbiology,1997,58(1):31-43.
[10]LUO H X. WU X X, XU Z K, et al. NOD2/c-Jun NH2-terminal kinasetriggers Mycoplasma ovipneumoniae-induced macrophage autophagy[J]. Journal of Bacteriology,2020, 202(20).DOI:10.1128/jb.00689-19.
[11]LI G,FAN L P, WANG Y Q, et al. High co-expression of TNF-α andCARDS toxin is a good predictor for refractory Mycoplasmapneumoniae pneumonia [J]. Molecular Medicine,2019,25:38.
[12]JIANG F, HE J Y,NAVARRO-ALVAREZ N, et al. Elongation factorTu and heat shock protein 70 are membrane-associated proteins fromMycoplasma ovipneumoniae capable of inducing strong immuneresponse in mice [J]. PLoS One, 2016,11(8): e0161170.
[13]YANG M Y,MENG F Z,GAO M, et al. Cytokine signatures associatewith disease severity in children with Mycoplasma pneumoniaepneumonia [J]. Scientific Reports,2019,9:17853.
[14]MARINARO M, GRECO G, TARSITANO E, et al. Changes inperipheral blood leucocytes of sheep experimentally infected withMycoplasma agalactiae [J]. Veterinary Microbiology, 2015,175(2/3/4):257-264.
[15]BAO J,WU Z, ISHFAQ M, et al. Comparison of experimentalinfection of normal and immunosuppressed chickens with Mycoplasmagallisepticum[J]. Journal of Comparative Pathology,2020,175:5-12.
[16]LI X, ZHANG Y K, YIN B, et al. Toll-like receptor 2(TLR2) andTLR4 mediate the Iga immune response induced by Mycoplasmahyopneumoniae [J]. Infection and Immunity,2019, 88(1).DOI:10.1128/iai.00697-19.
[17]NAGHIB M,HATAM-JAHROMI M,NIKTAB M,et al. Mycoplasmapneumoniae and toll-like receptors: a mutual avenue [J]. Allergologiaet Immunopathologia,2018, 46(5):508-513.
[18]ZHANG Y Y,MEl S F,ZHOU Y L, et al. TIPE2 negatively regulatesMycoplasma pneumonia-triggered immune response via MAPKsignaling pathway [J]. Scientific Reports,2017,7:13319.
[19]HWANG M H, DAMTE D, LEE J S,et al. Mycoplasmahyopneumoniae induces pro-inflammatory cytokine and nitric oxideproduction through NFκB and MAPK pathways in RAW264.7 cells[J].Veterinary Research Communications,2011,35(1):21-34.
[20]LU Z Y, XIE D Y,CHEN Y, et al. TLR2 mediates autophagy throughERK signaling pathway in Mycoplasma gallisepticum-infectedRAW264.7 cells [J]. Molecular Immunology,2017,87:161-170.
(责任编辑 :张梅)
张颖,张凯,马金成,等.绵羊肺炎支原体感染对绵羊肺泡巨噬细胞和小鼠巨噬细胞Raw 264.7蛋白质组的影响[J].福建农业学报,2020,35(11):1244-1251.
ZHANG Y. ZHANG K. MA J,et al. Proteomes of Sheep Alveolar and Mouse Macrophages Infected by Mycoplasma ovipneumoniae [J]. FujianJournal of Agricultural Sciences,2020,35(11):1244-1251.
收稿日期:2020-06-12初稿:2020-09-04修改稿
作者简介:张颖(1996-),女,硕士研究生,研究方向:细胞生物学(E-mail: 1776244258@qq.com)
*通信作者:高力扬(1981-),女,博士,讲师,研究方向:细胞生物学(E-mail:pandarun@nxu.edu.cn)
基金項目:国家自然科学基金项目(31960036、31460039);教育部“春晖计划”国际合作项目(NXU201802)

