不同麦秸还田模式对稻田土壤微生物活性和微生物群落组成的影响
王 宁,罗佳琳,2,赵亚慧,李 勇,于建光,2,4*
(1.江苏省农业科学院农业资源与环境研究所,南京 210014;2.南京农业大学资源与环境科学学院,南京 210014;3.江苏省常州市金坛区土壤肥料技术指导站,江苏常州 213200;4.农业农村部江苏耕地保育科学观测实验站,南京 210014)
在长江中下游地区,稻麦轮作作为典型的种植模式在保障主要粮食供应上起着重要的作用,但由于小麦收获后秸秆产生量大以及茬口时间短、季节紧,秸秆还田作为一种直接有效的秸秆处置措施被广泛采用。秸秆还田不仅能够改善土壤结构、增加土壤养分和提高作物产量[1-3],而且对土壤微生物也有着重要的影响[4-5]。
微生物量碳氮和酶活性作为土壤微生物活性的重要指标,是土壤养分转化和有机质分解的关键因子,常被用于评价土壤质量的生物学特性[6-9]。近年来,利用土壤微生物活性指标的变化来评价麦秸还田对稻田土壤生态学效应的研究相对较多。研究发现,秸秆还田对稻田土壤微生物活性的影响与秸秆还田方式、土壤性质等多种环境因子密切相关[10-12],因此,合理的秸秆还田技术能够有效地改善土壤微生物活性进而提升土壤肥力。然而,由于目前土壤环境的复杂性,使得对于典型稻麦轮作区大田试验条件下不同小麦秸秆还田模式对稻田土壤微生物活性的影响效应仍不够明确。
细菌是土壤微生物的重要组成部分,直接影响土壤物质循环和养分转化等[13-14]。然而由于土壤中大部分细菌很难分离培养,采用传统的土壤微生物研究方法如微生物平板培养法、变性梯度凝胶电泳(DG⁃GE)等通常无法详细描述出土壤微生物的群落多样性和组成方面的信息[15-17],使得对于土壤细菌生物多样性的研究仍然匮乏,有关其演替规律仍不清楚。近年来兴起的现代分子生物学技术如高通量测序技术等[13-14],为深入探究土壤微生物群落组成、功能及其适应机制提供了良好的契机。已有研究表明,不同微生物在秸秆降解过程中起着不同的作用,例如,在秸秆降解初期细菌起主要作用[18-19],而且秸秆还田显著增加拟杆菌门(Bacteroidetes)、β-变形菌门(Betapro⁃teobacteria)和芽单胞菌门(Gemmatimonadetes)丰度,从而改变土壤细菌群落[20-21]。然而目前关于典型稻麦轮作区大田试验条件下稻田土壤细菌群落组成对秸秆还田的响应仍不够清晰。
因此,本试验拟通过研究长江下游典型稻麦轮作区不同小麦秸秆还田模式对土壤微生物活性和微生物群落组成的影响,为寻求良好的土壤微生物生态环境提供理论和实践依据。
1 材料与方法
1.1 试验地概况
试验于2017年6月至11月在江苏省常州市金坛区薛埠镇罗村稻麦轮作试验田进行。该试验田0~20 cm土壤的理化状况为:pH值5.81、碱解氮51.3 mg·kg-1、速效磷12.2 mg·kg-1、速效钾190 mg·kg-1、有机质23.7 g·kg-1。
1.2 试验设计与田间管理
试验采用随机区组排列,设置四种处理,分别为对照(Control)、麦秸直接还田(S)、麦秸与氮肥配施还田(SN)、麦秸泡田还田(SP),每个处理三个重复。每个小区面积为2000~3000 m2,小区之间以自然田埂或筑埂分隔。试验前先将上季的小麦收获,留茬10 cm左右,然后通过收割机将小麦秸秆粉粹,长度约5~10 cm。待秸秆均匀抛撒后采用常规旋耕还田,深度为10~12 cm,上水泡田若干天后移栽稻秧苗,品种为武运粳23号,11月1日收获。各处理施肥和泡田具体管理情况见表1,其中Control、S和SP处理下氮、磷、钾肥总施用量分别为270、37.5、71.25 kg·hm-2;SN处理下氮肥用量增加到330 kg·hm-2,磷肥和钾肥施用量保持不变。基肥在泡田、整地前施;分蘖肥在插秧后7~10 d施;穗肥在倒三叶期(8月上旬)叶色褪淡时施。除草、病虫害防治等按照当地常规管理。
1.3 取样测定方法
在水稻成熟期(2017-11-01),采用五点取样法在各试验小区采集深度为0~20 cm的土壤样品。所有土壤样品挑除动植物杂体后混匀,分为三部分:一部分风干后用于土壤性质和土壤酶活性的测定,一部分鲜样保存于4℃冰箱用于土壤微生物量碳氮的测定,最后一部分鲜样保存于-20℃冰箱用于细菌群落结构分析。
土壤pH值采用酸度计(pHs-3C型精密pH计,上海雷磁仪器厂)测定(土∶水=1∶5);土壤电导率(EC)采用电导仪(DDSJ-318型电导率仪,上海雷磁仪器厂)测定;土壤总有机碳(TOC)采用重铬酸钾外加热法[22];土壤溶解性有机碳(DOC)采用有机碳分析仪(Shimadzu TOC-Vcph,Japan)测定(土∶水=1∶5);土壤全氮(TN)采用半微量开氏法[22];碱解氮(AN)采用碱解扩散法[22];有效磷(AP)采用钼锑抗比色法[22];速效钾(AK)采用火焰光度计比色法[22];土壤过氧化氢酶(Catalase)采用高锰酸钾滴定法[23];多酚氧化酶(Poly⁃phenol oxidase,PPO)采用邻苯二酚比色法[23];酸性磷酸酶(Acid phosphatase,ACP)采用对硝基苯磷酸二钠比色法[23];蔗糖酶(Invertase)采用二硝基水杨酸比色法[23];脲酶(Urease)采用靛酚比色法[23];微生物量碳氮(MBC、MBN)采用氯仿熏蒸浸提法[24]。
根据FastDNA®Spin Kit for Soil试剂盒说明书提取土壤微生物总DNA,所获得的DNA送至上海美吉生物有限公司,用于Illumina Miseq测序,细菌群落组成高通量测序所用引物为515F(5′-GTGCCAGC⁃MGCCGCGG-3′)和 907R(5′-CCGTCAATTC⁃MTTTRAGTTT–3′)[25]。
1.4 数据处理
高通量测序所得原始序列首先经拼接和过滤后去除含错误接头、漏测核苷酸(N)或者连续出现10次以上碱基的序列;再次过滤低质量的序列(含20个以上低质量的碱基),并去除引物。所得的序列随后在I-Sanger云平台进行分析,流程主要包括:参照绿色基因数据库(Greengenes database,2011版)在97%的相似度水平划分序列的OTU;挑选代表的OTU用RDP分类;去除含嵌合体的OTU归类为叶绿体或线粒体的OTU以及只出现一次的OTU;在不同的分类水平上将具有相同归属的OTU合并;将所有样品的序列数校正到样品中出现的最低序列数,并在此基础上做系数分析,计算物种群落组成、物种差异性分析和β多样性。其中β多样性是指根据样品两两间bray-curtis做非度量多维尺度分析(NMDS),用于表征样品之间基于一些OTU存在与否的细菌群落的相似性。测序数据图形绘制均在I-Sanger云平台上完成。
所得数据采用Excel 2007和SPSS 23.0软件进行处理与统计分析,图形绘制采用SigmaPlot 10.0。
2 结果与分析
2.1 土壤理化性质
不同麦秸还田模式下,稻田土壤部分理化性质的变化见表2。由表2可以看出,与未施用麦秸的对照土壤相比,S处理稻田土壤pH、TOC和AK含量都有上升趋势,土壤EC和TN则呈现下降趋势,但影响效应并不显著(P>0.05),而稻田土壤中AP含量则显著提高,AN含量显著降低(P<0.05)。三种麦秸还田模式下,稻田土壤中pH、TOC、DOC、AK、EC和TN并无显著变化。与S处理相比,SN处理显著提高了土壤中AN含量,并显著降低了稻田土壤中AP的含量,而与对照土壤相比,SN处理显著提高了土壤中DOC含量;SP处理与S处理相比仅显著降低了土壤中AP含量,而对其他性质无显著影响。以上研究结果表明,麦秸还田主要显著改变了土壤中易被微生物可利用的碳、氮、磷的含量如DOC、AN和AP,而对土壤中pH、EC、TOC、TN和AK则无显著影响。

表1 不同麦秸还田模式下稻田施肥和泡田管理情况Table 1 Fertilization and ponding treatments in paddy soils with different straw returning
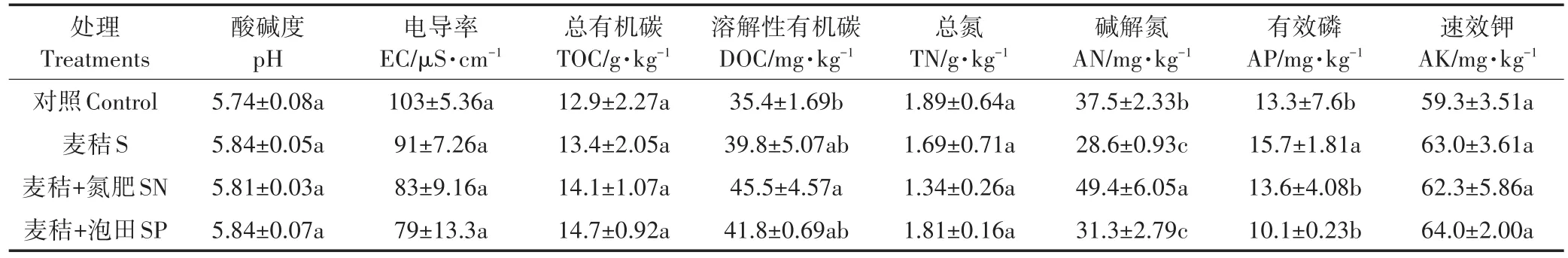
表2 不同麦秸还田模式下稻田土壤理化性质的变化Table 2 Soil properties in paddy soils with different straw returning
2.2 土壤微生物量碳和微生物量氮
不同麦秸还田模式下稻田土壤MBC和MBN含量,以及计算的MBC/MBN见图1。由图1可以看出,与对照土壤相比,三种麦秸还田模式下稻田土壤MBC含量由249 μg·g-1升高到257~282 µg·g-1,但其升高效应并不显著(P>0.05);而土壤中MBN则是由16.9µg·g-1显著提高到24.6~31.3µg·g-1(P<0.05),提高了45.6%~85.2%,其中SN处理下土壤中MBN含量最高。基于MBC和MBN结果,还发现麦秸还田下MBC/MBN由14.9显著降低到8.58~10.7(P<0.05),其中SN处理下土壤中MBC/MBN最低。以上研究结果表明,麦秸还田提高了稻田土壤中MBC和MBN含量,并显著降低了土壤中MBC/MBN比值。
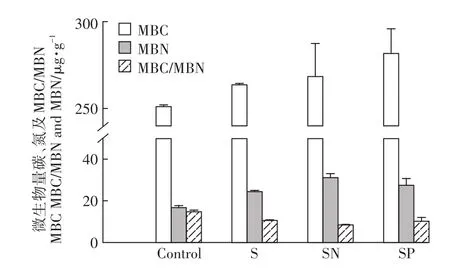
图1 不同麦秸还田模式下稻田土壤微生物量碳、氮含量以及微生物量碳氮比的变化Figure 1 Concentration in microbial biomass carbon(MBC)and nitrogen(MBN),and MBC/MBNin paddy soils with different straw returning
2.3 土壤酶活性
不同麦秸还田模式下稻田土壤的过氧化氢酶、多酚氧化酶、酸性磷酸酶、蔗糖酶以及脲酶活性见图2。由图2可知,与对照土壤相比,三种麦秸处理模式下,S和SN处理稻田土壤中过氧化氢酶活性由0.92 mL·g-1显著增加到 1.12 mL·g-1和 1.06 mL·g-1,增加了15.2%~21.7%,而SP处理土壤中过氧化氢酶则无明显变化;S和SN处理稻田土壤中蔗糖酶活性无显著变化,而SP处理土壤中蔗糖酶活性由对照的10.5 mg·d-1·g-1显著提高到 17.1 mg·d-1·g-1,增加了61.9%;三种麦秸处理模式下稻田土壤中多酚氧化酶活性由对照的16.7 µmol·g-1·h-1显著提高到 23.5、24.8 µmol·g-1·h-1和21.5 µmol·g-1·h-1,分别提高了40.5%、48.1%和28.7%;三种麦秸处理模式对稻田土壤中酸性磷酸酶活性无显著性影响。此外,S和SP处理下稻田土壤中脲酶活性由对照71.0 mg·d-1·g-1降低到54.8 mg·d-1·g-1和60.5 mg·d-1·g-1,显著降低了22.8%和14.8%,而SN处理下土壤中脲酶活性增加了9.86%,但其增加效应并不显著。以上结果表明,麦秸还田主要显著提高了稻田土壤中多酚氧化酶活性,但对于酸性磷酸酶活性则无显著影响,而稻田土壤中过氧化氢酶、蔗糖酶和脲酶活性的变化在不同麦秸还田模式下不同。
2.4 土壤细菌群落组成
利用Illumina高通量测序技术,对12个不同麦秸还田模式下稻田土壤样品按照97%相似性对非重复序列(不含单序列)进行OTU聚类。不同麦秸还田模式下,稻田土壤的细菌群落组成见图3。由图3可以看出,未施用麦秸的对照稻田土壤优势细菌为绿弯菌门(Chloroflexi,25.5%)、放线菌门(Actinobacteria,24.1%)、变形菌门(Proteobacteria,18.2%)、酸杆菌门(Acidobacteria,10.1%)和 厚 壁 菌 门(Fimicutes,8.35%)。
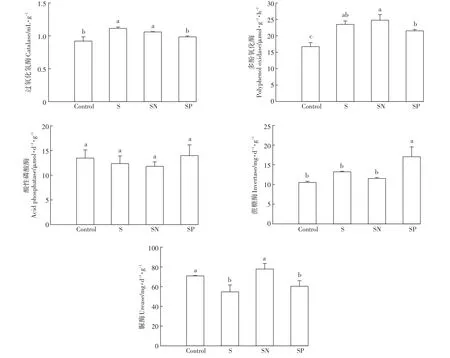
图2 不同麦秸还田模式下稻田土壤酶活性Figure 2 Soil enzyme activity in paddy soils with different straw returning
与对照土壤相比,麦秸还田处理对稻田土壤中主要优势菌门丰度的影响见图4。由图4可知,麦秸还田条件下稻田土壤中优势菌变形菌门(Proteobacte⁃ria)的丰度由18.2%提高至20.7%,而其他优势菌门并无显著变化。研究还发现,不同麦秸还田模式之间土壤中优势菌门并无显著差异(图3)。以上结果表明,麦秸还田显著提高了稻田土壤中变形菌门(Pro⁃teobacteria)的相对丰度,但对其他优势菌门相对丰度并无显著影响,且不同麦秸还田模式之间稻田土壤中优势菌门相对丰度也无显著差异。
为了进一步探究麦秸还田对土壤中细菌群落组成的影响,我们对不同麦秸还田模式下土壤中细菌群落组成进行了非度量多维尺度分析(NMDS)(图5)。结果显示,与对照土壤相比,S和SN处理下土壤中细菌群落组成有一定的迁移;SP和对照之间细菌群落组成正好重合。以上结果表明,麦秸直接还田和麦秸与氮肥配施还田改变了土壤中细菌群落组成,但麦秸泡田还田并未改变土壤中细菌群落组成。
3 讨论
土壤微生物量碳氮是土壤微生物躯体中所固定的碳素和氮素,是土壤养分的储存库。已有研究表明,秸秆覆盖还田能够显著提高土壤微生物量碳氮含量[11]。本研究也发现麦秸还田下稻田土壤中微生物量碳含量有上升趋势,同时微生物量氮含量显著提高。这很可能是由于秸秆还田提高了土壤中DOC含量,为微生物生长和繁殖提供了大量碳源,从而提高了土壤微生物量。土壤微生物生长不仅受碳源的影响,氮肥的调控也会影响土壤微生物的量[26]。当秸秆与氮肥配施还田时,氮肥施用为微生物生长提供了较多的氮源,刺激了微生物的生长[26],因此麦秸与氮肥配施还田下土壤中微生物量氮含量最高。
已有研究表明,秸秆还田条件下,土壤微生物量的增加能够促进土壤酶内在的分泌物数量,从而提高土壤酶活性,而土壤酶能够催化土壤中的生物化学反应,对土壤肥力有着重要的影响[27]。本研究也发现麦秸还田显著提高了土壤中多酚氧化酶活性。氧化还原酶在土壤转化过程中有很重要的作用,其中多酚氧化酶与土壤有机质的形成有关,是腐殖化的一种媒介[28]。麦秸还田条件下多酚氧化酶活性的提高很可能主要是有效促进秸秆腐质化,从而提高土壤有机质含量。而磷酸酶活性主要参与土壤中磷素的转化,本研究发现三种麦秸还田模式下土壤有效磷含量并无显著变化,因此三种麦秸还田对土壤磷酸酶活性也无显著影响。此外,稻田土壤中过氧化氢酶、蔗糖酶和脲酶活性对不同麦秸还田模式响应有所差异。过氧化氢酶活性从某方面反映了加入到土壤中的秸秆的分解状况,与土壤有机碳的转化有关[29]。与麦秸泡田还田相比,麦秸直接还田和麦秸与氮肥配施还田时,泡田时间较短情况下,土壤中含氧量较高易于好氧微生物生长,而泡田时间延长的情况下土壤中含氧量逐渐降低,形成一定的厌氧环境,厌氧微生物量逐渐增多,其对秸秆的分解程度通常不如好氧微生物彻底。因此秸秆分解较快的麦秸直接还田和麦秸与氮肥配施还田下土壤过氧化氢酶活性更高。而蔗糖酶活性在麦秸泡田还田处理下较高,很可能是因为厌氧条件下,有机质分解不够彻底,释放出较多蔗糖,因此需要较高的蔗糖酶来进一步分解成更小分子有机碳。脲酶活性主要是与土壤中氮的供给与利用情况密切相关[29]。本研究发现麦秸还田显著提高了土壤中溶解性有机碳含量,而微生物对土壤中C、N的利用有一定的比例范围,一旦C/N比值变大,势必引起微生物对N源的争夺利用,麦秸直接还田和麦秸泡田还田下随着秸秆的施入,土壤中碱解氮含量显著降低(37.5 mg·kg-1vs28.6~31.3 mg·kg-1),造成土壤氮缺乏[30],从而降低脲酶活性。而麦秸与氮肥配施还田随着氮肥施用量的增大增加了土壤中碱解氮含量(49.4 mg·kg-1),因此脲酶活性则又有所提高。
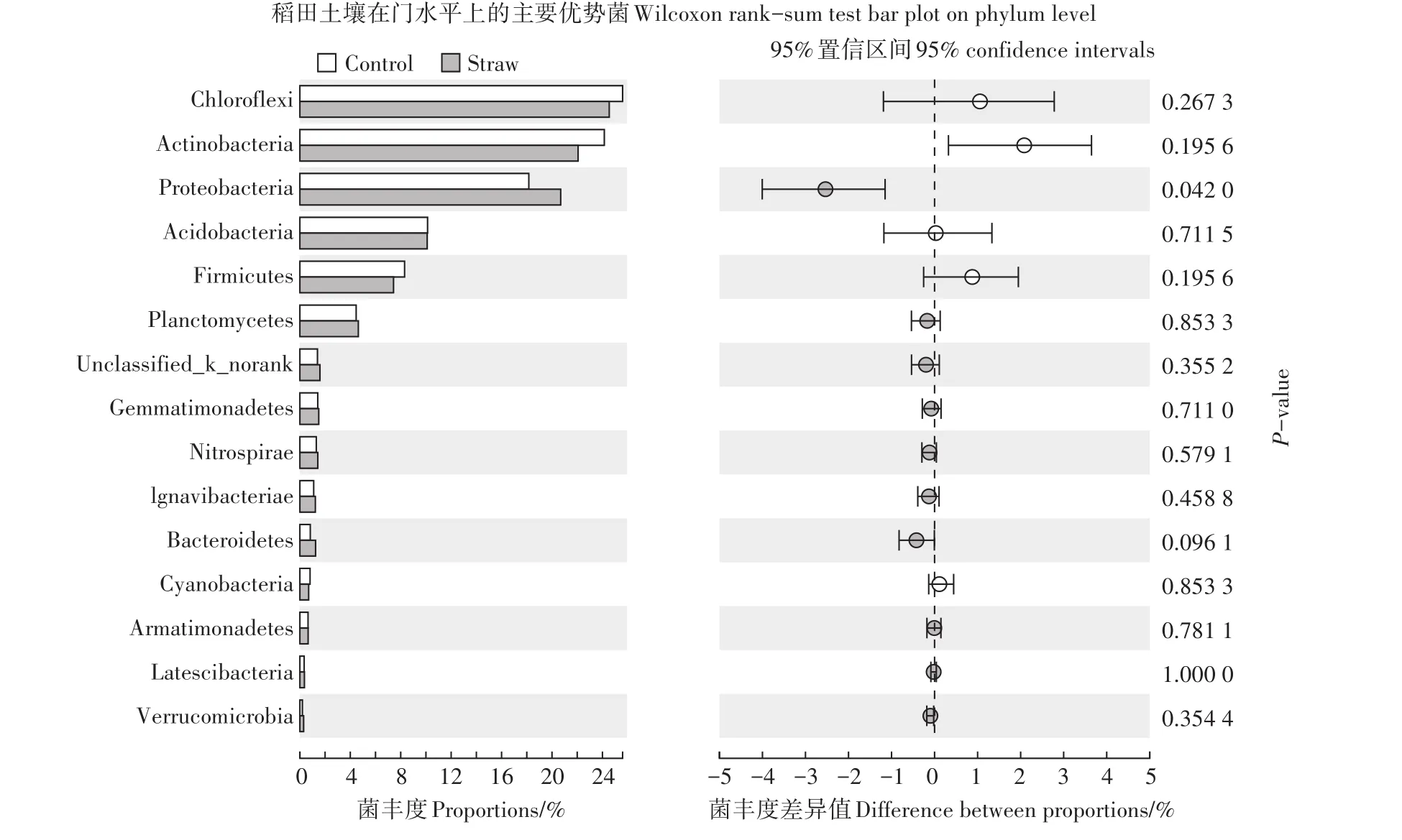
图4 麦秸还田对稻田土壤在门水平上的主要优势菌丰度的影响Figure 4 Class distribution of bacterial community in soils with different straw returning
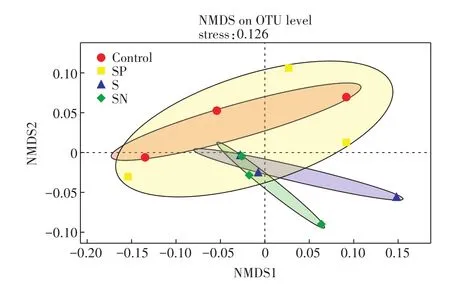
图5 不同麦秸还田模式下稻田土壤在OTU水平上细菌群落组成的β多样性Figure 5β-diversity of bacterial community at OTUlevel in soils with different straw returning
土壤微生物生物量碳氮比经常被用于描述微生物的群落结构信息[31]。一般来说,细菌的C/N比值在3~6之间,而真菌的C/N比值在7~12之间[32]。本研究中土壤微生物生物量碳氮的比值一直较大,维持在8~15(图1),说明该土壤中真菌数量比较高,而秸秆还田后,土壤微生物生物量碳氮比有所降低,很可能是由于秸秆还田后土壤pH的升高更利于细菌生长[11,33]。细菌作为微生物重要组成部分之一,在稻田土壤碳氮元素转化过程中的作用不可忽视。已有研究表明秸秆还田能够显著改变土壤细菌群落[20],并能显著增加拟杆菌门(Bacteroidetes)、β-变形菌门(Be⁃taproteobacteria)和芽单胞菌门(Gemmatimonadetes)丰度[21]。本研究发现麦秸还田显著增加了稻田土壤中变形菌门(Proteobacteria)的相对丰度,而细菌群落的迁移在不同麦秸还田模式下响应明显不同。土壤细菌群落组成仅在麦秸直接还田和麦秸与氮肥配施还田处理中有一定迁移,而麦秸泡田还田处理下细菌群落组成并无变化,这很可能是由于不同麦秸还田模式下土壤性质变化不同,而土壤性质是调控土壤微生物群落结构的重要因子[14]。
4 结论
(1)三种麦秸还田模式均提高了稻田土壤微生物量碳氮含量,并显著降低了微生物量碳氮比。
(2)麦秸还田显著提高了稻田土壤中多酚氧化酶活性,但对酸性磷酸酶活性无显著影响;而稻田土壤中过氧化氢酶、蔗糖酶和脲酶活性的变化与其麦秸还田模式紧密相关。
(3)麦秸还田显著提高了稻田土壤中变形菌门(Proteobacteria)的相对丰度,其中麦秸直接还田和麦秸与氮肥配施还田改变了土壤中细菌群落组成,而麦秸泡田还田并未改变土壤中细菌群落组成。

