八元瓜环与常山碱的相互作用模式
蒋 静, 陈晓丽, 黄亚励, 张奇龙,, 徐 红, 杨小生
(1. 贵州医科大学药用植物功效与利用国家重点实验室;2. 公共卫生学院环境污染与疾病监控教育部重点实验室; 3. 基础医学院, 贵阳 550025)
Scheme 1 Structures of host Q[8](A) and guest β-dichroine(B)
常山碱又名退热碱(febrifugine)、β-常山碱(β-dichroine)和常山乙素(结构见Scheme 1), 是从中药常山(DichroafebrifugaLour.)中分离出来的一种喹唑酮类生物碱单体成分, 相对分子质量为301, 分子式为C16H19O3N3, 是中药常山发挥药理作用的主要物质基础, 为中医治疟药常山中的有效成分[1]. 常山为虎耳草科植物, 其根、 茎、 叶均有药用价值, 根可治疟疾, 叶和果可消气, 果可用作调料及药膳[2]. 常山中主要含有α,β和γ(甲、 乙和丙)3种常山碱, 三者互为异构体, 在酸性、 碱性及加热条件下不稳定, 易发生异构化改变[3,4]. 常山碱对间日疟或恶性疟疾有疗效, 常山总生物碱的抗疟效价约为奎宁(临床抗疟药)的26倍,α-,β-和γ-常山碱对疟疾的疗效分别为奎宁的1, 100和150倍. 研究发现, 常山碱及其衍生物具有良好的抗肿瘤、 增强免疫、 促进伤口愈合及治疗糖尿病等作用[5~9].
虽然, 常山在医药领域具有广阔的应用前景, 但其主要活性成分常山碱存在使人恶心及呕吐等副作用[10], 因其毒副作用较大, 中药常山在《中华人民共和国药典》(2005年版一部)中被列为有毒药材[11].临床上常用常山复方口服治疗疟疾(单用胃肠反应大), 可减低副作用反应, 虽生效快但停药后易复发, 并且会增加复方中其它药物的摄入, 药物配方安全性有待考量. 目前, 对于常山碱引起的胃肠道毒性机制的相关实验研究较少, 限制了常山药物的发展. 因此, 寻找能够减轻常山碱恶心、 呕吐等胃肠反应副作用的方法对于常山碱的进一步临床应用具有重要意义.
瓜环(Q[n]s,n=5~8, 10, 14)是由苷脲单元通过亚甲基桥联起来的高度对称的桶状大环主体分子, 具有两端开口的空腔, 两端口大小相同, 端口直径小于空腔直径, 具有特殊的内亲水、 外疏水分子结构[12~14]. 多种无机或有机分子可与瓜环端口及空腔通过笼体作用、 氢键、 范德华力及离子偶极等非键弱相互作用力形成稳定的主-客体包结配合物(Ka=104~1015L/mol), 与环糊精和杯芳烃相比, 瓜环具有更强的络合作用和更高的空间定位效应, 能形成较稳定的包合物, 具有较好的分子识别功能[15]. 瓜环作为新一代的人工合成主体化合物, 在各种细胞和动物实验中均表现出极低的毒性, 是一种安全的药物载体[16~19], 并且能与多种药物分子形成稳定的主客体包合物, 其包结作用会对客体分子的一系列性质(如溶解性、 稳定性、 生物活性、 荧光光谱及电化学性质等)产生影响, 使客体分子物理化学性质均可能发生改变, 所以瓜环在药物化学和生命科学领域应用广泛[20~22]. 本文利用紫外吸收光谱、 核磁共振氢谱及红外光谱等方法考察了八元瓜环(Q[8])与常山碱(Feb)的相互作用, 并研究了形成包合物后Q[8]对Feb理化性质的影响, 为常山碱的进一步临床应用提供了研究思路和借鉴.
1 实验部分
1.1 试剂与仪器
八元瓜环(Q[8]), 纯度97%, 贵州省大环化学及超分子化学重点实验室提供; 常山碱(Feb), 纯度≥98%, 四川省维克奇生物科技有限公司; 实验用水均为二次蒸馏水; 溴化钾(KBr)、 磷酸二氢钾(KH2PO4)、 氢氧化钠(NaOH)和盐酸(HCl)等均为分析纯, 重庆川东化工集团.
UV-2600型紫外-可见分光光度(UV-Vis)计, 日本岛津公司; Inova-400 MHz型核磁共振波谱(NMR)仪, 美国Varian公司; VGT-2227QTD型超声仪, 深圳市固特宏业机械设备有限公司; CP214型电子天平, 上海奥豪斯仪器有限公司; VERTEX70型傅里叶变换红外光谱(FTIR)仪, 德国Bruker公司; RE-52A型旋转蒸发器, 上海亚荣生化仪器厂; pH S-25型酸度计, 成都世纪方舟科技有限公司; MD3型生物透析袋, 北京Solarbio科技有限公司; 1.0 mL/5.0 mL移液枪, 德国Eppendorf公司.
1.2 实验过程
1.2.1 不同pH条件下Q[8]与Feb相互作用的紫外吸收光谱测定 先配制浓度为100 μmol/L的Feb水溶液, 分别移取2.0 mL Feb水溶液置于7个10.0 mL标定过的容量瓶中, 分别加入pH=0, 1.0, 2.0, 3.0, 4.0, 5.0和6.0的稀HCl溶液各1.0 mL, 用蒸馏水定容至10.0 mL, 即调节pH值至1.0, 2.0, 3.0, 4.0, 5.0, 6.0和7.0, 配好后立即分别测定其紫外吸收光谱. 用蒸馏水分别配制浓度为100 μmol/L的Q[8]溶液和Feb溶液, 分别量取2.0 mL Q[8]溶液和Feb溶液置于10.0 mL标定过的容量瓶中, 分别加入pH=0, 1.0, 2.0, 3.0, 4.0, 5.0和6.0的HCl溶液各1.0 mL, 用蒸馏水定容至10.0 mL, 即调节pH值至1.0, 2.0, 3.0, 4.0, 5.0, 6.0和7.0, 配好后立即分别测定其紫外吸收光谱. 由上述实验结果可知, Q[8]与Feb在pH=1.2时的相互作用力较强, 由于pH=1.2是后续考察药物释放的生理模拟实验条件, 因此选择pH=1.2作为实验pH值条件. 因此, 分别用蒸馏水配制浓度为100 μmol/L的Q[8]溶液(pH=1.2)和Feb溶液(pH=1.2)作为储备液.
1.2.2 pH=1.2时Q[8]与Feb相互作用的紫外吸收光谱测定 采用摩尔比法和等摩尔连续变化法(Job法)法分别测定溶液的紫外吸收光谱. 摩尔比法, 即固定客体的浓度, 改变瓜环的浓度配制不同摩尔比的主客体溶液. 向标定过的10.0 mL容量瓶中分别加入2.0 mL 100 μmol/L Feb溶液, 配制Q[8]与Feb摩尔比分别为0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.5, 2, 2.5, 3.0和3.5的混合溶液, 用pH=1.2的盐酸溶液定容. Job法, 即固定客体的浓度或保持客体和主体的总浓度(100 μmol/L)不变, 改变Q[8]的浓度配制Q[8]/Feb摩尔比分别为0, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9和1.0的溶液. 溶液配好后立即于室温下测定其紫外吸收光谱.
1.2.3 pH=1.2时Q[8]与Feb相互作用的荧光光谱测定 采用摩尔比法和Job法配制溶液, 立即于室温测定其荧光光谱, 激发狭缝和发射狭缝宽度均为5 nm, 激发波长230 nm, 发射波长340 nm.
1.2.4 Q[8]与Feb相互作用的1H NMR测定 在V(DCl)∶V(D2O)=1∶99条件下, 以D2O溶液作为溶剂溶解Q[8]和Feb, 固定客体的量, 向体系中逐渐加入Q[8], 于25 ℃测定体系的1H NMR.
1.2.5 Q[8]/Feb固体包合物的制备 按照n(Q[8])∶n(Feb)=1∶1称取Q[8]和Feb, 加入100.0 mL pH=1.2的盐酸溶液, 室温下超声3 h, 反应结束后过滤除去不溶性沉淀, 得到无色澄清透明滤液, 将滤液于60 ℃下旋转浓缩后烘干, 即得包合物固体.
1.2.6 红外光谱的测定 分别称取一定量的Feb, Q[8], Q[8]/Feb(摩尔比1∶1)物理混合物和Q[8]/Feb包合物, 加入KBr并压片, 测定其红外光谱, 扫描范围为4000~500 cm-1.
1.2.7 不同pH值下Q[8]/Feb包合物中Feb的释放 配制浓度为100 μmol/L的Q[8]水溶液(pH=1.2)和Feb水溶液(pH=1.2)作为储备液. 分别量取上述溶液各15.0 mL混合于50 mL烧杯中, 放置10 min形成稳定的Q[8]/Feb包合物溶液后, 用12 mol/L的NaOH溶液依次调节pH值至2.0, 3.0, 4.0, 5.0, 6.0和6.8, 于室温下立即测定溶液的紫外吸收光谱.
1.2.8 Q[8]/Feb固体包合物在人工胃肠液中的缓释测定 参照中国药典2015年版二部[23], 采用恒温振荡法测定Q[8]/Feb固体包合物在人工胃肠液中的体外释放行为. 分别称取包合物5.0 mg置于透析袋内, 扎紧袋口后置于盛有80.0 mL人工胃液(pH=1.2的盐酸水溶液)或人工肠液(pH=6.8的磷酸盐缓冲液)的圆底烧瓶中, 于(37±0.5) ℃恒温振荡器内释放, 转速100 r/min. 分别隔一定时间取样液3.0 mL, 同时向释放体系中补充3.0 mL新鲜人工肠液或人工胃液, 以维持释放体系的体积不变. 释放液样品经0.45 μm滤膜过滤, 于228 nm波长处测定其紫外吸收值, 根据标准曲线计算药物的含量. 药物累积释放率R(%)根据下式计算:
R=[80.0cFeb(n)+3.0∑cFeb(n-1)]/m0×100%
式中:cFeb(n)(mg/mL)为第n次提取时药物在溶液中的浓度;cFeb(n-1)(mg/mL)为第n-1次提取时药物在溶液中的浓度;m0(mg)为药物Feb在包合物中的质量; 80.0(mL)为缓冲溶液的体积; 3.0(mL)为每次取出的溶液体积.
2 结果与讨论
2.1 不同pH条件下Q[8]与Feb相互作用的紫外吸收光谱分析
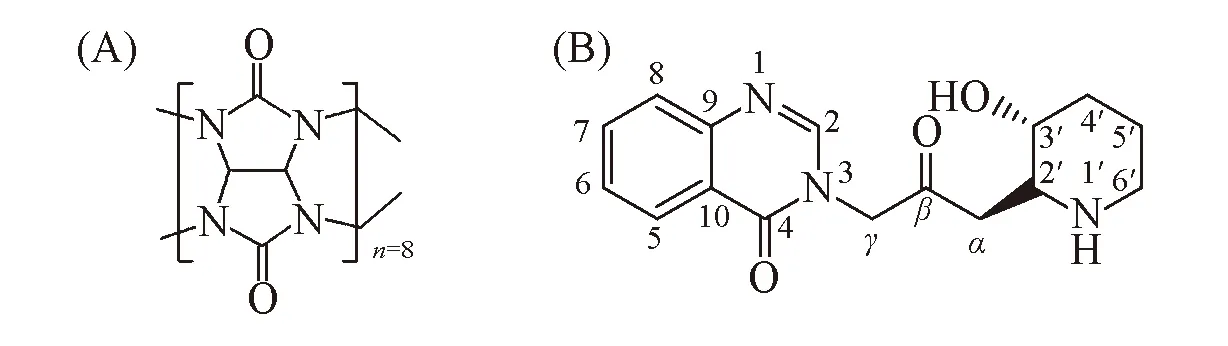
据文献[4]报道, Feb在中性和酸性条件下可稳定存在, 而在碱性条件下则发生降解, 因此考察了pH=1.0~7.0对Feb的存在形态的影响. 由图1可见, 随着pH值的增大, Feb的吸光度值逐渐增大, 当pH值增大到3.0时, 吸光度值基本不再改变, 表明pH值对Feb的溶解度有影响, 即在较强酸性(pH<3.0) 条件下, Feb溶解度略低, pH=3.0~7.0时, 溶解度较高.

Fig.1 UV spectra of Feb(A) and the absorbance intensity plot at 228 nm(B) of Feb at different pH values c(Feb)=20 μmol/L.
考察了不同pH条件下Feb与Q[8]相互作用的紫外吸收光谱变化. 由图2(A)可见, 加入Q[8]溶液后, 随着pH值的改变, 溶液的吸光度值发生变化, 通过与未加Q[8]时的谱图[图2(B)]对比发现, 随着pH值的下降(pH值从4.0至1.0), 紫外吸收光谱强度ΔA(AFeb-AFeb/Q[8])逐渐增大[图2(C)], 说明Feb与Q[8]发生了相互作用, 改变了溶液的吸光度. 在pH=1.0时, ΔA值最大, 说明此条件下Feb与Q[8]的相互作用最强; 而在pH=4.0~7.0时, ΔA值变化不大, 表明Feb与Q[8]相互作用能力较弱. 由于在pH=1.2时Feb与Q[8]相互作用能力较强, 且pH=1.2是人工胃液的生理环境, 也是后续考察药物释放的模拟生理实验条件. 因此, 后续考察Feb与Q[8]相互作用的紫外吸收光谱、 荧光光谱变化以及作用比例时均采用pH=1.2作为实验条件.
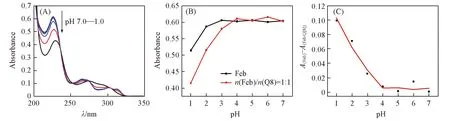
Fig.2 UV spectra of Feb with Q[8] at different pH values(A), trend chart of simple Feb solution and after addition the Q[8](B) and ΔA value(C) of AFeb and AFeb/Q[8] λ=228 nm; c(Feb)=20 μmol/L.
2.2 Q[8]与Feb相互作用的紫外吸收光谱分析
图3为pH=1.2时Feb与Q[8]相互作用的紫外吸收谱图. 在pH=1.2时, Feb在228 nm处有最大吸收峰, Q[8]在大于210 nm波长范围内均无吸收. 随着主体Q[8]浓度的增加, 客体Feb的吸收强度逐渐下降, 说明Q[8]与Feb发生了相互作用. 当二者的摩尔比为1∶1时,A~n(Q[8])/n(Feb)曲线出现转折点, 继续增大瓜环的量吸收强度无明显变化, 说明二者相互作用形成了摩尔比为1∶1的包合物. 同时, Job法在n(Q[8])/[n(Q[8])+n(Feb)]≈0.5时, ΔA出现最大值, 即Q[8]/Feb体系的作用比为1∶1, 这与摩尔比法所得结论一致. 通过非线性拟合得到Q[8]与Feb的结合常数为4.20×104L/mol.

Fig.3 UV spectra(A) and Job’s plot(B) of Feb with Q[8](A) c(Feb)=20 μmol/L; n(Q[8])/n(Feb), a—k: 0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5. Inset of (A): absorption intensity plot at 228 nm of Feb upon addition of increasing concentrations of Q[8].
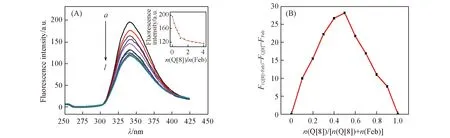
Fig.4 Fluorescence emission spectra(A), and Job’s plot(B) of Feb with Q[8](A) c(Feb)=20 μmol/L; n(Q[8])/n(Feb), a—l: 0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0. Inset of (A): the fluorescence intensity plot at 340 nm of Feb upon addition of increasing concentrations of Q[8].
2.3 Q[8]与Feb相互作用的荧光光谱分析
图4为pH=1.2时, 瓜环Q[8]与客体Feb相互作用的荧光发射光谱图, 在225 nm波长光激发下, Feb的最大荧光发射波长为340 nm. 随着瓜环量的增加, Feb在340 nm波长处的荧光强度逐渐降低, 说明Q[8]与Feb发生了主客体相互作用. 摩尔比法和Job法表明, Q[8]与Feb相互作用的摩尔比为1∶1. 与紫外吸收光谱测试结果一致.
2.4 Q[8]与Feb相互作用的核磁共振氢谱分析
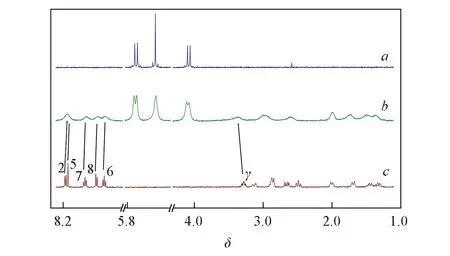
Fig.5 1H NMR spectra of interaction between Q[8] and Feb(pH=1.2) a. Q[8]; b. n(Q[8])/n(Feb)=1∶1; c. Feb.
图5给出了Q[8]与Feb相互作用的1H NMR谱图. 由图5可知, 相对于游离客体Feb, 当向体系中加入Q[8]后, 客体Feb的质子发生了不同程度的化学位移, H2, H7, H8和H6分别向高场移动了δ0.05, 0.03, 0.06和0.03, Hγ则向低场移动了δ0.26, 而其它质子未发生明显位移, 说明Feb分子的芳香环进入了Q[8]空腔, 并因此受到瓜环的屏蔽效应影响, 从而使质子峰向高场移动. Hγ向低场移动, 推断其可能正好处于Q[8]的端口, 因为瓜环在端口外部形成的核磁去屏蔽区, 会使处于该区域的质子的化学位移受到去屏蔽效应而向低场移动. 因此, 由核磁共振氢谱表征结果推测Q[8]与Feb的相互作用模式如Scheme 2所示.
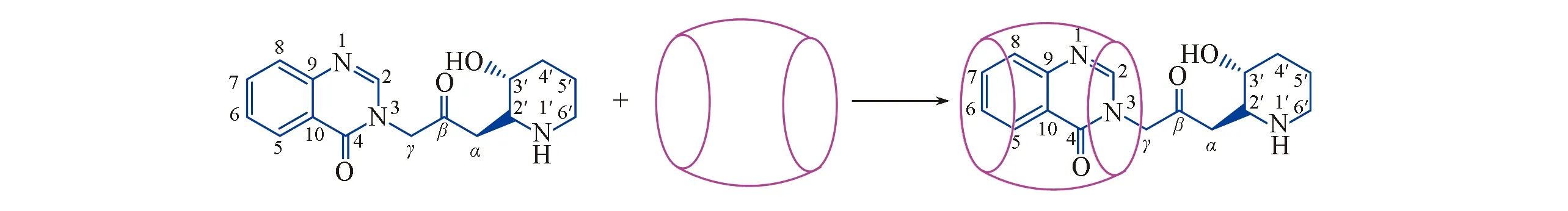
Scheme 2 Interaction mode of Feb with Q[8]
2.5 红外光谱分析

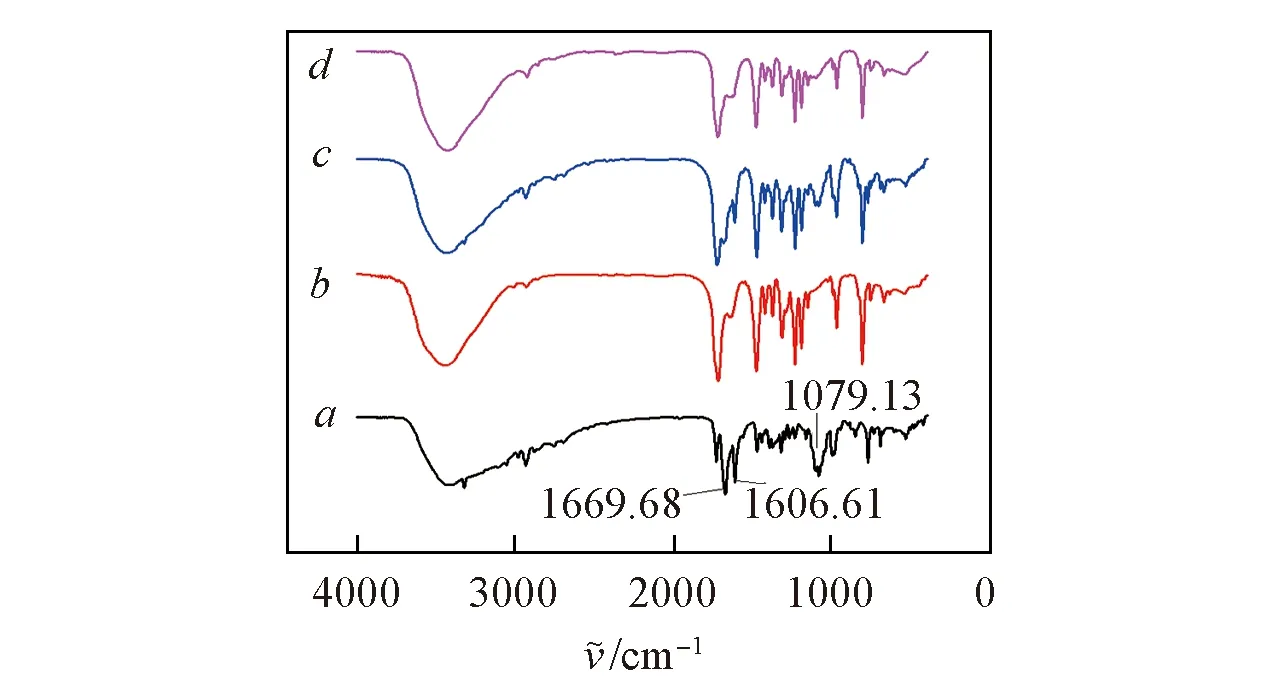
Fig.6 IR spectra of Q[8] with Feba. Feb; b. Q[8]; c. Feb/Q[8] physical mixture; d. Feb/Q[8] Inclusion complex.

Fig.7 Release of Feb at different pH valuespH, a—f: 1.2, 2.0, 3.0, 4.0, 5.0, 6.8. Inset: absorbance intensity plot at 228 nm of Q[8]/Feb.
2.6 不同pH值下Q[8]/Feb包合物中Feb的释放
图7为Q[8]/Feb包合物溶液随pH值变化(1.2~6.8)的紫外吸收光谱图. 可见, 随着pH逐渐增大, 溶液吸光度值逐渐增大, 当pH>3.0时, 吸光度值基本趋于平稳, 不再发生改变. 此结果表明, 当溶液pH值从1.2增大至3.0时, Q[8]/FebQ包合物能够逐渐释放出游离Feb分子, 当pH>3.0时, 达到了完全释放.

Fig.8 Release of Q[8]/Feb inclusion complex at pH=1.2(a) and 6.8(b)
根据上述实验结果, 可以推断在pH=1.2时质子化的Feb分子可与Q[8]形成稳定包合物. 当pH>3.0时, Q[8]/Feb包合物可释放出游离Feb分子, 即在人工胃液(pH=1.2)中质子化的Feb分子可与Q[8]以稳定包合物形式存在, 而在人工肠液(pH=6.8)中Feb分子则从八元瓜环空腔释放出来.
2.7 Q[8]/Feb固体包合物在人工胃肠液中的缓释
由图8可见, Q[8]/Feb固体包合物释放受介质pH值的影响较大. 在10 min时, Q[8]/Feb固体包合物在人工胃液(pH=1.2)和人工肠液(pH=6.8)中的累积释放度分别为65.35%和72.79%; 在50 min时, 累积释放度分别为89.06%和96.20%. 可见, Q[8]/Feb固体包合物在人工肠液(pH=6.8)中的释放度大于人工胃液(pH=1.2).
3 结 论
在pH=1.2的盐酸介质中, Feb可与Q[8]发生相互作用, 形成摩尔比为1∶1的主-客体包合物, 主-客体结合常数为4.20×104L/mol. Feb在pH=1.2(人工胃液)时可与Q[8]形成稳定包合物, 在pH=6.8(人工肠液)时Q[8]/Feb包合物可释放出单纯的游离Feb, 即在胃液里稳定存在, 肠液里释放. Q[8]作为Feb的一种潜在药物载体, 其减轻常山碱呕吐副反应的作用还有待进一步的研究.
- 高等学校化学学报的其它文章
- 可双光子激发的聚集诱导发光光敏剂及其生物医学应用
- 金属有机框架材料的结构、 动力学行为和主客体相互作用的固体核磁共振研究
- 大面积多元化表面等离激元金纳米粒子结构的制备
- Determination of Triazine Herbicides from Fruit Juice Samples Using Effervescence Assisted Microextraction Method Based on Acidic Ionic Liquid Packed Syringe
- 聚谷氨酸接枝聚乙二醇@碳酸钙遮蔽体系用于提高聚乙烯亚胺基因转染效率
- 基于萘普生-芳基金属配合物的抗癌及抗炎性能

