微滴式数字PCR检测冷冻草莓中GⅠ、GⅡ型诺如病毒
,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266000; 2.山东青岛海关检验检疫技术中心,山东青岛 266000)
诺如病毒(norovirus,NV)是引起急性无菌性胃肠炎和儿童腹泻的主要病原之一,1972年采用免疫电镜方法,在胃肠炎病人粪便标本中检出一种以前没有见到过的小圆形病毒颗粒,命名为“小圆结构病毒”,“诺瓦克病毒”[1]。诺如病毒可以通过人与人之间直接传播,或接触到被污染的水和食物而进行传播。在日常环境和烹饪条件下并不能完全杀灭[2-3],从感官体验上几乎不能判断食物是否被病毒污染。而人类对诺如病毒普遍易感,10~100个病毒粒子即可引发感染,因此常因食品污染诺如病毒,造成严重的食品安全事件[3]。2012年,德国学校食堂发生了10952人次感染诺如病毒的大面积急性肠胃炎事件,同时伴随着腹泻、呕吐、高热等症状,调查显示是冷冻草莓被污染诺如病毒引起[4]。所以,对诺如病毒的研究和防治具有重要的现实意义。
目前,诺如病毒不能在体内繁殖,也无动物模型,没有合适的组织细胞培养系统,采用电镜法、酶联免疫法和PCR法检测是诺如病毒检测的常用方法[5]。在食品中污染的诺如病毒数量少,一般都少于104copy/10 g,电镜检测的灵敏度为105~106个病毒粒子/mL,食源性诺如病毒可能超过电镜法的最低检测限[4-5];酶联免疫法也因食品中诺如病毒含量较少,抗原特异性不强,导致检测灵敏度过低,不能满足日常检测要求[6]。现有的RT-qPCR技术检测诺如病毒因样品染毒浓度低,同时存在检测过程中受抑制物影响而导致无法检测的情况[7]。微滴式数字PCR原理是将含有核酸模板的标准PCR反应体系,平均分配成数百万个PCR反应到微滴中,使每个反应中都尽可能含有一个模板分子,进行单分子模板PCR反应,有荧光信号记为1,无荧光信号记为0,然后经过统计学泊松分布的校准进行绝对定量[8-10]。
近年来,利用微滴式数字PCR对甲型流感病毒进行定量分析[10],有学者通过对食品中GⅠ型诺如病毒进行研究,以获得ddPCR在食品致病微生物检测领域的基础性证据[11-13]。本文将RT-ddPCR应用到冷冻草莓样品GⅠ和GⅡ型诺如病毒的检测中,目前国内还未见相同报道,通过研究RT-ddPCR用于诺如病毒检测的最佳退火温度、灵敏度、特异性、重复性实验,建立了RT-ddPCR检测诺如病毒的绝对定量技术,以期应用到小剂量食源性病毒的检测中。
1 材料与方法
1.1 材料与仪器
冷冻草莓 青岛海关出入境检验检疫实验室各公司送检散装样品,-20 ℃保存,1周内检测;30 U果胶酶(Sigma p2401) 美国Sigma公司;Tris/Glycine/Beef extract(TGBE)缓冲液(Tris base 12.1 g、甘氨酸3.8 g、牛肉浸出粉10 g、双蒸水补充至1 L,pH调节至9.5,高压灭菌)、PBS(5×PEG,50 g/100 mL PEG 8000,1.5 mol/L NaCl,高压灭菌)、1 mol/L盐酸、氢氧化钠溶液、氯仿、正丁醇等化学试剂(均为分析纯) 国药集团化学试剂有限公司;Qiagen RNEASY Mini Kit(74104) 德国Qiagen公司;One-Step TM PCR Inhibitor Removal Kit 美国Genemed Synthesis公司;One-Step RT-ddPCR Advanced Kit for Probes、ddPCRSupermix for Probes(no dUTP) 美国BIO-RAD公司;AmbionAgPath-IDTM One-Step RT-PCR Kit(AM1005) 美国ABI公司。
LC480荧光定量PCR仪 美国Applied Biosystems公司;QX200 Droplet Digital PCR System 美国BIO-RAD公司;5804R高速低温离心机(50 mL) 德国Eppendorf公司;BagPageR无菌匀质袋 法国Interscience公司;MLS-3750高压灭菌锅、WDF-U4186S超低温冰箱 松下健康医疗器械(上海)有限公司;蛋白核酸检测仪 德国Eppendorf公司。
1.2 实验方法
1.2.1 引物和探针 参照ISO/TS 15216-2:2013[14]合成引物与探针,Norovirus GⅠ正向引物:CGC TGG ATG CGN TTC CAT;反向引物:CCT TAG ACG CCA TCA TCA TTT AC;探针:FAM-TGG ACA GGA GAY CGC RAT CT-TAMRA。Norovirus GⅡ正向引物:ATG TTC AGR TGG ATG AGR TTC TCW GA;反向引物:TCG ACG CCA TCT TCA TTC ACA;探针:VIC-AGC ACG TGG GAG GGC GAT CG-TAMRA。
1.2.2 样品前处理 称取5~10个冷冻草莓放入带滤网的均质袋中,向均质袋中加入35 mL已混30 U果胶酶黑曲素的TGBE缓冲液,调节pH至9.5,在室温下60 r/min恒定摇晃孵育20 min。孵育过程中每隔10 min检测样品pH,若pH小于9.0,则使用NaOH调节至pH9.5(酸性水果孵育过程中会使pH下降),若调节了pH,则应延长10 min的孵育时间。收集洗脱液于50 mL离心管中,10000×g离心30 min,4 ℃离心澄清,取上清液至新离心管。
1.2.3 病毒富集 使用HCl调节上述离心上清溶液酸碱度至7.0,加入四分之一体积的PEG溶液涡旋振荡1 min,使样品溶液充分混匀,之后持续在4 ℃振摇4 h或静置过夜。4 ℃条件下10000×g离心30 min,弃上清液,在4 ℃条件下10000×g离心5 min,使沉淀紧实后用移液枪移去废液弃掉,加500 μL PBS蜗旋振荡,使沉淀重新溶解,室温静置5 min,4 ℃条件下10000×g离心5 min,吸上清液置于2 mL无菌离心管,加入等体积有机溶剂氯仿-正丁醇,蜗旋混合后静置5 min。4 ℃、10000×g离心15 min,与有机溶剂混合明显分层,将上层水相小心移至新离心管中,-20 ℃保存用于提取病毒RNA[8,15]。
1.2.4 病毒RNA提取 按照Qiagen RNEASY Mini Kit(74104)试剂盒说明书,提取样品中病毒RNA,最终溶于100 μL RNase水,-80 ℃保存,用于后续微滴式数字PCR实验。
1.2.5 阳性对照的制备 诺如病毒原液:由实验室检测获得诺如粪便悬液,使用1×磷酸盐缓冲液(phosphate buffer saline,PBS)10倍稀释,旋涡振荡混匀,用离心机8000×g离心20 min,上清液分装至1.5 mL离心管,作为阳性对照,-80 ℃贮存备用[8]。
1.2.6 质粒标准品的制备 以诺如病毒的核酸为模板,使用1.2.1设计的引物进行扩增,扩增长度为280 bp,将扩增产物连接至载体,然后转化为感受态细胞,将筛选的阳性重组质粒测序。测序结果在NCBI上进行BLAST分析,序列正确的阳性质粒即为诺如病毒GⅠ、GⅡ的标准品。
1.2.7 方法学实验
1.2.7.1 RT-ddPCR退火温度的优化 退火温度为引物和模板结合时候的温度参数,是影响 RT-ddPCR特异性的较重要因素,过低时可能导致非特异性扩增,过高时会使反应的灵敏度下降[15-16]。采用RT-ddPCR推荐的反应体系(One-Step RT-ddPCR Advanced Kit for Probes 20 μL),使用同一样品的RNA核酸,对退火温度进行研究。根据信号读取结果判断优化体系。设置GI,GII型诺如病毒的退火温度为63.0、62.4、61.4、59.9、58.1、56.5、55.6、55.0 ℃,将扩增完的96孔板放进QX200微滴读取仪上,进行结果读取。双通道检测GI,GII型诺如病毒,根据信号读取结果判断最优反应体系。
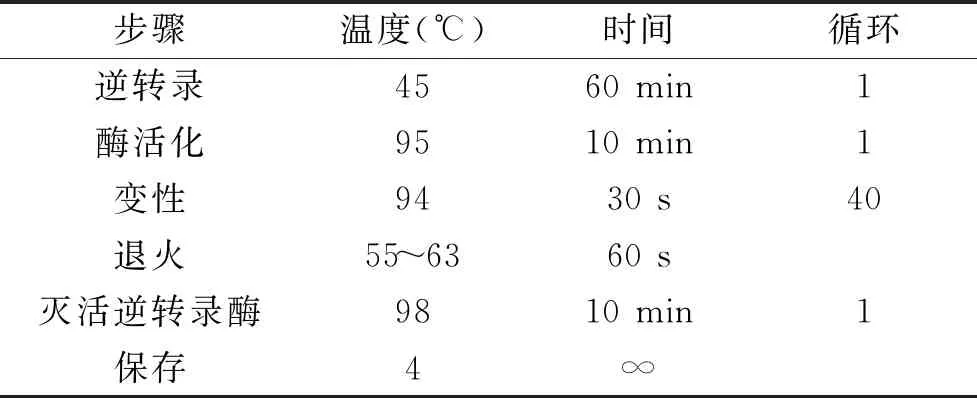
表1 RT-ddPCR反应条件Table 1 RT-ddPCR reaction conditions
1.2.7.2 RT-qPCR反应和 RT-ddPCR反应 RT-qPCR反应体系(20 μL):TaqMan Universal PCR Master Mix 10 μL,10 μmol/L的上下游引物各1.8 μL,10 μmol/L的探针0.5 μL,RNA模板2 μL,无RNase超纯水3.9 μL。反应设置条件为:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min。
RT-ddPCRddPCRSupermix for Probes(no dUTP)反应体系(20 μL):TaqMan mix 10 μL;10 μmol/L的上下游引物各1.8 μL,10 μmol/L的探针0.5 μL,DNA模板2 μL,无RNase超纯水3.9 μL。
反应体系(One-Step RT-ddPCR Advanced Kit for Probes 20 μL):Supermix 5 μL,Reverse transcriptase 2 μL,300 nm DTT 1 μL,10 μmol/L的上下游引物各1.8 μL,10 μmol/L的探针0.5 μL,RNA模板2 μL,无RNase超纯水5.9 μL。转移油滴进入96孔板,封好膜后在30 min内进行PCR反应,将扩增完的96孔板放进QX200微滴读取仪上,进行结果读取。
1.2.7.3 灵敏度实验和线性关系分析 将诺如病毒 GⅠ,GⅡ的标准品进行10倍梯度稀释,连续稀释8次记为S1~S8,进行RT-ddPCRSupermix for Probe实验,记录拷贝数,确定标准曲线和数字PCR的检测范围。
1.2.7.4 特异性实验 用上述1.2.2和1.2.3方法提取诺如病毒,轮状病毒,腺病毒进行RT-ddPCR检测,确定该实验方法的特异性。
1.2.7.5 重复性实验 为了证明体系的重复性,对样品重复3次进行RT-ddPCR实验,每1周进行检验一次,连续3周,计算标准差和相对标准差,判断该方法重复性和稳定性。
1.2.8 送检样品 对送检的草莓样品进行RT-ddPCR定量检测。与RT-qPCR进行比较,判断该方法的准确性。
1.3 数据处理
实验结果采用QX200 Droplet Digital PCR System 提供的Quantasoft软件(Bio-Rad)进行分析处理。
2 结果分析
2.1 退火温度的确定
在不同退火温度下63.0、62.4、61.4、59.9、58.1、56.5、55.6和55.0 ℃(A01-H01对应8个温度梯度)对GⅠ型诺如病毒进行RT-ddPCR反应,得到如图1所示散点图,横坐标表示微滴数,纵坐标表示荧光信号强度,可以直接在Quantasoft软件上直接读取微滴数和拷贝数,对应的拷贝数分别为91.1、145.5、212、228、229、233、232和228 copies/μL,单个样品孔内生成的总微滴数是检验实验好坏的重要指标,可接受的平均微滴数目为10000[10],本实验反应平均微滴数为12139,表明所有反应的微滴生成正常,阴阳微滴有明显分层,保证了后续实验结果分析的准确性,在温度为56.5 ℃时,样品拷贝数最高,为233 copies/μL。表明此退火温度能够保证 RT-ddPCR法定量检测GⅠ型诺如病毒结果的可靠性,将GⅠ型诺如病毒 RT-ddPCR反应的退火温度选为56.5 ℃。

图1 诺如病毒GⅠ 8个温度梯度RT-ddPCR一维散点图Fig.1 Temperature gradient ddPCR one-dimensional scatter plot of NV GⅠ
同样的温度梯度,对GⅡ型诺如病毒进行RT-ddPCR反应,得到如图2所示散点图,样品拷贝数分别为76.9、78.3、67、62.8、72.8、69.3、65.6和71.1 copies/μL。图2中3526处的短横线为阈值线,荧光信号强度为3526时能更清晰直观的反映阴阳性微滴是否分开,图3显示63和62.4 ℃时,拷贝数分别为76.9和78.3 copies/μL,阴阳微滴界限不明显,实验结果不准确。图4显示在温度为58.1 ℃时,样品拷贝数为72.8 copies/μL,阴阳微滴分层明显,并且分布于中间的不易判定阴阳性的微滴数目较少,微滴数量和质量都较好,说明扩增效果良好,结果较为准确[11]。表明此退火温度能够保证RT-ddPCR法定量检测GⅡ型诺如病毒的结果的可靠性。将GⅡ型诺如病毒的RT-ddPCR反应的退火温度选为58.1 ℃。
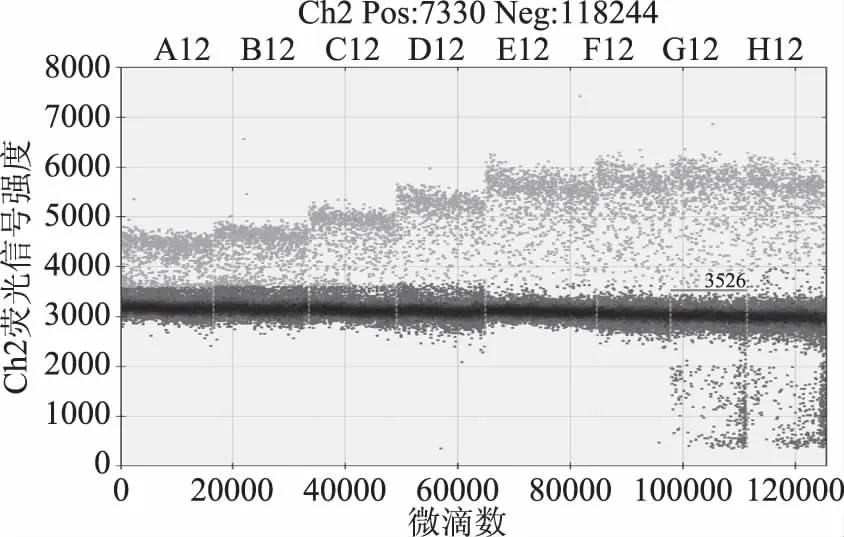
图2 诺如病毒GⅡ 8个温度梯度RT-ddPCR一维散点图Fig.2 Temperature gradient ddPCR one-dimensional scatter plot of NV GII

图3 退火温度为63、62.4 ℃的 RT-dd PCR法检测GⅡ型诺如病毒的直方图Fig.3 Histogram of GII Norovirus detected by RT-dd PCR with annealing temperature of 63,62.4 ℃
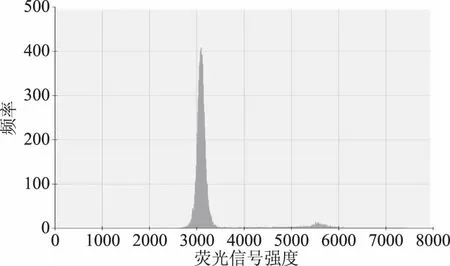
图4 退火温度为58.1 ℃的RT-dd PCR法 检测GⅡ型诺如病毒的直方图Fig.4 Histogram of GII Norovirus detected by RT-dd PCR with annealing temperature of 58.1 ℃
2.2 RT-ddPCR线性分析
从图5、图6中可以看出,随着质粒浓度降低,阳性微滴数减少,阴性微滴数增加,生成的微滴数最低为12134,最多为19432均大于10000,平均为16139,说明生成的微滴质量和数量较好,结果准确可靠。S1~S3质粒浓度过高,超出检测范围,图5中GⅠ质粒拷贝数分别为9000、1934、183、25.6、5.6 copies/μL,图6中GⅡ质粒拷贝数分别为7000、659、68.6、9.2和1.8 copies/μL。以质粒拷贝数的对数为纵坐标,RT-ddPCR检测诺如病毒GⅠ标准曲线线性方程为y=-0.829x+4.819,决定系数R2=0.9947,RT-ddPCR检测诺如病毒GⅡ标准曲线线性方程为y=-0.9035x+4.6543,决定系数R2=0.995,线性关系良好,表明该方法结果准确可靠。
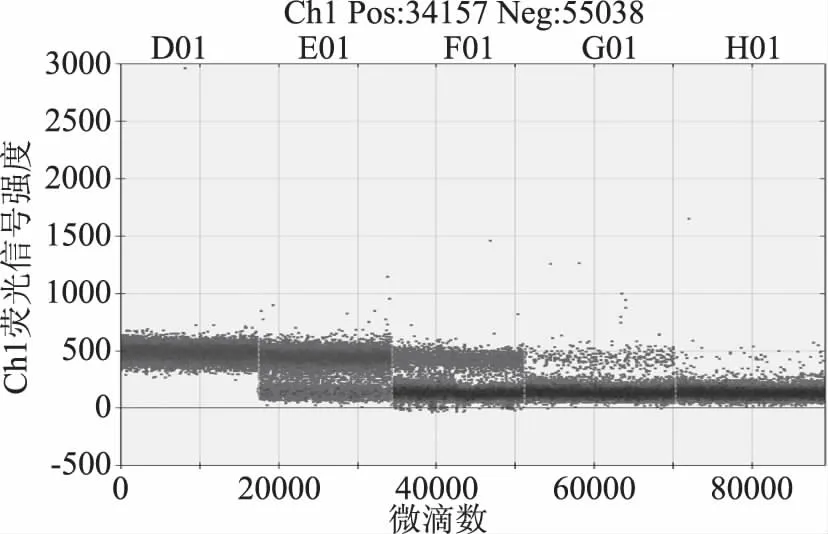
图5 GⅠ质粒浓度梯度稀释RT-ddPCR一维散点图Fig.5 RT-ddPCR one-dimensional scatter plot of GI concentration gradient dilution
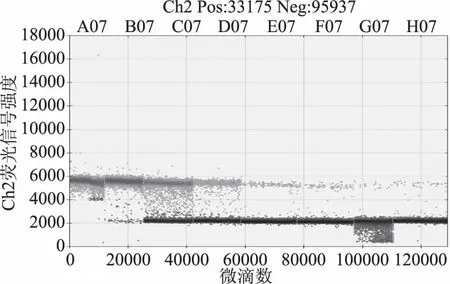
图6 GⅡ质粒浓度梯度稀释RT-ddPCR一维散点图Fig.6 RT-ddPCR one-dimensional scatter plot of GⅡ concentration gradient dilution
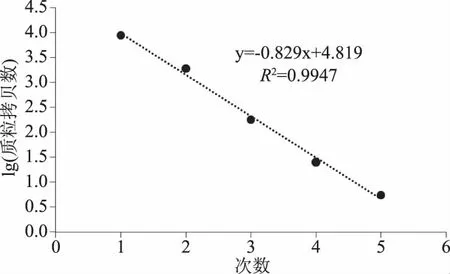
图7 GⅠ型诺如病毒的线性关系Fig.7 Linear relationship of GI type norovirus
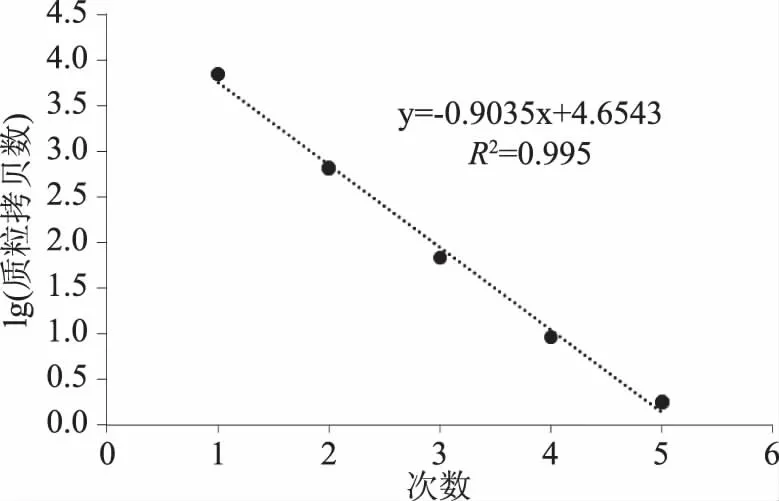
图8 GⅡ型诺如病毒的线性关系Fig.8 Linear relationship of GII type norovirus
2.3 RT-ddPCR特异性实验
本实验建立的方法对轮状病毒,腺病毒均无明显扩增,A12为诺如病毒的拷贝数为388 copies/μL,B12、C12为轮状病毒与腺病毒检测结果No Call,说明该方法具有特异性。
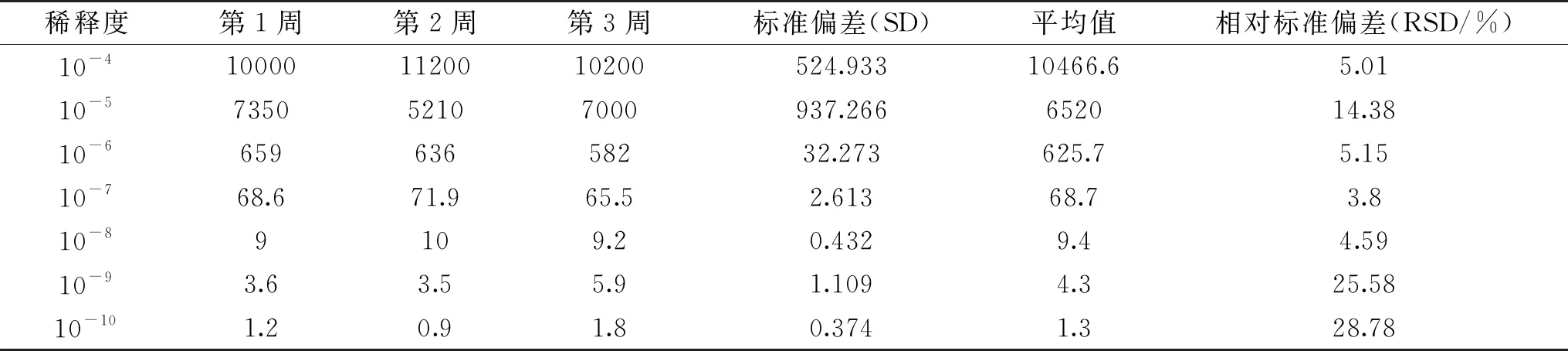
表2 RT-ddPCR重复性实验Table 2 RT-ddPCR repeatability experiment

图9 RT-ddPCR特异性试验Fig.9 Specificity test of NoV with droplet digital PCR注:从左往右分别为388 copies/μL,No Call,No Call,空白。
2.4 重复性
通过组间重复和组内重复实验分析RT-ddPCR的重复性,结合实验结果的标准偏差和相对标准偏差对实验的准确性进行判定[17]。对提取的GⅡ型诺如病毒RNA进行10-1~10-7稀释,稀释度为10-1~10-3时,浓度过高,超出检测范围。在稀释度为10-7时,RT-ddPCR法的RSD 为3.8%,精密度最好,在稀释度为10-10即浓度最低时,RT-ddPCR法的RSD为28.78%,精密度最差,说明在浓度很低时,RT-ddPCR法的重复性不佳。在实际应用过程中,应注意样品浓度不宜过高或过低,确保实验重复性良好。
2.5 应用于实际样品的检测
经过病毒富集后,将实验室送检诺如病毒阳性样品稀释,进行RT-qPCR和RT-ddPCR定量,微滴式数字PCR的定量结果分别为:420、42、4.1、3.9、3.2、1.8 copies/μL。RT-qPCR扩增曲线如图10所示,呈“S”型,从左到右分别表示稀释度为10-1~10-5时扩增曲线,稀释度为10-6、10-7时,RT-qPCR与阴性对照均无明显扩增,所以RT-qPCR法的灵敏度为稀释度为10-5的诺如病毒阳性样品的浓度,其Ct值为33.69(Ct<35),而RT-ddPCR在微滴生成正常,满足泊松分布的条件下,在稀释度为10-6时实测质粒标准品的拷贝数浓度为1.8 copies/μL,所以RT-ddPCR法的灵敏度比RT-qPCR法高一个数量级。最低检测限低至个位拷贝数,在RT-ddPCR的检测范围内,利用建立好的RT-ddPCR的方法对临床标本进行了准确定量,可以运用到实际样品的检测。
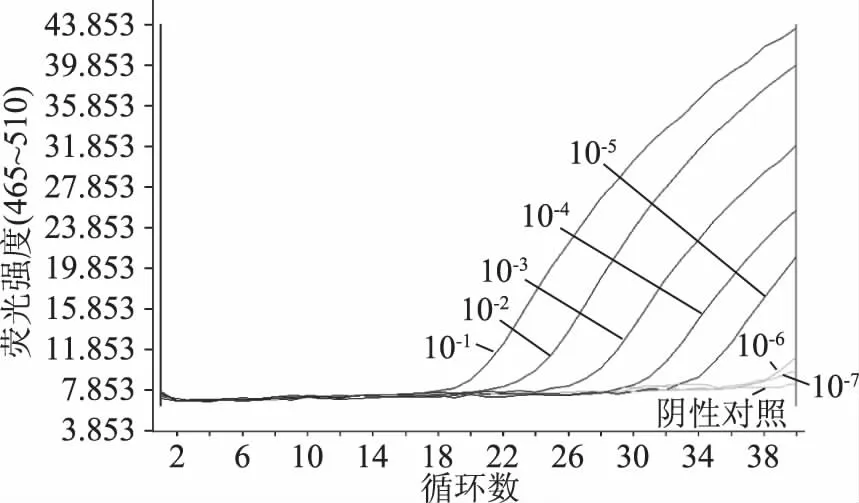
图10 RT-qPCR检测不同稀释度 诺如病毒样品的RNA扩增图Fig.10 RT-qPCR detection of RNA amplification of different dilutions of Norovirus samples
3 结论与展望
一步法微滴式数字PCR系统包括微滴生成器、PCR仪和微滴分析仪三部分组成,检测冷冻草莓中的诺如病毒,实验方法的准确性是由反应扩增后累计的荧光信号的强弱决定的,而荧光信号的累积与PCR扩增效率密切相关[18-19]。因为RT-ddPCR不受PCR抑制物的影响,PCR扩增效率与PCR扩增体系中的引物、探针浓度和退火温度密切相关[13]。RT-ddPCR是将含有核酸模板的反应体系分配成小的PCR反应,所以RT-qPCR的反应体系可能不适合RT-ddPCR反应,需要对扩增过程进行优化以达到RT-ddPCR的最优效果。优化RT-ddPCR的退火温度,确定了RT-ddPCR检测GI型、GⅡ型诺如病毒退火温度为56.5、58.1 ℃。RT-ddPCR的检测结果与GⅠ质粒标准品拷贝数的决定系数R2=0.9947,与GⅡ质粒标准品拷贝数的决定系数R2=0.995,说明该方法具有良好的线性关系。浓度过高超出检测范围时,RT-ddPCR检测结果全为阳性,RSD最小为3.8%,表明该实验重复性良好。在浓度较低时,RT-ddPCR的重复性不佳。所以在临床样品的检测中要确保样品浓度在检测范围内,使实验结果准确可靠。本实验在研究特异性的时候,因为病毒样品资源的限制,只做了诺如病毒与轮状病毒、腺病毒的RT-ddPCR反应,对轮状病毒和腺病毒几乎无扩增,说明该方法具有特异性。对送检样品做RT-ddPCR和RT-qPCR作对比RT-qPCR扩增曲线呈“S”型,说明荧光定量结果准确可靠,结果显示RT-ddPCR最低检测限低至个位拷贝数,RT-ddPCR法的灵敏度比RT-qPCR法高一个数量级,说明RT-ddPCR灵敏度高。
本研究建立的诺如病毒RT-ddPCR法具有特异性强、灵敏度高、检测限低等优点,但也有自己的不足,浓度过高超出检测线的样品会导致结果不准确,阈值线的设置可能会导致结果的偏差,反应微粒处于阈值线附近的微滴因为阈值线的变动,被定义为阴性或者阳性,造成错误的结果[20]。因此,在样品检测过程中,需要保证样品浓度处于检测范围内,浓度过高可以稀释后再检测。阴性峰和阳性峰明显分开,分布在中间不易界定阴阳性的微滴数少,微滴生成平均在一万以上以确保实验结果的准确可靠。在加样过程中,因为微滴发生板不允许出现气泡,扩大1.1倍,配制22 μL体系,使误差减小。微滴生成器,PCR扩增仪和微滴分析仪在使用前进行预热,达到机器使用的最好状态。
本研究建立了基于一步法微滴式数字PCR技术对冷冻草莓中诺如病毒绝对定量的方法,减少了两步法和荧光定量PCR中可能出现的污染,并可对临床样本中的病毒含量进行绝对定量,该方法的最低检测限可以低至个位拷贝数,给小剂量感染诺如的食品检测提供了新方法,对诺如病毒引起的胃肠炎的防治,监测治疗等方面具有重要意义。

