蛋白修饰植物甾醇脂质体的制备及体外消化研究
,,3,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023; 2.武汉轻工大学武汉市畜禽饲料工程技术研究中心,湖北武汉 430023; 3.国家粮食局粮油资源综合开发工程技术研究中心,湖北武汉 430023)
植物甾醇(Phytosterol,PS)是存在于植物体内的具有类胆固醇结构的功能性脂质,是植物体内甾醇类化合物的统称,欧洲食品安全局推荐每人每日应摄入1.5~3.0 g的植物甾醇,这样可以降低人体内7%~11.3%的低密度脂蛋白胆固醇[1]。人们日常饮食中植物甾醇的含量为250 mg/d[2]左右,一些素食主义者可以达到500 mg/d[3],但由于其利用率低仍需补充摄入植物甾醇。大豆卵磷脂(phosphatidylcholine,PC)是一种两亲性离子表面活性剂,分散于水中可自发形成双分子层封闭结构脂质体(Liposome,LS),用作药物载体。目前,植物甾醇已被证实可取代胆固醇作为脂质体的稳定剂[4]。大豆分离蛋白(Soybean protein isolate,SPI)因其高营养价值和良好的乳化性被广泛应用于食品工业,有学者发现,大豆蛋白与卵磷脂之间存在交互作用,可提高乳化体系的物理稳定性[5]。
由于天然植物甾醇在水中溶解性差,在健康人体内的吸收率通常小于食物中含量的5%,远低于胆固醇35%~70%的吸收率[6],使用乳化技术可以提高植物甾醇的吸收率,Ostlund等[7]发现300 mg卵磷脂乳化的植物甾醇其降血脂效果为1 g游离植物甾醇的3倍。除此之外,将物理改性后的植物甾醇添加到乳液、微胶囊和脂质体等食品体系中,也为植物甾醇的利用提供了新的思路。钱伟等[8]采用O/W微乳化喷雾干燥法,以酪蛋白酸钠为壁材,蔗糖为助乳化剂,蔗糖脂肪酸酯为油相得到水溶性良好的植物甾醇微胶囊;杨贝贝等[9]以植物甾醇替代胆固醇作为脂质体的包封材料,达到降胆固醇的目的,并探讨了植物甾醇对脂质体结构与性质的影响。曹文君[10]利用乳化蒸发技术构建了多种食物蛋白-植物甾醇纳米颗粒,研究了纳米颗粒粒径与PS生物利用率的关系,并将纳米颗粒应用到蛋白凝胶体系中。
植物甾醇脂质体能够有效提高植物甾醇在水中的溶解度,并且达到一定的降胆固醇目的,但以蛋白修饰脂质体,并考察其对植物甾醇的包封率少有报道,且脂质体易氧化、稳定性差[11],故本研究采用大豆分离蛋白对植物甾醇脂质体进行修饰,并对其包封率及复溶性进行研究。
1 材料与方法
1.1 材料与仪器
植物甾醇(>95%) 武汉远成共创科技有限公司;大豆卵磷脂(70%) Aladdin试剂公司;大豆分离蛋白 河南坚久实业有限公司;混合植物甾醇标准品(菜籽甾醇13%,菜油甾醇26%,豆甾醇7%,β-谷甾醇53%) Larodan公司;5α-胆甾烷标准品、N,O-双三氟乙酰胺[BSTFA-TMCS(99∶1)]、胃蛋白酶(250 U/mg)、胰酶(10000 BAEE U/mg) Sigma-Aldrich公司;无水乙醇、盐酸、氢氧化钠、叠氮钠、胆盐等均为分析纯 国药集团化学试剂有限公司。
AL204分析天平 上海梅特勒-托利多仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;pH计 上海奥豪斯仪器有限公司;GC7890A气相色谱仪 美国Agilent科技有限公司;Zetasizer Nano ZS激光粒度仪 英国Malvern公司;T18高速分散机 德国IKA公司;JY92-ⅡN超声波清洗机 上海生析超声仪器有限公司;R-3旋转蒸发仪 瑞士Buchi公司;TGL205高速离心机 赛默飞世尔科技(中国)有限公司;SHZ-82水浴振荡锅 金坛市医疗仪器厂。
1.2 实验方法
1.2.1 蛋白修饰植物甾醇脂质体的制备 蛋白溶液配制:将大豆分离蛋白以2%(w/v)比例溶于去离子水中,加入0.02%叠氮钠,磁力搅拌溶解,调节pH至7.0,4 ℃水化过夜,得到SPI溶液。
脂质体制备[12]:采用乙醇注入法制备植物甾醇脂质体。称取一定的植物甾醇和大豆卵磷脂,溶于一定的无水乙醇,充分搅拌溶解;用去离子水将SPI溶液稀释至一定浓度,在高速分散(8000 r/min)条件下,用注射器将PS-PC乙醇溶液缓慢注入40 mL 1% SPI溶液,继续分散2 min,间隔超声(开3 s,关2 s)10 min,旋转蒸发除去乙醇,加水稀释至原蛋白浓度,即得蛋白修饰植物甾醇脂质体(SPI-LS)。
1.2.2 单因素实验 根据1.2.1所示方法,在乙醇体积与大豆分离蛋白体积比为20%,大豆分离蛋白含量为1%时,考察植物甾醇与卵磷脂的比(PS∶PC为1∶1、1∶2、1∶3、1∶4、1∶5)对包封率的影响;在PS∶LC为1∶4,SPI含量为1%时,考察不同乙醇体积比(10%、15%、20%、25%、30%)对包封率的影响;在PS∶PC为1∶4,乙醇体积比为25%时,考察不同含量(0.25%、0.50%、1.00%、1.50%、2.00%)的大豆分离蛋白对包封率的影响。
1.2.3 植物甾醇标准曲线绘制及包封率测定 标曲绘制:分别量取0.2、0.4、0.8、1.6、3.2、6.4 mL混合植物甾醇标准溶液,加入0.2 mL 5α-胆甾烷标准溶液,氮吹、衍生,气相分析植物甾醇各组分含量,以混合植物甾醇各组分分别与5α-胆甾烷的浓度比为横坐标,相应的峰面积之比为纵坐标,绘制标准曲线。
包封率测定方法[13]:皂化:脂质体在8000×g离心20 min,取上清液0.4 mL于50 mL试管中,加入0.4 mL 5α-胆甾烷(1.002 mg/mL)作为内标和10 mL 1.0 mol/L KOH乙醇溶液,于80 ℃水浴振荡器内皂化1 h,取出后冷却至室温,在皂化液中加入5 mL水和10 mL正己烷萃取,有机相水洗3次;衍生:有机相用氮气吹干,加入0.1 mL吡啶和0.1 mL BSTFA∶TMCS(99∶1),70 ℃衍生1 h,加入1 mL正己烷,过膜;气相色谱条件:HP-5毛细管柱(30 m×0.32 mm×0.25 μm),恒定流速1 mL/min,进样口温度为300 ℃,柱温160 ℃保持2 min,10 ℃/min升至280 ℃,保持10 min,5 ℃/min升至300 ℃,保持5 min,检测器温度为310 ℃,分流进样,分流比为10∶1。
式中:W为包封率;m0为上清液中植物甾醇含量,单位为毫克(mg);m1为加入的PS含量,单位为毫克(mg)。
1.2.4 粒径与Zata电位测定 脂质体用去离子水稀释100倍后,采用马尔文激光粒度仪测定脂质体平均粒径、多分散系数PdI和Zata电位。
1.2.5 SPI-LS复溶性测定
1.2.5.1 复溶液粒径、Zata电位测定 将脂质体冷冻干燥后,取一定量的SPI-LS冻干粉溶于去离子水中至原蛋白浓度,涡旋使其充分溶解,稀释一定倍数后,采用动态光散射技术测定其粒径(稀释1000倍)和电位(稀释100倍)大小。
1.2.5.2 溶解度测定 参照彭捷[14]的方法并加以改进,称取过量SPI-LS冻干粉溶解于一定量水中,使得样品达到过饱和状态,涡旋充分溶解,37 ℃水浴振荡平衡24 h后,8000×g离心20 min,取上清液,气相分析植物甾醇含量。
式中:S为植物甾醇溶解度(mg/mL);m0为上清液中植物甾醇含量(mg);V为加入的水的体积(mL)。
1.2.6 模拟胃肠消化
1.2.6.1 消化液的配制 模拟胃肠消化液的配制,参照Liu等[15]的报道加以改进。胃液储备液(Simulated gastric fluid,SGF)的配制:2 g NaCl溶于800 mL去离子水中,0.1 mol/L HCl调节pH至2.0,定容至1 L,4 ℃储藏备用;肠液储备液(Simulated intestinal fluid,SIF)的配制:6.8 g KH2PO4溶于800 mL去离子水中,0.1 mol/L NaOH调节pH至7.0,定容至1 L,4 ℃储藏备用。胃蛋白酶和胰酶分别用胃肠储备液溶解,3000 r/min离心取上清液。

表2 PS∶PC对SPI-LS包埋效果的影响Table 2 Effect of PS∶PC on SPI-LS embedding quality
注:表中小写字母表示相互之间差异显著(P<0.05),相同字母表示相互之间差异不显著(P>0.05)。
1.2.6.2 体外模拟胃肠消化 体外模拟胃消化[10]:将10 mL SPI-LS与9 mL SGF混合于50 mL离心管,调节pH至2.0,在37 ℃恒温水浴摇床上,以95 r/min转速平衡10 min,加入1 mL胃蛋白酶(80 mg/mL),开始消化实验。分别在0、30、60 min取出1 mL,0.1 mol/L NaOH调节pH至7.0使胃蛋白酶失活,8000×g离心20 min,取上清液测定物甾醇含含量。
体外模拟肠消化[16]:经60 min胃液消化后,取上述10 mL消化液于50 mL离心管,加入9 mL SIF,用4 mol/L NaOH迅速调节pH至7.0,加入160 mg胆盐,在37 ℃恒温水浴摇床上,以95 r/min转速平衡10 min,加入1 mL胰酶(160 mg/mL),分别在90、120、150、180 min取出1 mL,沸水浴2 min,迅速冷却至室温,8000×g离心20 min,取上清液测定物甾醇含含量。对照试验:植物甾醇溶于无水乙醇中(2.0%,w/v),取5 mL用去离子水定容至100 mL,依次进行胃肠消化。
式中:A为植物甾醇体外生物活性;m为消化不同时间后上清液中物甾醇含含量(mg);m3为开始消化前上清液中物甾醇含的含量(mg)。
1.3 统计学处理
2 结果与分析
2.1 植物甾醇标准曲线绘制
按照1.2.3项下方法绘制标准曲线,并得到各种植物甾醇含量的标准曲线如表1所示。表明植物甾醇浓度在标准曲线范围内,线性关系良好,因此本实验选择气相色谱法作为测定植物甾醇含量的方法。
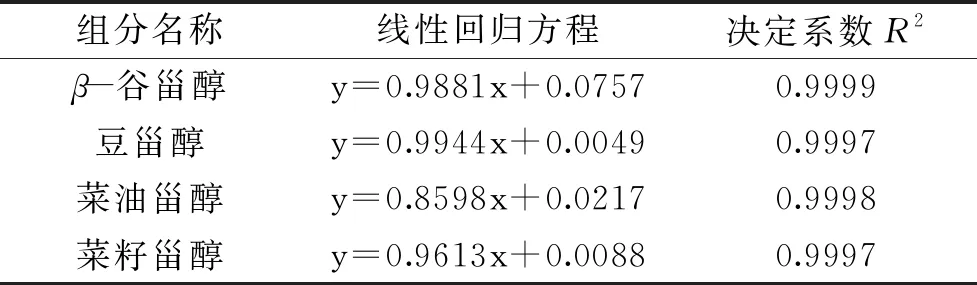
表1 植物甾醇混标各组分的线性回归方程及相关系数Table 1 Linear regression equation and correlation coefficient of each component in mixed phytosterol standard
注:线性回归方程中x为各组分与胆甾烷的浓度比,y为相应的峰面积之比。
2.2 单因素优化SPI-LS的制备
2.2.1 PS:PC对SPI-LS的影响 当PS-PC乙醇溶液与水混合后,卵磷脂分散在水中形成双分子层囊泡结构,植物甾醇的嵌入可调节双分子层的流动性及通透性作用,增加生物膜的稳定性[17]。如表2所示,当卵磷脂含量少时,植物甾醇嵌入达到饱和,过量的植物甾醇由于其弱的亲水性,易在水中重结晶析出;随着卵磷脂比例增加,脂质体粒径逐渐减小,当PS∶PC比例达到1∶4时,植物甾醇充分包埋,继续加大卵磷脂比例,过量的卵磷脂会形成新的脂质体,所测粒径分布为二重峰,使得粒径的多分散系数PdI增大,但平均粒径无显著变化。脂质体的Zata电位均在-30 mv以下,稳定性良好。加大卵磷脂比例有利于提高植物甾醇的包封率,由表2可知,当PS∶PC为1∶4和1∶5时,脂质体对植物甾醇的包封率显著高于其他组(P<0.05);PS∶PC为1∶4时,植物甾醇包封率可达到95%以上,继续增加卵磷脂比例会提高生产成本,故PS∶PC最佳配比为1∶4。
2.2.2 乙醇体积比对SPI-LS的影响 Leong[13]采用四种不同的有机溶剂制备植物甾醇纳米分散液,发现利用正己烷所得分散液粒径最小,但多分散性较差,
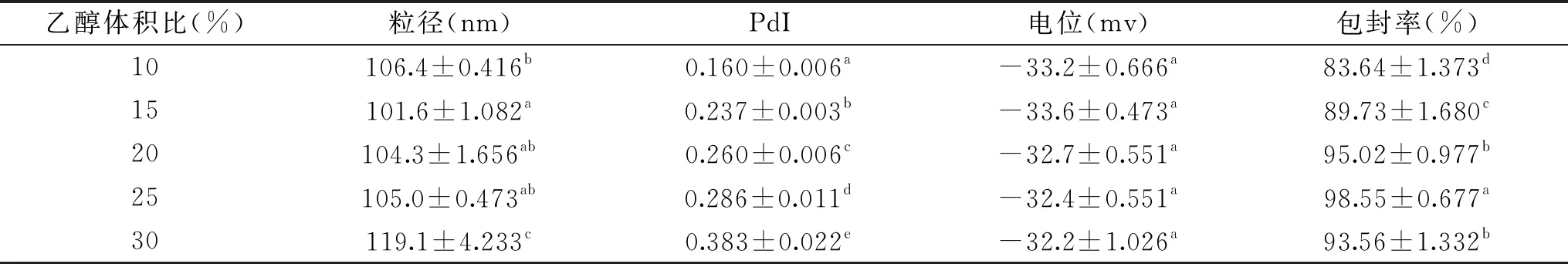
表3 乙醇体积比对SPI-LS包埋效果的影响Table 3 Effect of ethanol volume ratio on SPI-LS embedding quality
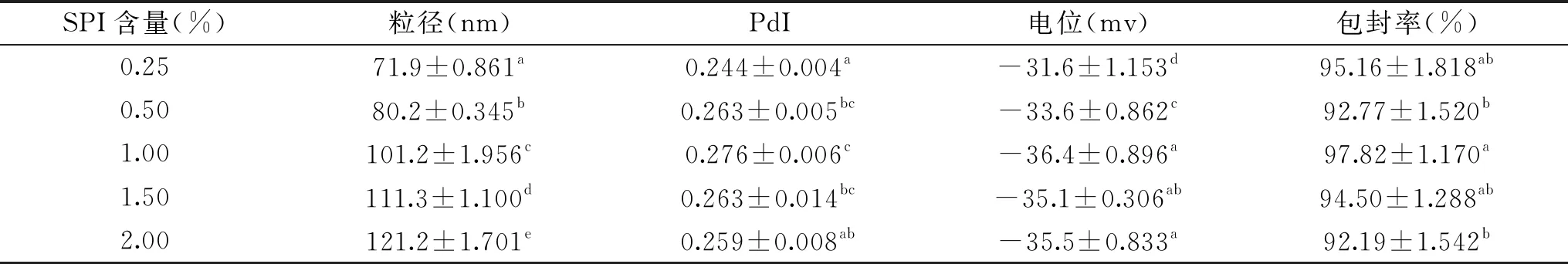
表4 SPI含量对SPI-LS包埋效果的影响Table 4 Effect of SPI content on SPI-LS embedding quality
以无水乙醇制得分散液粒径较小,且PdI在0.2以下,故合适及适量的有机溶剂能够影响纳米颗粒的结构及稳定性。本文采用乙醇注入法制备植物甾醇脂质体,当乙醇体积比较小时植物甾醇与卵磷脂不能充分混匀,少量植物甾醇仍以针状结晶存在[18],在旋蒸后进行水化的过程中,会显著增大脂质体粒径,造成包封率降低;加大乙醇体积比有助于植物甾醇卵磷脂的充分结合,减少水化过程的损失,但同时乙醇的存在也会造成部分蛋白变性,影响植物甾醇的包封率。乙醇体积比为25%时,包封率最高,之后继续增加乙醇体积反而使包封率下降。故最佳乙醇体积比确定为25%。
2.2.3 SPI含量对SPI-LS的影响 在中性条件下,大豆分离蛋白和大豆卵磷脂可通过静电相互作用和疏水相互作用可自发形成复合体系[19],不同浓度蛋白对脂质体粒径影响较大。如表4所示,磷脂在水溶液中形成囊泡或胶束,将蛋白质包裹其中[20],随着蛋白含量的增加,脂质体粒径显著增大。在蛋白含量为0.5%时,部分蛋白取代植物甾醇的位置,包封率有所下降。继续加大蛋白浓度,卵磷脂诱导蛋白疏水基团充分暴露,提高了磷脂分子层的稳定性。但磷脂与蛋白之间存在一个结合常数,当蛋白含量为1.00%时,粒径较小且包封率最高;当继续加大SPI含量时,其粒径继续增大、但包封率有所下降。这是因为SPI含量为1.00%时蛋白的吸附刚好达到饱和,继续增加蛋白含量,过量的蛋白会代替磷脂与植物甾醇结合,带来一定程度的聚沉导致粒径增大[21];在乙醇的存在下,由于蛋白的变性聚集,降低了植物甾醇的包封率。且在蛋白含量为0.25%时,植物甾醇虽然有较高的包封率,但冻干后脂质体呈块状,复溶性差。故最佳配方为:PS∶PC为1∶4,乙醇体积比为25%,蛋白含量为1.00%。
2.3 SPI-LS复溶性测定
根据2.2所得最优条件制备得到的SPI-LS经冻干后复溶,其溶液外观前后无明显差异,但粒径大小由原来的102.5 nm增加到215 nm,粒径分布由单峰变成了双峰(图1),主要是由于在冷冻干燥过程中,部分磷脂之间容易发生融合,引起SPI-LS部分团聚,使平均粒径及其分布发生变化;用于衡量脂质体表面电位的Zeta电位在冻干前后都在-30 mV以下,说明SPI-LS稳定性良好[22]。
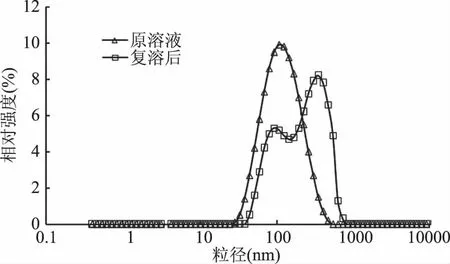
图1 脂质体复溶前后粒径分布图Fig.1 Particle size distribution of liposomes before and after dissolution
水中植物甾醇溶解度是评价包埋体系效果的重要指标。温娟[23]利用羟丙基环糊精对植物甾醇进行包埋,包合物中植物甾醇的溶解度可达到0.466 mg/mL;彭捷[14]测得未经处理的植物甾醇在水中的溶解度为0.0137 mg/mL,以酪蛋白为稳定剂制备植物甾醇纳米粒可使甾醇溶解度达到0.798 mg/mL。本文以乙醇注入法制备蛋白修饰植物甾醇脂质体,所得冻干粉末中植物甾醇在水中溶解度为1.971 mg/mL。
2.4 植物甾醇体外消化生物活性
通过模拟胃肠环境,测定SPI-LS不同消化时段植物甾醇的生物活性,结果如图2所示。加入胃蛋白酶进行消化,30 min后测出植物甾醇的生物活性上升至97.12%,这是因为pH为2时胃蛋白酶选择性水解11S球蛋白,而11S被选择性水解后,SPI的乳化活性与乳化稳定性均要比未水解的SPI高[24],所以水解30 min后植物甾醇的活性反而上升。

图2 不同消化时间段SPI-LS与原植物甾醇的生物活性Fig.2 Bioaccessibility of SPI-LS and native PS at different digestion time
随着蛋白的继续水解,植物甾醇生物活性迅速下降,可能是脂质体由中性环境变为强酸性环境,pH的变化使蛋白结构舒展开来,胰酶的作用使蛋白和磷脂水解,破坏了脂质体的有序结构,使得蛋白-磷脂复合乳化体系的乳化活性与稳定性降低,故植物甾醇生物活性由原来的98.07%降到了84.43%(60 min),但植物甾醇的保留率仍可达到80%以上;继续水解90 min,磷脂蛋白的水解产物覆盖在脂质体表面,与胆酸盐结合形成囊泡,避免了脂质体的进一步降解,所以经3 h胃肠消化后植物甾醇的生物活性仍可保持在50%以上。而未包埋的植物甾醇经过1 h模拟胃消化后植物甾醇的生物活性在5%左右;在肠液环境中由于胆盐的存在,植物甾醇吸附被胆盐乳化,生物活性升高至15%左右,与Cao结果相似[25],即在胆盐和酶的存在下,未包埋植物甾醇的生物活性为17.8%,经酪蛋白包埋达到29.2%。
3 结论
蛋白修饰植物甾醇脂质体的最佳制备工艺为:PS∶PC为1∶4、乙醇体积比为25%、蛋白含量为1%。在此工艺下制备的SPI-LS经冻干后,复溶性良好,植物甾醇在水中的溶解度可达到1.971 mg/mL;经3 h胃肠消化后,SPI-LS中植物甾醇的生物活性仍可保持在50%以上,是未经包埋植物甾醇的三倍之多。蛋白修饰植物甾醇脂质体未添加冻干保护剂,以蛋白-磷脂间的相互作用,来提高脂质体冻干后的复溶性及消化稳定性,并能够很好地保持植物甾醇的生物活性,为植物甾醇在食品中的应用提供技术支持,以控制食物中胆固醇的摄入,从而降低高血脂症的发生。

