粉碎粒度对苜蓿不同部位茎叶营养物质及功能性质的影响
,*
(1.山西农业大学工学院,山西太谷 030801; 2.山西农业大学文理学院,山西太谷 030801)
紫花苜蓿是豆科草本植物,品种丰富,种植范围广且产量高,资源十分丰富[1]。苜蓿中含有蛋白质、膳食纤维、多糖、多酚、总黄酮等营养物质,其氨基酸种类丰富且数量均衡,可补充人们日常谷物中缺少的赖氨酸;多糖、多酚、总黄酮具有延缓衰老的功能;大量存在的膳食纤维具有预防便秘、调节血糖、降血压、吸附有害物质等功能[2-4]。苜蓿具有很高的食用价值,但目前在我国苜蓿主要用做动物饲料[5],苜蓿功能食品有待进一步开发。
国内外许多学者对苜蓿中的营养物质及其功能性质进行了研究。Wang等[6]和Xie等[7]对苜蓿叶蛋白进行了研究,得知苜蓿叶蛋白氨基酸比例均衡且泡沫膨胀率高于卵清蛋白。刘华伟等[8]、许英一等[9]、施伟梅等[10]对苜蓿中多糖、多酚、总黄酮进行提取并对其抗氧化性进行了研究,得知苜蓿多糖、多酚、总黄酮清除DPPH自由基的半数抑制浓度分别为0.573、0.011、0.608 mg/mL,具有良好的抗氧化性。Wang等[11]对苜蓿膳食纤维进行了研究,得知食用添有5%苜蓿粉的饲料时,便对猪肠道中的微生物和丁酸盐有显著影响,有益于维持肠道环境的健康。但关于不同粉碎粒度苜蓿茎叶的基本成分、活性成分、功能性质研究却鲜见报道。
对苜蓿中营养物质含量进行测定,是开发苜蓿功能食品的前提,粉碎又是开发苜蓿功能食品的重要工序。因此,本文比较了苜蓿不同部位基本成分、活性成分、功能性质,并对不同粒度苜蓿粉营养物质的溶出量和功能性质进行分析,以期提高苜蓿的利用价值,为苜蓿功能食品开发提供理论指导。
1 材料与方法
1.1 材料与仪器
紫花苜蓿 山西农业大学牧草实践教学基地初花期的金皇后;葡萄糖、芦丁、没食子酸、胆固醇 标准品,合肥博美生物科技有限公司;亚硝酸钠 标准品,北京海岸鸿蒙标准物质技术责任有限公司;耐高温α-淀粉酶液(≥20000 U/mL)、蛋白酶(≥100 U/mg)、淀粉葡萄糖苷酶(≥100000 U/mL) 上海金穗生物科技有限公司;氢氧化钠、氯化钠、醋酸钾 分析纯,天津市致远化学试剂有限公司。
分级筛边长为0.25、0.2、0.16、0.125、0.08、0.063 mm的编织方孔筛 浙江上虞市华丰五金有限公司;SKD-800凯氏定氮仪 上海沛欧分析仪器有限公司;721N分光光度计 上海重逢科学仪器有限公司;SC-2542低速离心机 安徽中科中佳科学仪器有限公司;PHS-3C型精密pH计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 不同部位的苜蓿粉 采样后,以苜蓿底端为起点进行测量,在植株30、60、90 cm处进行分段,将植株分为下(0~30 cm)、中(30~60 cm)、上(大于60 cm)三段;分别对每段进行茎叶分离,将植株分为上部叶片、上部茎秆、中部叶片、中部茎秆、下部叶片、下部茎秆6个部分;分别对6部分进行冲洗、干燥(55 ℃恒温干燥箱中完全干燥)、粉碎、过筛(80目)得6个样品,自封袋内避光保存。
1.2.1.2 不同粒度的苜蓿粉 苜蓿粉碎后用边长分别为0.25、0.20、0.16、0.125、0.08、0.063 mm的编织方孔筛分级,得G1(粒度在0.2~0.25 mm)、G2(粒度在0.16~0.2 mm)、G3(粒度在0.125~0.16 mm)、G4(粒度在0.08~0.125 mm)、G5(粒度在0.063~0.08 mm)5个样品,自封袋内避光保存。
1.2.2 基本成分的测定 水分参照GB 5009.3-2016直接干燥法[12]进行测定;蛋白质参照GB 5009.5-2016凯氏定氮法[13]进行测定;灰分参照GB 5009.4-2016灼烧法[14]进行测定;脂肪参照GB 5009.6-2016索氏抽提法[15]进行测定;维生素C参照GB 5009.86-2016滴定法[16]进行测定。
1.2.3 活性成分的测定 膳食纤维参照GB 5009.88-2014酶重量法[17]进行测定;多糖参照SN 4260-2015苯酚-硫酸法[18]进行测定;总黄酮参照DB 43/T476-2009进行测定[19];总酚参照Blagoj的方法[20]进行测定。
1.2.4 功能性质指标的测定
1.2.4.1 持水力的测定 称取苜蓿粉0.5 g于15 mL离心管,加10 mL去离子水,漩涡振荡5 min,37 ℃恒温静置4 h,4000 r/min离心15 min,弃其上清液,称重[21]。持水力的公式如式(1)所示:
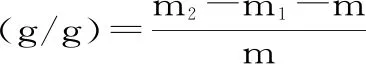
式(1)
式中:m-称取苜蓿粉的质量,g;m1-离心管的质量,g;m2-离心后的总质量,g。
1.2.4.2 持油力的测定 称取苜蓿粉0.5 g于15 mL离心管,加4 g植物油,涡旋振荡5 min,37 ℃恒温静置4 h,4000 r/min离心15 min,弃其上层油液,称重[22]。持油力的公式如式(2)所示:
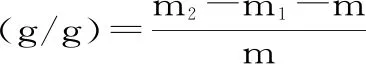
式(2)
式中:m-称取苜蓿粉的质量,g;m1-离心管的质量,g;m2-离心后的总质量,g。
1.2.4.3 膨胀力的测定 称取0.5 g苜蓿粉于10 mL量筒,记录自然堆积时的体积,加水搅拌使粉末完全湿润,冲洗玻璃棒加水至10 mL刻度线,室温环境中密封保存18 h,记录膨胀后体积[23-24]。膨胀力的公式如式(3)所示:
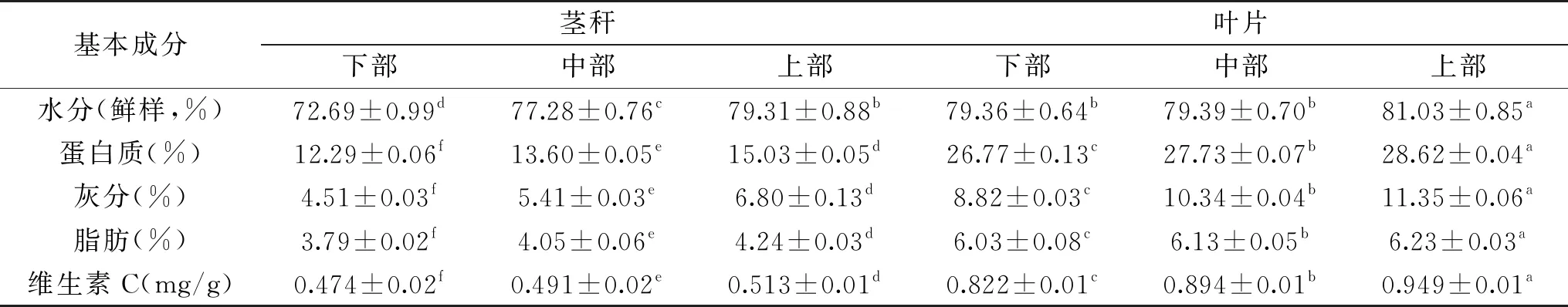
表1 苜蓿不同部位茎叶的基本成分Table 1 Basic compositions of stems and leaves in different parts of alfalfa
注:同一行数字肩上的小写字母不同表示不同部位苜蓿粉的同一指标比较差异显著(P<0.05)。
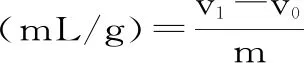
式(3)
式中:m-称取苜蓿粉的质量,g;v0-自然堆积时的体积,mL;v1-样品膨胀后的体积,mL。
1.2.4.4 对亚硝酸钠的吸附能力的测定 亚硝酸钠用分光光度法绘制标准曲线、进行测定[25]。称取0.1 g苜蓿粉于离心管,加10 mL 5.0 μg/mL亚硝酸钠标准溶液,调节溶液pH至7,于37 ℃恒温振荡器中振荡2 h,4000 r/min离心20 min,取1 mL上清液,按上述方法测其含量[26]。改变溶液pH至2,其他条件不变,重复实验。对亚硝酸钠吸附能力的公式如式(4)所示:
式(4)
式中:c0-吸附前亚硝酸钠的浓度,(μg/mL);c1-吸附后亚硝酸钠的浓度,(μg/mL);v-所加亚硝酸钠的体积,mL;m-称取苜蓿粉的质量,g。
1.2.4.5 对胆固醇的吸附能力的测定 参照陆红佳等[27]的方法,绘制标准曲线。蛋黄液的制备:取新鲜鸡蛋一个,蛋清分离后,蛋黄中加500 mL去离子水充分打成乳液,取1 mL样液,按上述方法测其胆固醇含量。
吸附能力的测定:称取0.2 g苜蓿粉于15 mL离心管,加10 mL上述蛋黄液,调节溶液pH至7,充分振荡,于37 ℃恒温振荡器中振荡2 h,4000 r/min离心20 min,取1 mL上清液,按上述方法测其含量。改变溶液pH至2,其他条件不变,重复实验。对胆固醇吸附能力的公式如式(5)所示:
式(5)
式中:m0-所加蛋黄液中胆固醇的总质量,mg;m1-离心后上清液中胆固醇的总质量,mg;m-称取苜蓿粉的质量,g。
1.3 数据处理
所有的结果平行测定3次,Excel 2010进行数据整理,SAS 9.1进行Duncan’s差异性分析(P<0.05),Origin 9.0绘制柱状图。
2 结果与分析
2.1 粉碎粒度对苜蓿茎叶中基本成分溶出量的影响
2.1.1 苜蓿不同部位茎叶基本成分的测定结果 按照1.2.2的方法测定苜蓿不同部位茎叶中水分、灰分、脂肪、蛋白质、维生素C的含量,结果见表1。
苜蓿叶片中蛋白质、灰分、脂肪、维生素C的含量均高于茎秆,且下部、中部、上部的含量依次升高。苜蓿上部叶片的蛋白质含量是28.62%,比下部茎秆高16.33%。苜蓿上部叶片的脂肪含量是6.23%,具有相对较好的口感。苜蓿上部叶片的水分(鲜样)、灰分、维生素C含量分别为81.03%、11.35%、0.949 mg/g。这是由于上部叶片光合作用强、生命活动活跃、代谢旺盛[28]。相比较而言,苜蓿上部叶片具有更高的营养价值。
2.1.2 粉碎粒度对苜蓿叶中蛋白质溶出量的影响 蛋白质是苜蓿的主要营养物质之一,通过2.1.1测定结果可知,上部叶片的含量最高。因此,对不同粉碎粒度的上部叶片中蛋白质的溶出量进行测定与分析,结果见图1。
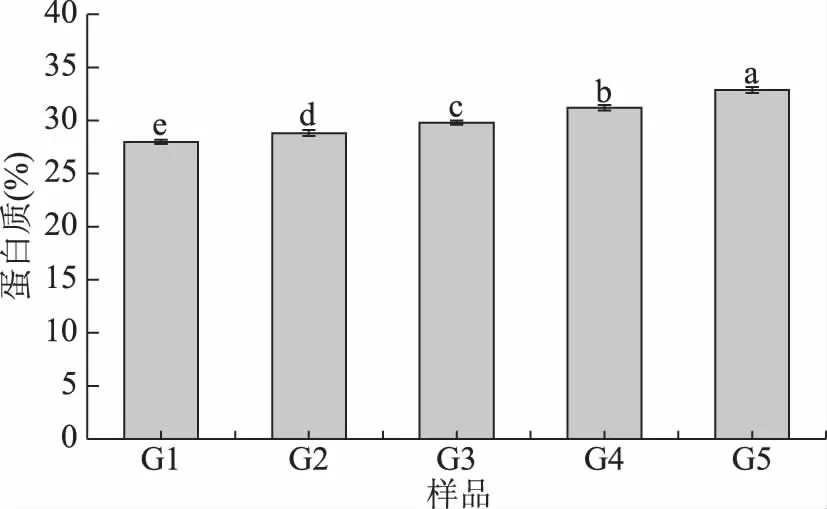
图1 不同粉碎粒度苜蓿叶蛋白质的溶出量Fig.1 Dissolution of protein from alfalfa leaves with different crushing particle size注:不同小写字母表示同一指标各组间 数据差异显著(P<0.05),图2~图6同。
随着粉碎粒度的减小,苜蓿上部叶片中蛋白质的溶出量逐渐增加。当苜蓿叶粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,蛋白质的溶出量由27.98%增加到32.87%。苜蓿叶蛋白质的溶出量增加,这是因为苜蓿叶粉碎粒度减小,组织结构和细胞壁表面结构破坏程度增加,营养物质更容易溶出[29]。因此,推测减小苜蓿叶的粉碎粒度,或可提高苜蓿叶蛋白的消化率。
2.2 粉碎粒度对苜蓿茎叶中活性成分溶出量的影响
2.2.1 苜蓿不同部位茎叶活性成分的测定结果 按照1.2.3的方法测定苜蓿不同部位茎叶中膳食纤维、多糖、多酚、总黄酮的含量,结果见表2。

表2 苜蓿不同部位茎叶的活性成分Table 2 Active constituents from stems and leaves of different parts of alfalfa
注:同一行数字肩上的小写字母不同表示不同部位苜蓿粉的同一指标比较差异显著(P<0.05)。
苜蓿叶中多糖、多酚、总黄酮的含量均高于茎秆,且下部、中部、上部的含量依次升高。上部叶片中多糖、多酚、总黄酮的含量为20.94、12.45、6.47 mg/g,分别是下部茎秆含量的1.95倍、4.00倍、3.99倍。苜蓿叶片的可溶性膳食纤维含量显著高于茎秆,且下部、中部、上部的含量依次升高。上部叶片中可溶性膳食纤维含量高达12.25%,可提供优质的膳食纤维。茎秆中总膳食纤维的含量显著(P<0.05)高于叶片,与豆渣微粉的膳食纤维含量相近[30]。
2.2.2 粉碎粒度对苜蓿叶中活性成分溶出量的影响 通过2.2.1的测定结果可知,上部叶片中多糖、多酚、总黄酮的含量最高。对不同粉碎粒度的上部叶片中多糖、多酚、总黄酮的溶出量进行测定与分析,结果见图2。
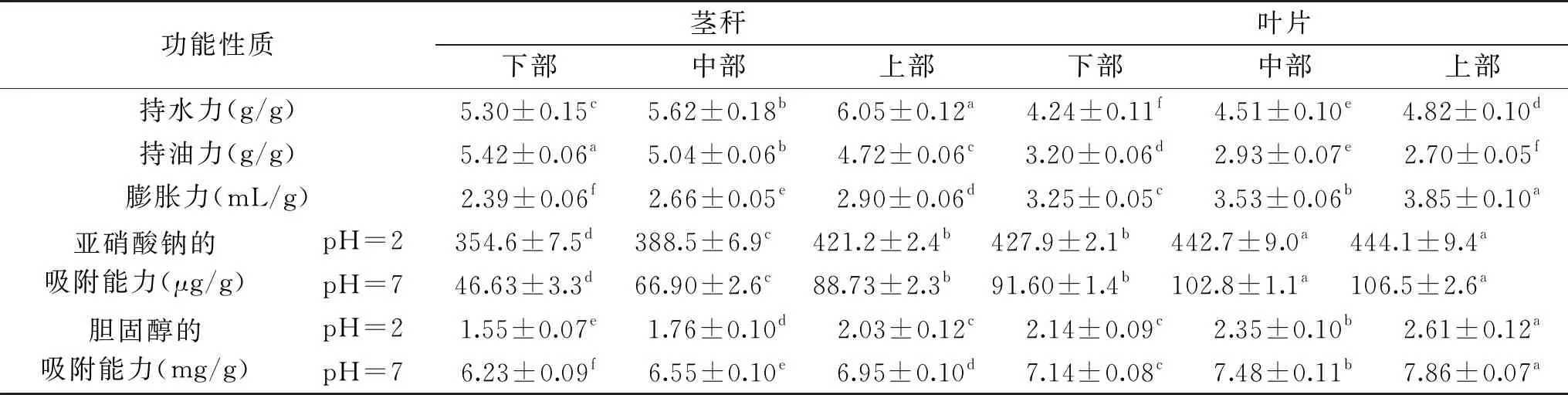
表3 苜蓿不同部位茎叶的功能性质Table 3 Functional properties of stem and leaf in different parts of alfalfa
注:同一行数字肩上的小写字母不同表示不同部位苜蓿粉的同一指标比较差异显著(P<0.05)。
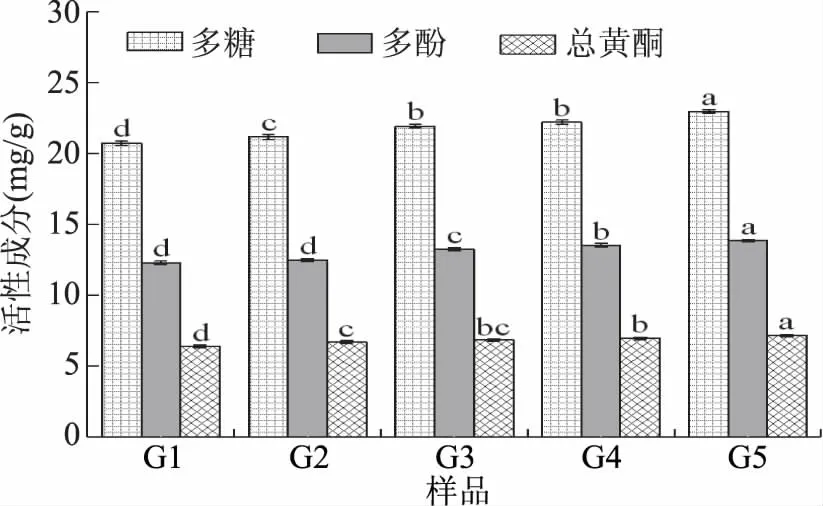
图2 不同粉碎粒度苜蓿叶活性成分的溶出量Fig.2 Dissolution of active ingredientfrom from alfalfa leaves with different crushing particle size
随着苜蓿叶粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,多糖的溶出量由20.72 mg/g增加到22.97 mg/g;多酚的溶出量由12.31 mg/g增加到13.86 mg/g;总黄酮的溶出量由6.42 mg/g增加到7.17 mg/g。粉碎粒度影响了苜蓿叶中活性成分的溶出量,减小粉碎粒度,可提高苜蓿叶中活性成分的溶出量。这是由于苜蓿叶粉碎粒度减小,比表面积增大,表面结构破坏程度增加,接触面积增大,提高了营养物质的溶出量[29]。
2.3 粉碎粒度对苜蓿茎叶功能性质的影响
苜蓿中大量存在的膳食纤维,难以被人体消化吸收。人体食用膳食纤维主要是因为其具有特殊的功能性质。因此,对苜蓿茎叶的功能性质进行研究。
2.3.1 苜蓿不同部位茎叶功能性质指标的测定 按照1.2.4的方法测定苜蓿不同部位茎叶以下功能特性指标,结果如下表3。
苜蓿茎秆的持油力、持水力高于叶片,这是由于茎秆中含有大量的膳食纤维,对水和油脂有较好的吸附作用。苜蓿茎秆下部、中部、上部的持水力依次增加,持油力依次降低。苜蓿叶的膨胀力高于茎秆,上部叶片的膨胀力最高为3.85 mL/g。苜蓿叶对亚硝酸钠和胆固醇的吸附能力高于茎秆,且下部、中部、上部的吸附能力依次增强,这是由于叶片中可溶性膳食纤维含量依次增加[31]。苜蓿叶对亚硝酸钠和胆固醇的吸附能力跟其所在环境的酸碱度有关。苜蓿叶对亚硝酸钠在pH=2环境中的吸附能力是在pH=7环境中的4~5倍,这是由于酸性条件中,含羧基化合物会解离,提高了吸附能力[32]。苜蓿叶对胆固醇在pH=7环境中的吸附能力是在pH=2环境中的3~4倍。苜蓿对有害物质进行吸附,这可能是由于具有粘性的膳食纤维对有害物质进行吸附,内容物体积增加,减少了与肠道的接触,有利于肠道健康[33]。
2.3.2 粉碎粒度对苜蓿叶功能性质的影响 通过2.3.1的测定结果可知,苜蓿叶有较好的膨胀力、对亚硝酸钠和胆固醇的吸附能力,且上部叶片的功能性质最佳。因此,对不同粉碎粒度的上部叶片的膨胀力、对亚硝酸钠的吸附能力、对胆固醇的吸附能力进行测定与分析,结果见图3~图5。
2.3.2.1 膨胀力 随着粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,苜蓿叶的膨胀力先增大后减小,当粉碎粒度为0.125~0.16 mm(G3)时达到最大,为4.40 mL/g。这是由于随着苜蓿叶粉碎粒度减小,表面亲水基团数量增加,使得膨胀力增大。但粉碎粒度过小时,苜蓿叶粉表面的空间结构被破坏,对水分子的束缚力下降,导致膨胀力下降[34]。
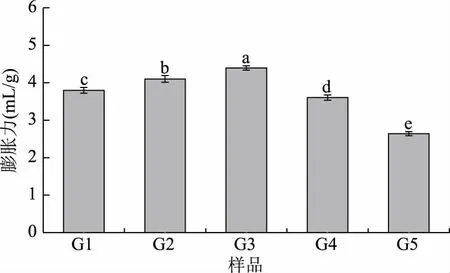
图3 不同粉碎粒度苜蓿叶的膨胀力Fig.3 Swelling capacity of alfalfa leaves with different crushing particle size
2.3.2.2 对亚硝酸钠的吸附能力 随着粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,在pH=2环境中,苜蓿叶对亚硝酸钠的吸附能力由437.91 μg/g逐渐增加到501.51 μg/g。在pH=7环境中,苜蓿叶对胆固醇的吸附能力由106.43 μg/g逐渐增加到108.02 μg/g,差异显著(P<0.05)。这是由于随着粉碎粒度的减小,一方面比表面积增大,更多有效基团暴露出来[35];另一方面粉碎破坏了膳食纤维原有的结构,部分不溶性膳食纤维链状结构断裂转化为可溶性膳食纤维,最终使得吸附能力增加[36]。
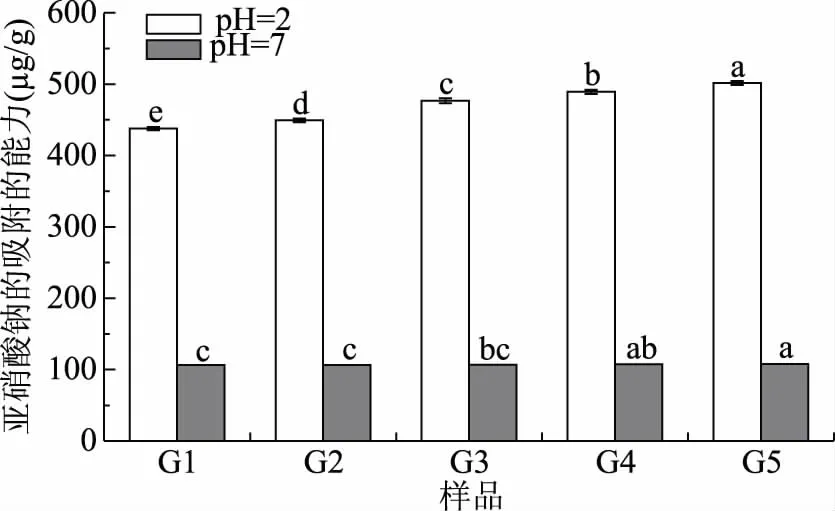
图4 不同粉碎粒度苜蓿叶对亚硝酸钠的吸附能力Fig.4 Adsorption of alfalfa leaves on sodium nitrite with different crushing particle size
2.3.2.3 对胆固醇的吸附能力 随着粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,在pH=2环境中,苜蓿叶对胆固醇的吸附能力由2.45 mg/g逐渐增加到6.01 mg/g。在pH=7环境中,苜蓿叶对胆固醇的吸附能力由7.65 mg/g逐渐增加到9.66 mg/g。这可能是由于粉碎粒度减小,表面有效基团数量增加,苜蓿粉的粘性增加,使得对胆固醇的吸附能力增强[33]。
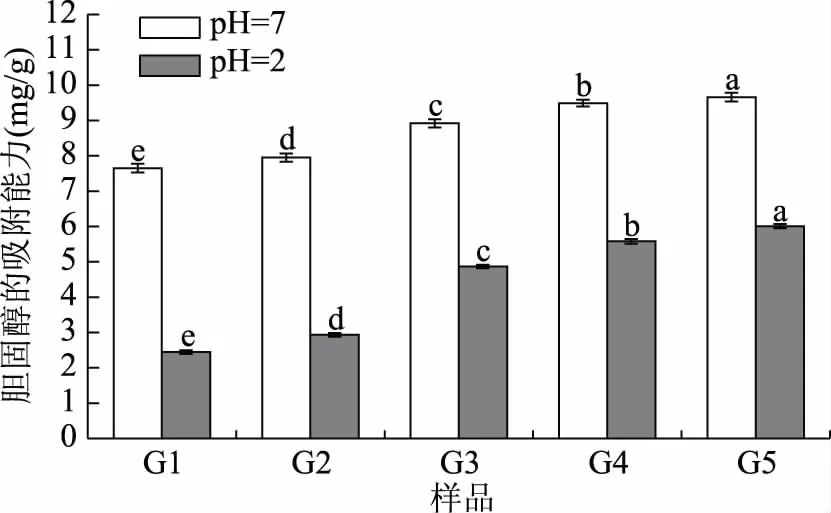
图5 不同粉碎粒度苜蓿叶对胆固醇的吸附能力Fig.5 Adsorption capacity of alfalfa leaves on cholesterol granularity with different crushing particle size
2.3.3 粉碎粒度对苜蓿茎秆功能性质的影响 通过2.3.1的测定结果可知,苜蓿茎秆具有较好的持油力、持水力,且上部茎秆有较好的持水力,下部茎秆有较好的持油力。综合茎叶分离能耗的问题,对不同粉碎粒度上部茎秆的持水力、持油力进行测定与分析,结果见图6。
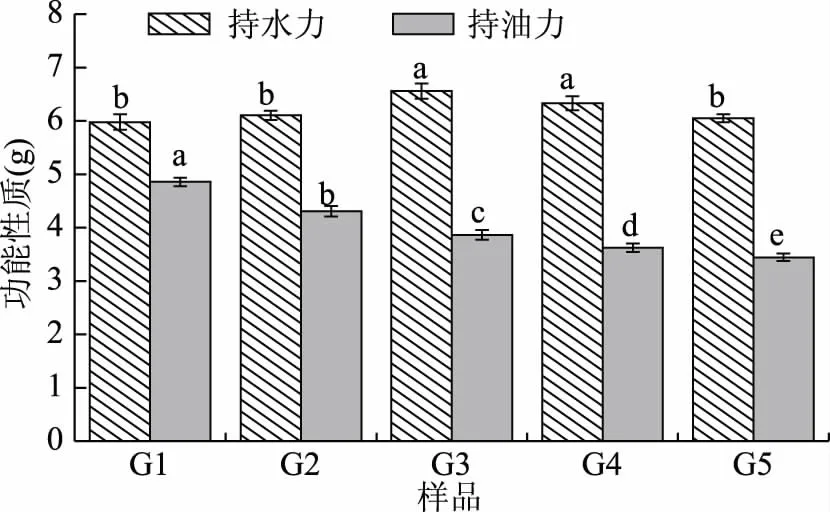
图6 不同粉碎粒度苜蓿茎秆的功能性质Fig.6 Functional properties of alfalfa stems with different crushing particle size
随着粉碎粒度由0.2~0.25 mm(G1)减小到0.063~0.08 mm(G5)时,苜蓿茎秆的持油力由4.86 g/g减小到3.44 g/g;持水力先增大后减小,当粉碎粒度为0.125~0.16 mm(G3)时达到最大,为6.56 mL/g。这是由于粉碎粒度减小,表面细胞组织破坏严重,表面亲水基团数量增加,导致持水力增大,但粉碎粒度过小时,苜蓿粉空间结构被破坏,对水分子的束缚力下降,使得持水力下降[35]。随着粉碎粒度减小,苜蓿粉表面的微孔直径在逐渐减小,进入微孔的油脂分子数量减小,使得持油力下降。
3 结论
苜蓿的基本成分、活性成分含量和功能性质客观上反映其营养价值。通过对苜蓿不同部位基本成分、活性成分、功能性质的比较,客观反映苜蓿不同部位的营养价值。结果表明,苜蓿上部叶片的蛋白质、多糖、多酚、总黄酮等成分含量高,具有较好的膨胀力和吸附特性;上部茎秆具有较好的持水力和持油力。因此,苜蓿的茎叶可分别用于开发不同的功能食品,苜蓿茎秆可用于开发促进肠道蠕动、预防肥胖的食品。苜蓿叶可用于来开发强化营养、预防癌症、吸附有害物质的食品,达到充分利用苜蓿资源的目的。
不同粉碎粒度苜蓿茎叶营养物质的溶出量及功能性质,客观上反映粉碎工艺对苜蓿营养价值的影响。针对苜蓿茎叶营养成分和功能性质的不同,对苜蓿茎叶进行不同程度地粉碎,测定与分析其主要营养成分溶出量及功能性质指标。结果表明,减小苜蓿叶的粉碎粒度可提高蛋白质、多糖、多酚、总黄酮的溶出量,也可提高苜蓿叶对胆固醇、亚硝酸钠的吸附能力。当粉碎粒度为0.125~0.16 mm(G3)时,苜蓿叶的膨胀力,苜蓿茎秆的持水力、持油力达到最佳。将苜蓿茎叶开发成不同功能食品的原料,针对不同的功能食品进行不同程度地粉碎,使其具有更高的营养价值。
通过对测定结果进行分析可推测,对胆固醇、亚硝酸钠的吸附机理与持水力、持油力、膨胀力的机理不同。对胆固醇和亚硝酸钠的吸附能力可能是与苜蓿粉表面的基团数量相关,持水力、持油力、膨胀力可能跟苜蓿粉的空间结构和表面的基团数量相关,具体原因需要进一步验证。本文仅对多糖、多酚、总黄酮的含量进行了测定,未对其抗氧化指标进行测定,日后可对这方面进一步研究。

