丁香酚与丁香醛缩二甲醇联合抗氧化作用研究
方雪祥,袁慧慧,单艳超,蓝闽波
(华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237)
丁香酚(2-allyl-4-methoxyphenol,Eugenol)又名子丁香酚,化学名为2-甲氧基-4-烯丙基苯酚,是植物丁香、丁香罗勒以及樟树属肉桂叶挥发油的主要成分,常温下为黏稠的淡黄色油状液体,呈现出特殊辛辣味和强烈的丁香气息[1]。作为一种天然香料,Eugenol还有很好的抗氧化活性[2-3]。Leopold等[4]发现Eugenol具有与BHA(丁基羟基茴香醚)几乎相等的DPPH·自由基清除能力,在检测羟基自由基清除能力的实验中还发现,Eugenol具有极强的金属螯合能力,大约是同浓度下槲皮素的十倍。因此可以作为一种具有防腐作用、矫味作用和抗氧化作用的食品添加剂[5]、药物辅料和膳食补充剂。同时,Eugenol可通过降低氧化应激水平抑制大鼠肾缺血再灌注性损[6];能提高心肌细胞超氧化歧化酶(SOD)活性,增强清除超氧自由基阴离子能力,阻断脂质过氧化反应,对H2O2诱导的H9C2细胞损伤具有一定的保护作用[7],其抗氧化[8]、抗炎等药理活性也越来越受到广泛关注。

以课题组前期研究[16-17]为基础,在研究天然抗氧化剂的协同作用过程中,我们发现Eugenol和丁香醛(一种香兰素的衍生物,广泛的存在于核桃等植物中[18])在甲醇溶液中久置前后的联合抗氧化作用有明显差异,通过进一步研究发现丁香醛与甲醇反应的产物-丁香醛缩二甲醇(syringaldehyde dimethylacetal(SGD))和Eugenol产生协同抗氧化作用。本文通过研究Eugenol和SGD复配比例对协同抗氧化效果的影响,初步探讨了协同作用机制,为发挥Eugenol优异的抗氧化性能,提供理论依据。
1 材料与方法
1.1 材料与仪器
Eugenol、α-生育酚、无水甲醇 上海阿拉丁生化科技有限公司;二苯代苦味酰自由基(DPPH·) sigma-aldrich公司;SGD 自制,采用Yukihito等[19]报道的合成方法。
Evolution 220紫外可见分光光度计 赛默飞世尔科技(中国)有限公司;UHD Accurate Mass Q-TOF高分辨液质联用仪、1260 Infinity高效液相色谱仪 安捷伦科技(中国)有限公司;A SH-Ⅲ循环水式真空泵 上海羌强仪器设备有限公司;FA2004电子天平 上海良平仪器仪表有限公司。
1.2 实验方法
1.2.1 不同抗氧化剂对DPPH·的清除作用 DPPH·清除实验参照文献[20]的方法,并在此基础上根据实际需要稍作修改。分别取不同浓度的Eugenol,SGD和α-生育酚供试品溶液2.0 mL与2.0 mL 0.1 mmol/L的DPPH·溶液在PE管中充分混合。α-生育酚作为阳性对照,等量的无水甲醇作为空白对照。将混合溶液放入暗处,常温反应30 min,用紫外分光光度计于517 nm处检测其吸光度。DPPH·清除率采用公式1计算:
式(1)
其中A1为供试品溶液在517 nm波长处的吸光度,A0为空白甲醇溶液在517 nm处的吸光度,结果以供试品溶液DPPH·清除率达到50%时的浓度,即IC50表示。IC50值越小表明样品的自由基清除能力越强。
1.2.2 Eugenol与SGD对DPPH·的联合清除作用 以Eugenol和SGD摩尔比为5∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶5,配制复合抗氧化剂,按照1.2.1的方法,测定复合抗氧化剂的DPPH·清除活性。
1.2.3 协同作用分析 等效线分析法(Isobologram)被用于协同抗氧化研究,常用于判断药物之间的相互作用,被看作是评价药物相互作用的“黄金标准”。其中相互作用指数(λ)可用来判断相互作用强度,能为抗氧化剂的最佳配比提供理论依据[21-22]。
式(2)
注:IC50A和IC50B分别表示抗氧化剂A、B单独作用时的IC50值,IC50Amix和IC50Bmix分别表示复合抗氧化剂中A,B的浓度。
如果λ<0.9,表现为协同作用;λ>1.1,表现为拮抗作用;0.9<λ<1.1则为加和作用。而且λ值越小协同作用越强,λ值越大,拮抗作用也越强[23]。
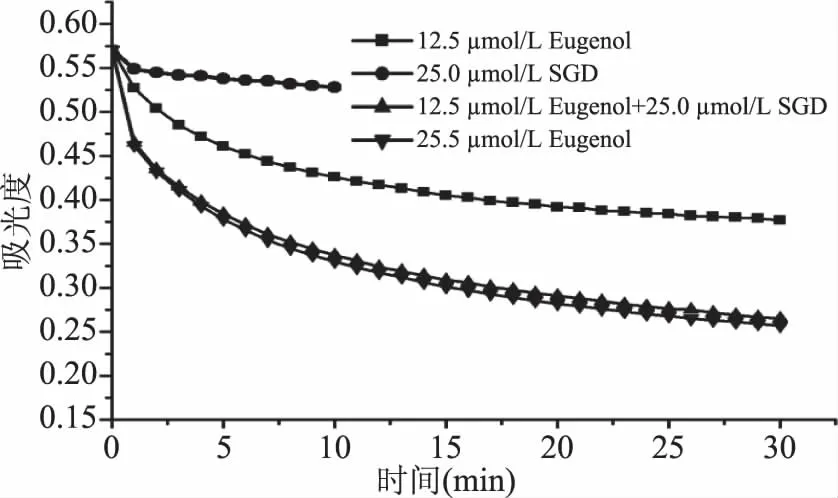
1.2.4 不同抗氧化剂对DPPH·清除效果随时间的变化对比 配制12.5 μmol/L和25.0 μmol/L Eugenol甲醇溶液,25.0 μmol/L和50.0 μmol/L SGD的甲醇溶液。取12.5 μmol/L、25.0 μmol/L Eugenol甲醇溶液、25.0 μmol/L SGD的甲醇溶液、复合抗氧化剂甲醇溶液(含12.5 μmol/L Eugenol和25.0 μmol/L SGD)各2.0 mL分别与2.0 mL 0.1 mmol/L的DPPH·溶液在PE管中充分混合。以等量的无水甲醇作为空白对照。将上述混合溶液放置暗处,常温反应。每隔1 min用紫外分光光度计于517 nm处检测并记录溶液的吸光度,直至吸光度值基本不变。
1.2.5 复合抗氧化剂与DPPH·反应产物分析 供试品制备:配制0.25 mmol/L、0.50 mmol/L Eugenol甲醇溶液和0.50 mmol/L、1.00 mmol/L SGD的甲醇溶液,分别取0.25 mmol/L Eugenol甲醇溶液和0.50 mmol/L SGD的甲醇溶液以及复合氧化剂甲醇溶液(含0.25 mmol/L Eugenol和0.50 mmol/L SGD)各2.0 mL 与2.0 mL 0.1 mmol/L的DPPH·溶液在PE管中充分混合,放置暗处,常温反应30 min,经0.45 μm滤膜过滤,用高效液相色谱仪检测,以Eugenol、SGD和DPPH·三种反应物作为对照。分离纯化复合抗氧化剂与DPPH·反应的关键产物,用高分辨液质联用仪检测。
高效液相色谱条件:流动相为甲醇(A)和水(B);梯度洗脱条件:0~40 min,40%~100% A;检测波长:265 nm;流速:1.0 mL/min;进样体积:10 μL;柱温:30 ℃。
农业科研活动具有内在的特殊性和科技成果的外部性,需要采用适合的评价指标体系。评价体系中引入中长期影响因素,为真实反映出农业科研项目的绩效,笔者认为评价指标中应当包括成果转化效益指标和发展能力指标,以反映中长期影响因素。引入成果转化指标旨在促进科研与市场对接,激励农业科技成果转化,将财政对农业科研经费的投入转化成农业现实生产力的进步。引入发展能力指标,主要是把科研单位整体实力提升纳入评价范围,包括人才培养与流动,条件改善等方面的内容,这将有利于引导科研人员更加关注农业科研项目的长期影响,全面反映农业科研项目的长期效益。
高分辨液质联用仪测试条件。色谱条件:流动相为甲醇(A)和水(B);等度洗脱:甲醇/水(50/50),流速为0.2 mL/min;进样体积1 μL;柱温:30 ℃。质谱条件:ESI正离子检测;离子源350 ℃;干燥气(N2)流速10 L/min,雾化气(N2)气压45 psi;毛细管电压3000 V;一级全扫描(m/z 100~1000)。
1.3 数据处理
所有实验平行测定三次,结果用平均值±标准偏差表示。Statistical Product and Service Solutions 19.0 软件(IBM)对实验数据进行单因素方差分析,检测实验测定的IC50值(IC50 mix)与理论的IC50值(IC50add)之间是否具有显著性差异,如果显著性差异值P<0.05,则二者有显著性差异。
应用Sigmaplot12绘制Isobologram分析图,对复配混合物的联合清除DPPH·能力进行分析。
2 结果与分析
2.1 不同抗氧化剂对DPPH·的清除作用
图1为三种抗氧化剂在不同浓度下(选定的浓度皆为IC50值附近的浓度)对DPPH·清除率。计算得到各抗氧化剂的IC50值分别为:Eugenol:22.23 μmol/L;α-生育酚:23.14 μmol/L;SGD:331.38 μmol/L。可以看出Eugenol抗氧化活性与α-生育酚相当,SGD抗氧化活性较低,仅为前者的十五分之一左右。

图1 Eugenol、SGD和α-生育酚对DPPH·清除能力Fig.1 DPPH free radical scavenging activity of eugenol,SGD and α-tocopherol
2.2 Eugenol与SGD对DPPH·的协同清除作用
表1和图2给出了Eugenol与SGD不同复配比例对协同抗氧化能力的影响。由表1可知,随着复合抗氧化剂浓度的增加,其对DPPH·的清除率也逐渐增大。等效线分析图(图2)可直观地看出在给定的7个比例复配后的抗氧化剂测得的IC50值在等效线分析图上的落点均在理论加和线下方,表明7个比例下复配的复合抗氧化剂都具有协同抗氧化作用[21,24]。
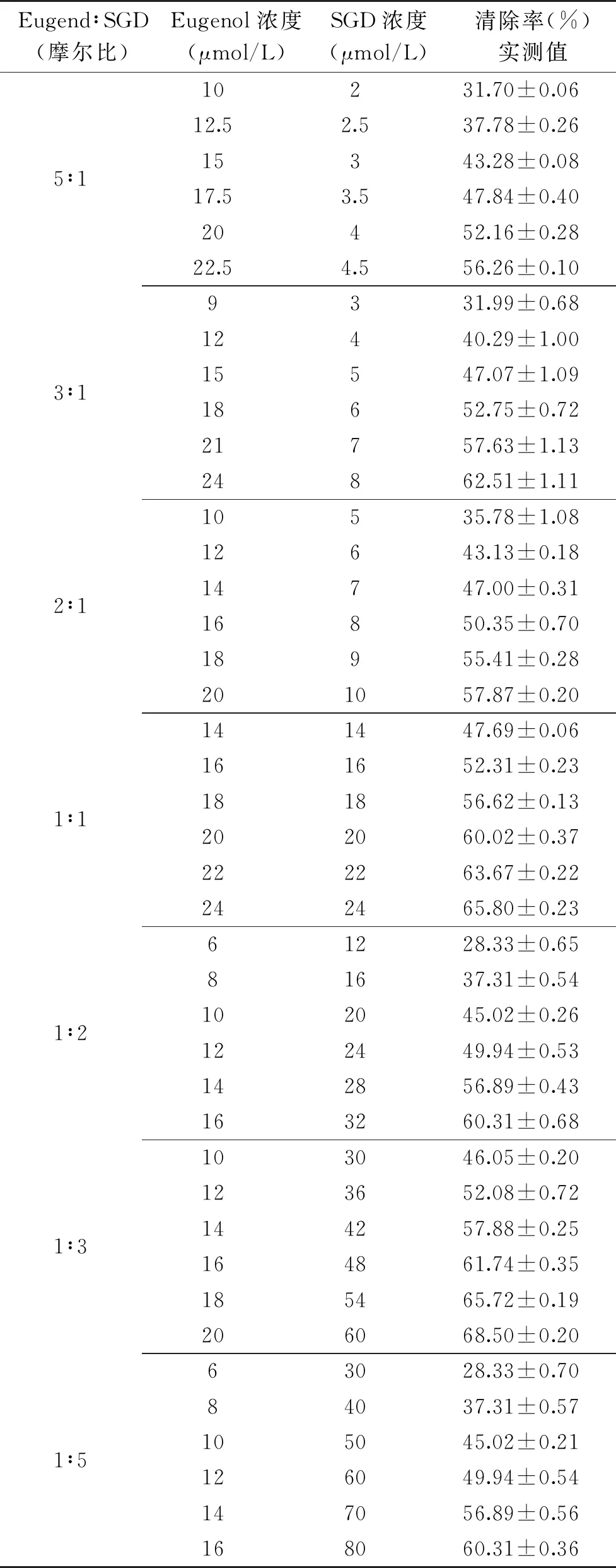
表1 Eugenol与SGD复合抗氧化剂清除DPPH·能力Table 1 DPPH radical scavenging capacity of eugenol and SGD composite antioxidants
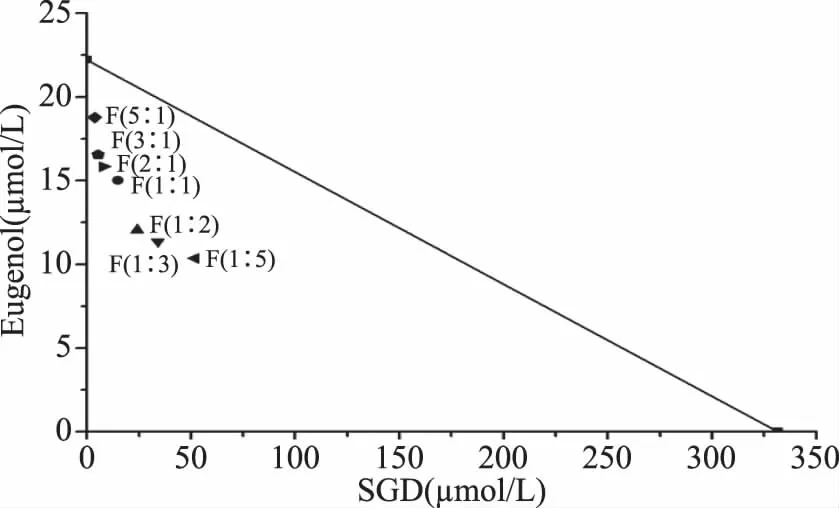
图2 Eugenol和SGD联合抗氧化的等效线分析图Fig.2 Isobolograms for the interaction of eugenol and SGD注:F(5∶1)、F(3∶1)、F(2∶1)、F(1∶1)、F(1∶2)、F(1∶3)、 F(1∶5)在图中分别表示Eugenol与SGD浓度的比例为 5∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶5。
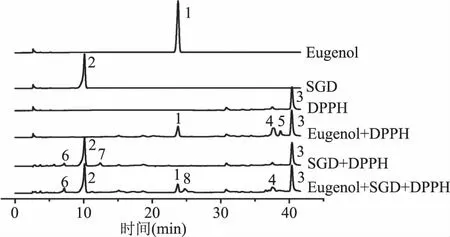
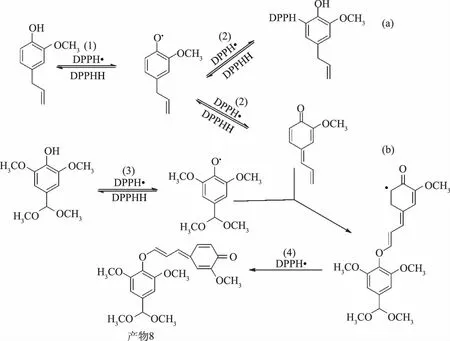
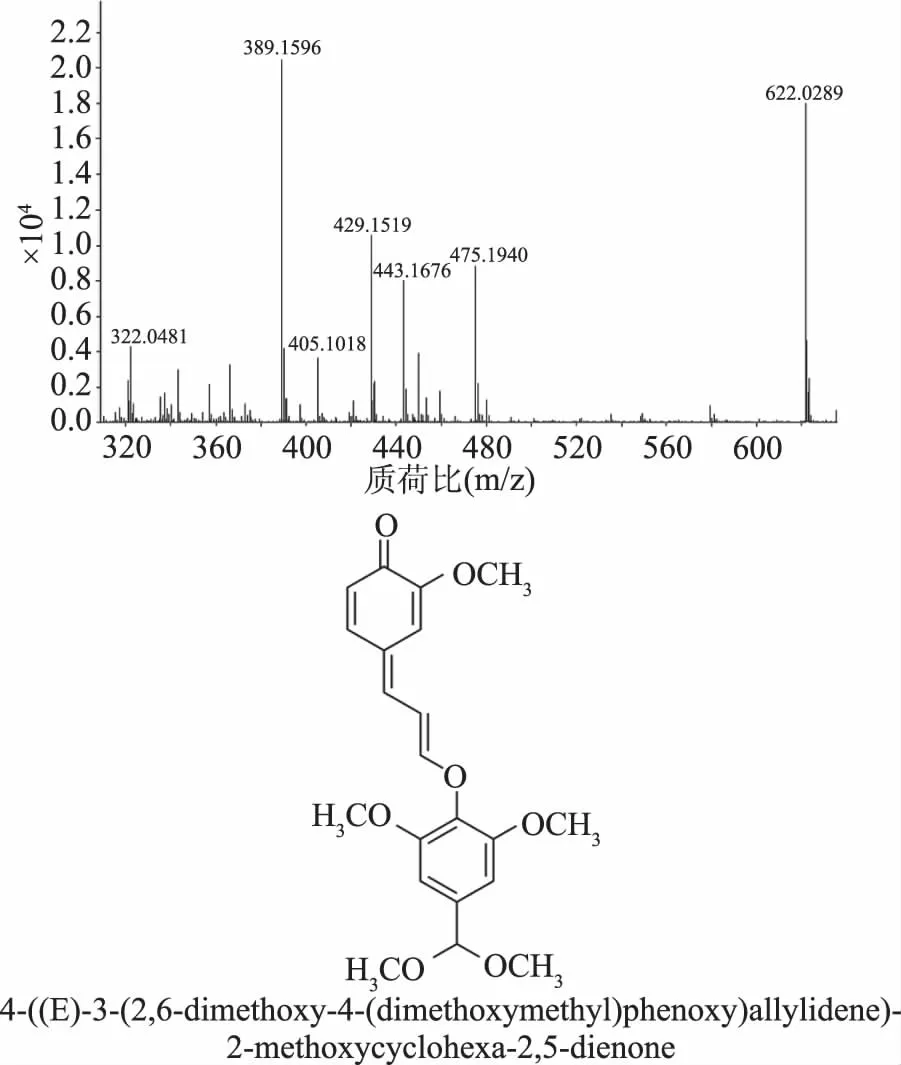
采用t检验对IC50 add和IC50 mix进行统计比较,若IC50 mix 表2 不同配比Eugenol和SGD的IC50及λTable 2 Experimental,theoretical IC50 and the interaction index values for eugenol and SGD with different ratio 注:与IC50add对比***P<0.001,**P<0.01,and*P<0.05。 Eugenol与SGD复配比例在1∶2和1∶3时,其λ值相当且最小,考虑增加SGD的量对协同作用贡献度不大,因此认为Eugenol和SGD比例为1∶2时具有最佳的协同抗氧化作用。 图3 单一和复合抗氧化剂与DPPH· 反应吸光度(517 nm)随时间的变化Fig.3 Absorbance change of DPPH· scavenging assay at 517 nm in the presence of single or combined antioxidant 为了进一步探究协同作用机制,采用HPLC对Eugenol,SGD以及两者的复合抗氧化剂与DPPH·反应的产物进行了分析,出峰情况如图4。 图4 单一以及复合抗氧化剂 与DPPH·反应产物的HPLC谱图Fig.4 HPLC chromatogram of the products of DPPH· radical scavenging reactions in the presence of single or combined antioxidant 图4中1和2号峰分别为Eugenol和SGD的信号峰。通过对比未加任何抗氧化剂的DPPH·的HPLC谱图,可推断4、5为Eugenol单独与自由基反应的主要产物,而SGD单独与自由基反应活性低,产物较多且生成量少,从图谱上看主要有6、7产物峰。8号产物峰只出现在复合抗氧化剂清除自由基的反应中,从而可以推断8号产物可能与Eugenol和SGD协同抗氧化作用有关。且通过对比单一抗氧化剂和复合抗氧化剂与DPPH自由基反应产物,可以明显的看出复配后,各单一抗氧化剂原有的自由基反应产物4、5、7等有了不同程度的减少甚至消失,这可能与复合抗氧化剂与自由基反应机制发生改变,更多的向着生成新产物8的方向进行。 图6 推测的协同反应机制Fig.6 Possible synergistic antioxidant mechanism of eugenol and SGD on DPPH· scavenging 将8号产物分离富集后进行高分辨质谱分析,正离子模式下质谱图信号为389.1596。通过对反应可能生成的产物以及分子量的精确计算,最后得出了该化合物可能的结构式如图5所示,命名为:4-((E)-3-(2,6-二甲氧基-4-(二甲氧甲基)苯氧基)烯丙亚基)-2-甲氧基环己-2,5-二烯酮。该化合物在正离子模式下的理论准确分子量为389.1595,与质谱图信号389.1596相差0.0001。 图5 产物8的高分辨质谱图(m/z 300~640) 及可能的分子结构式Fig.5 High resolution mass spectrum(m/z 300~640) and possible molecular structure of the product 8 根据质谱分子量信息推测的分子结构以及文献报道,推导出可能的反应机制如图6。Bondet等[25]的报道,Eugenol单独与DPPH·反应,主要有a,b两个途径,这两种途径都是一分子的Eugenol清除两分子的DPPH·。而复合抗氧化剂中SGD与DPPH·的反应活性虽然很低,但其与DPPH·反应后所得SGD自由基能与b途径生成的醌类化合物反应,所得产物可再与一分子的DPPH·反应生成产物8。因此复合抗氧剂中一分子Eugenol清除DPPH·沿着醌类产物途径,将消耗四分子的DPPH·,其清除能力约为单一Eugenol抗氧化剂的2倍,这与2.3中得出的结果吻合。 研究采用DPPH·清除法和等效线分析法评价了Eugenol与SGD在不同比例复配下抗氧化的相互作用,发现在测试的比例下两者均表现出显著的协同抗氧化作用,最佳协同比例为Eugenol∶SGD 1∶2。采用HPLC分析复合抗氧化剂与DPPH·的反应产物,发现并分离得到了产物8,结合其高分辨质谱分子量等信息,推测出产物8为4-((E)-3-(2,6-二甲氧基-4-(二甲氧甲基)苯氧基)烯丙亚基)-2-甲氧基环己-2,5-二烯酮,从而推导出复合抗氧剂的协同抗氧化机理,反应中可消耗醌类产物,且其抗氧化能力相当于单一Eugenol抗氧化能力的2倍,因此使用复合抗氧剂,不仅可以减少Eugenol的用量,从而避免其高浓度下促氧化的风险,还可减少醌类物质所引起的细胞毒性,从而极大地提高了Eugenol在抗氧化方面的应用。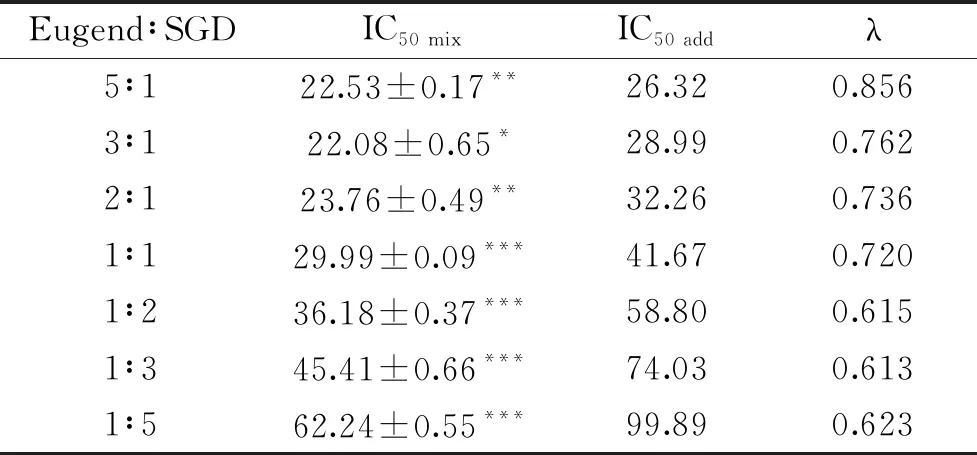
2.3 不同抗氧化剂对DPPH·的清除效果随时间的变化
2.4 单一和复合物抗氧化剂与DPPH·反应的产物分析
2.5 反应机制推导
3 结论

