TRPM7通过STAT3途径参与IL-6诱导的肝细胞增殖
崔志华,方 玲,李玲玲,蔡诗怡,夏 泉,许杜娟,
肝脏是人体内唯一具有强大再生能力的实质性器官。各种物理、化学、生物等因素均可导致肝脏疾病的发生,如果不及时治疗可能会进一步导致肝纤维化、肝硬化乃至肝癌。肝再生能力不足是晚期肝病的一个共同特征,因此深入探究肝再生的分子机制对于提高患者的总体生存率具有非常重要的临床意义。M型瞬时受体电位通道7(transient receptor potential melastatin 7,TRPM7)是一种具有离子通道和激酶双功能的膜蛋白,参与调节多种生理功能和病理进程。课题组前期研究发现TRPM7参与肝星状细胞(hepatic stellate cells, HSC)的活化和增殖[1],而在肝再生及肝细胞(hepatocytes, L-02)增殖中的作用未被报道。该研究通过经典的70%肝切除术(partial hepatectomy, PHx)肝再生模型及建立白细胞介素-6(interleukin 6, IL-6)诱导L-02 细胞的模型,探讨TRPM7是否参与肝细胞增殖,为治疗肝再生能力不足提供一个可能的治疗靶点。
1 材料与方法
1.1 材料
1.1.1细胞系 人正常肝细胞系L-02购自中科院上海细胞库,由安徽医科大学第一附属医院实验室液氮冻存保种。
1.1.2实验动物 取8~10周龄雄性普通级昆明(KM)小鼠80只,体质量28~30 g,由安徽医科大学实验动物中心(中国合肥)提供。整个饲养过程采用标准的啮齿类动物饲料和水,自由摄取。动物实验方案经安徽医科大学动物护理和使用委员会批准。
1.1.3主要试剂 重组人IL-6细胞因子购自美国Peprotech公司;2-氨基乙酯二苯基硼酸(2-Aminoethoxydiphenyl borate,2-APB)和TRPM7单克隆抗体购自美国Abcam公司;信号转导因子和转录激活因子3 (signal transducers and activators of transcription 3, STAT3)和磷酸化-STAT3(p-STAT3)单克隆抗体购自美国CST公司;β-actin和增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)单克隆抗体购自中国Elabscience公司;四甲基偶氮唑蓝(MTT)购自美国Sigma公司;丙氨酸氨基转移酶(alanine aminotransferase, ALT)及天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)检测试剂盒购自中国南京建成生物工程研究所。
1.1.4主要仪器 二氧化碳培养箱(型号:Forma311)、酶标仪(型号:Mulikan MK3)购自美国Thermo公司;超净工作台(型号:SW-CI-2F)购自苏州安泰空气技术有限公司。
1.2 方法
1.2.1PHx肝再生模型 小鼠称重后,用异氟烷吸入麻醉,用剪刀在上腹部中线靠近剑突位置打开约2 cm的切口,常规消毒后,用剪刀剪开腹膜,打开腹腔,用棉签将肝脏钝性分离,移除其左前、左后及右前叶。再用棉签润湿腹膜,缝合手术切口,最后清洁并进行皮肤消毒,将小鼠置于干净的鼠笼待其自然苏醒。
1.2.2HE染色 小鼠取部分肝脏组织,置于10 %中性甲醛固定24 h。依次进行脱水、透明、浸蜡、包埋、切片、展片、捞片、烘干、脱蜡水合之后在苏木精-伊红中染色至适当颜色深度,流水冲洗,随后进行脱水透明化,中性树胶封片,显微镜下观察肝脏病理变化情况并拍照。
1.2.3ALT/AST测定 收集PHx术后不同时间点小鼠全血,分离血清,取5 μl待测样本加入已预温至37 ℃的基质液中反应30 min,然后进一步与2,4-二硝基苯肼液反应20 min,最后加入200 μl氢氧化钠终止反应,轻轻水平摇动96孔板混匀,室温放置15 min,510 nm波长,酶标仪测各孔光密度(optical density,OD)值。
1.2.4细胞培养 使用含10 % 胎牛血清、双抗(青霉素100 IU/ml、链霉素100 mg/L)的RPMI-1640培养基(美国Hyclone公司)进行培养。置于 37 ℃、5% CO2培养箱中贴壁培养,细胞在对数生长期时用胰酶消化传代。
1.2.5MTT测定 细胞按7 500个/孔的密度接种于96孔板,给予TRPM7通道抑制剂2-APB(0、25、50、100、200、400 μmol/L)作用12 h终止反应。将细胞培养物与5 mg/ml MTT在37 ℃下孵育4 h。孵育完成后,小心吸出培养基并向每个孔中加入150 μl DMSO溶解甲瓒晶体。用酶标仪测量492 nm处的吸光度。
1.2.6Western blot分析 用Ripa裂解缓冲液裂解小鼠肝脏组织和L-02细胞。通过使用BCA蛋白质定量试剂盒测定蛋白质浓度。通过10% SDS-PAGE分离蛋白质样品,然后转移至PVDF膜。在室温下用5%脱脂牛奶封闭2 h,TBST洗净后,将膜在4 ℃下与一抗(1 ∶1 000)孵育过夜。 一抗孵育后,将膜在TBS/Tween-20中洗涤3次,然后在室温下与二抗(1 ∶5 000)一起温育1 h。运用ECL显影发光拍照,然后通过ImageJ软件分析。

2 结果
2.1 PHx肝再生模型建立成功为探讨PHx肝再生模型是否建立成功,运用HE病理染色及ELASA检测PHx术后肝再生过程中ALT和AST酶变化水平。 HE结果显示:PHx术后可见组织增生,细胞体积变大,增生的肝细胞索排列有不同程度的紊乱,并伴有炎性细胞的浸润(见图1A)。ELASA结果显示:ALT酶蛋白水平在术后上升,并在12 h达到高峰,而后逐渐降低至正常水平,差异有统计学意义(F=6 347,P<0.05)。见图1B。AST酶蛋白水平出现相同趋势且差异有统计学意义(F=1 991,P<0.05)。见图1C。
2.2 PHx术后肝再生过程中TRPM7、PCNA的蛋白表达变化为观察TRPM7是否参与PHx术后的肝再生进程,运用Western blot法检测PHx术后不同时间点TRPM7及细胞增殖指标PCNA蛋白表达变化。Western-blot结果显示:PCNA蛋白水平在PHx术后上升,36 h达到高峰,差异有统计学意义(F=59.08,P<0.05)。见图2A。TRPM7的蛋白水平同样在术后上升并且持续至72 h,差异有统计学意义(F=16.77,P<0.05)。见图2B。
2.3 IL-6对L-02细胞增殖的影响及对TRPM7的蛋白表达影响为进一步观察TRPM7是否参与肝细胞增殖过程,运用重组人IL-6体外刺激L-02细胞增殖,Western blot法检测TRPM7蛋白表达变化。MTT结果表明:与空白对照组相比,IL-6刺激组细胞活力上升,差异有统计学意义(F=10.37,P<0.05)。见图3A。IL-6最佳刺激时间为12 h,差异有统计学意义(F=16.61,P<0.05)。见图3B。Western blot结果显示:与对照组TRPM7蛋白含量(1.635±0.061)比较,当使用最佳的IL-6刺激浓度(10 ng/ml)刺激12 h时,刺激组TRPM7的蛋白含量(1.872±0.061)水平升高,差异有统计学意义(P<0.05)。见图3C。
2.4 2-APB预处理对IL-6诱导L-02细胞增殖的影响为进一步探讨阻断TRPM7通道对L-02细胞增殖的影响,给予TRPM7抑制剂2-APB(0、25、50、100、200、400 μmol/L)后,观察对IL-6诱导L-02细胞增殖的影响。MTT结果表明:与IL-6刺激组比较,共培养组细胞活力下降,并且在一定的范围内抑制作用呈浓度依赖性,差异有统计学意义(F=552.7,P<0.05)。见图4。

图1 HE病理染色及ELASA法检测PHx术后不同时间点ALT及AST酶蛋白变化水平 HE×200
A:PHx术后肝再生过程中不同时间点HE病理染色情况;B:PHx术后肝再生过程中ALT酶蛋白变化水平;C:PHx术后肝再生过程中AST酶蛋白变化水平;与0 h比较:***P<0.001
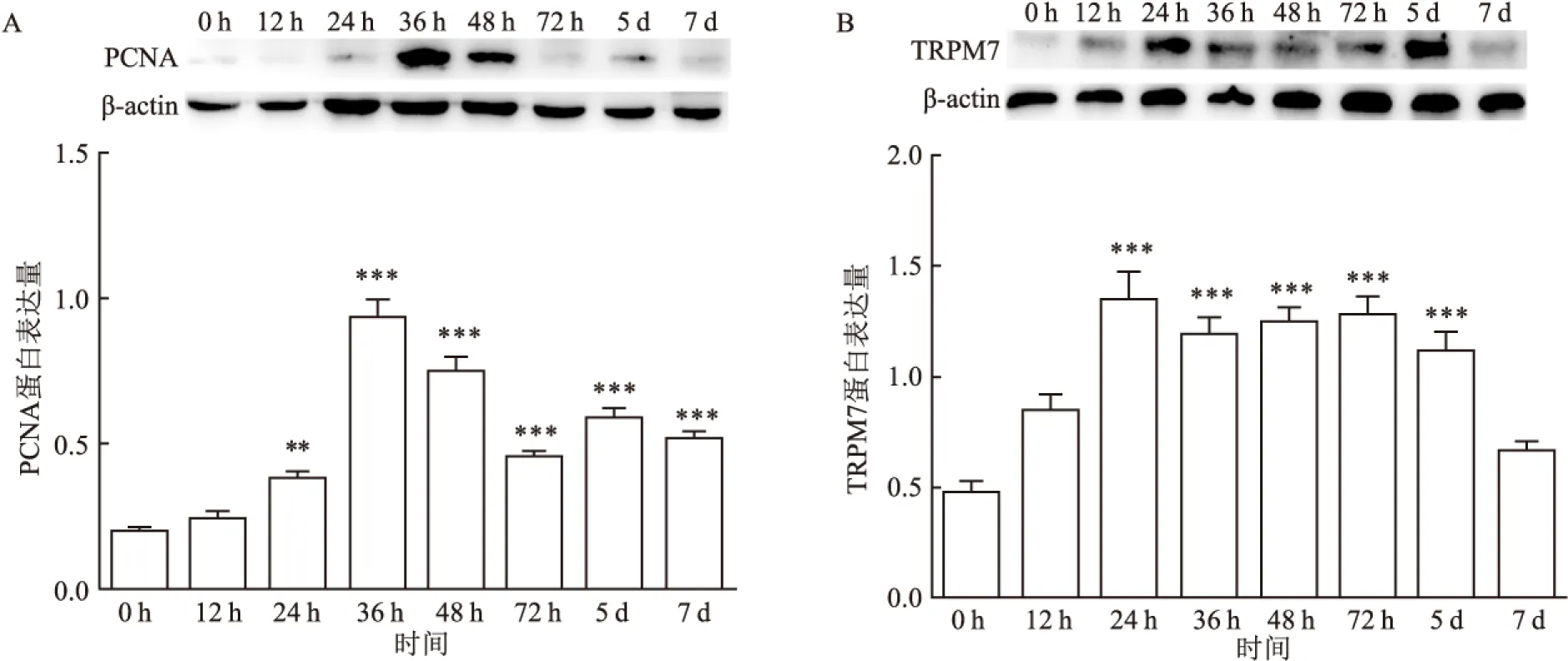
图2 Western blot 法检测PHx术后不同时间点TRPM7及PCNA蛋白的表达水平
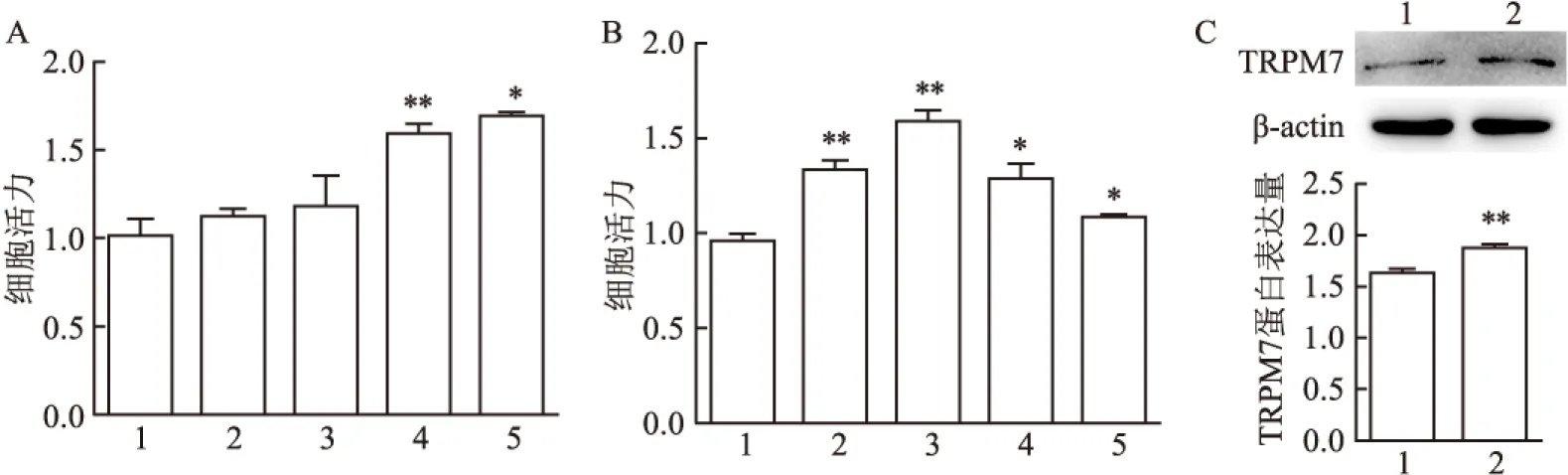
图3 IL-6刺激下L-02细胞活力变化及TRPM7蛋白表达情况
A:IL-6刺激下细胞活力具有浓度饱和性;1:空白对照组;2:IL-6 2.5 ng/ml 组;3:IL-6 5 ng/ml 组;4:IL-6 10 ng/ml 组;5:IL-6 20 ng/ml 组;B:IL-6刺激下细胞活力不具有时间依赖性;1:空白对照组;2:IL-6 刺激6 h 组;3:IL-6 刺激12 h 组;4:IL-6 刺激24 h 组;5:IL-6 刺激48 h 组;C:TRPM7蛋白的Western blot结果;1:空白对照组;2:IL-6 刺激组;与空白对照组比较:*P<0.05;**P<0.01
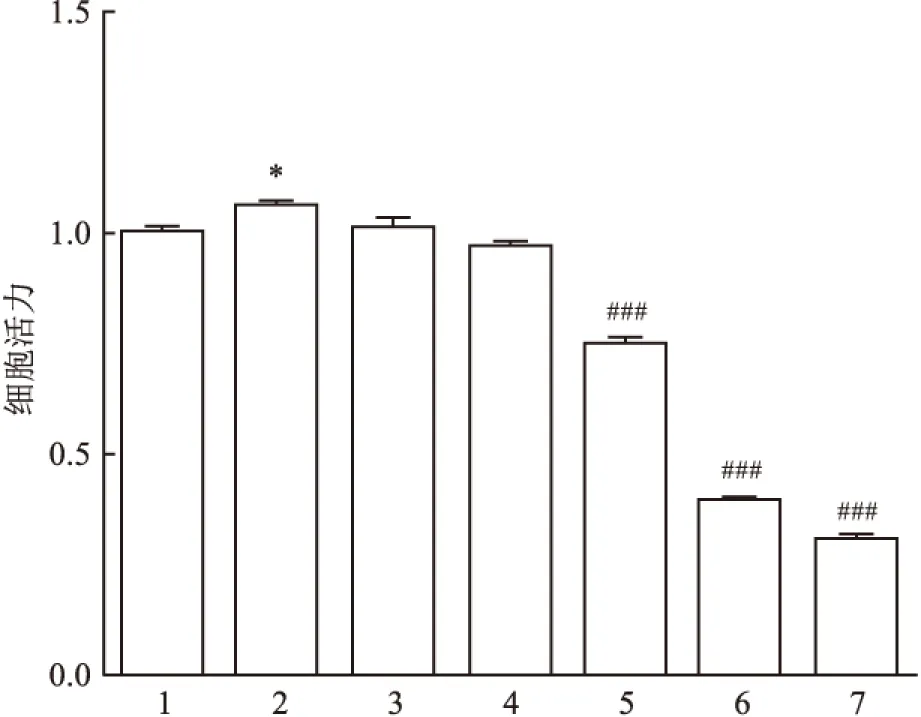
图4 MTT法检测2-APB与IL-6共培养刺激L-02细胞12 h时细胞活力变化
1:空白对照组;2:IL-6刺激组;3:IL-6+25 μmol/L 2-APB组;4:IL-6+50 μmol/L 2-APB组;5:IL-6+100 μmol/L 2-APB组;6:IL-6+200 μmol/L 2-APB组;7:IL-6+400 μmol/L 2-APB组;与空白对照组比较:*P<0.05;与IL-6刺激组比较:###P<0.001
2.5 2-APB预处理对L-02细胞中PCNA蛋白表达的影响为进一步揭示阻断TRPM7通道之后抑制IL-6诱导细胞活力上升的原因,运用Western blot法检测PCNA蛋白水平的变化。Western blot结果显示:与空白对照组比较,IL-6刺激组的PCNA蛋白水平上升,差异有统计学意义。而与IL-6刺激组比较,IL-6与2-APB共培养组的PCNA水平下降且差异有统计学意义(F=84.59,P<0.05)。见图5。
2.6 2-APB预处理对L-02中STAT3蛋白表达的影响为探讨阻断TRPM7通道之后抑制IL-6诱导细胞活力上升的可能作用通路,运用Western blot法检测p-STAT3蛋白水平的变化。Western blot结果显示:与空白对照组比较,IL-6刺激组的STAT3的蛋白水平未发生变化而p-STAT3的蛋白水平上升,且差异有统计学意义。而与IL-6刺激组比较,IL-6与2-APB共培养组STAT3的蛋白水平未发生变化,而p-STAT3的蛋白水平下降,且差异具有统计学意义(F=23.98,P<0.05)。见图6。
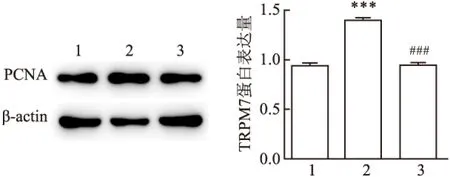
图5 Western-blot法检测IL-6、2-APB作用L-02细胞12 h时对PCNA蛋白表达的影响
1:空白对照组;2:IL-6刺激组;3:IL-6+2-APB组;与空白对照组比较:***P<0.001;与IL-6刺激组比较:###P<0.001
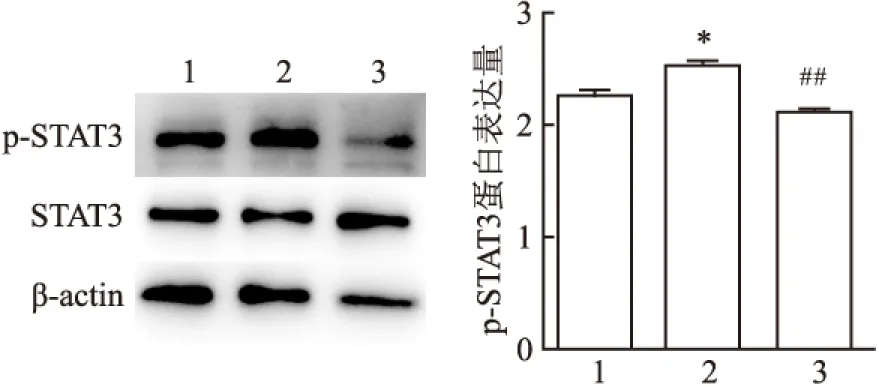
图6 Western-blot法检测IL-6、2-APB作用L-02细胞12 h时对STAT3、p-STAT3蛋白表达的影响
1:空白对照组;2:IL-6刺激组;3:IL-6+2-APB组;与空白对照组比较:*P<0.05;与IL-6刺激组比较:##P<0.01
3 讨论
TRPM7是TRP家族的一员,也是第一个被发现具有离子通道和激酶双功能的膜蛋白。作为一种非选择性的阳离子通道,其主要介导细胞内Ca2+和Mg2+离子的内流,其中Ca2+是被广泛认知的细胞内第二信使,在细胞增殖、迁移中扮演着重要的作用[2]。此外,作为一种具有丝氨酸/苏氨酸结构区域的蛋白激酶,其可使自身或底物磷酸化,同样在细胞增殖中扮演着重要的作用。研究[3-4]显示TRPM7在多种肿瘤中过表达并且与肿瘤细胞增殖息息相关,并且与较差的临床预后相关[5]。而目前TRPM7在肝再生领域研究较少。本研究显示TRPM7蛋白水平在肝再生过程中增加并且与增殖指标蛋白PCNA水平具有一致性,表明TRPM7可能参与肝再生进程,过表达TRPM7可能成为治疗晚期肝再生能力不足的新靶点。
小鼠PHx切除模型是目前用于肝再生研究最广泛的模型[6],由于其是一种无基础肝病的模型,因此肝再生过程中并不伴随着大量的炎症和坏死。本实验HE染色及ALT、AST酶蛋白水平变化结果同样说明PHx之后短时间会出现低强度的炎症反应,随着肝再生进程的推移,肝脏逐渐恢复原来的生理功能。研究[7]表明,IL-6在肝再生早期启动阶段中扮演重要的作用,作为一种促炎因子,其可激活下游的JAK/STAT3信号通路促进肝细胞的增殖[8],并且有研究[9]表明体外利用重组的IL-6可以直接刺激鼠原代肝细胞的增殖。本实验利用重组的人IL-6刺激L-02细胞建立肝细胞增殖模型,观察TRPM7蛋白表达是否发生变化,结果显示体外使用重组人IL-6可以诱导L-02细胞活力上升,并且IL-6刺激组TRPM7蛋白水平表达升高,说明TRPM7可能参与肝细胞增殖过程。2-APB作为经典的TRPM7通道阻断剂,其可抑制TRPM7样电流,本实验利用2-APB阻断TRPM7通道,发现其可逆转IL-6诱导的L-02细胞活力的上升,并且IL-6与2-APB共培养组相较于IL-6刺激组其p-STAT3水平下降,表明TRPM7参与IL-6诱导的肝细胞增殖可能是通过STAT3通路实现的。
综上所述,本研究证实了TRPM7参与IL-6诱导肝细胞增殖的过程,阻断TRPM7通过减少STAT3蛋白磷酸化水平抑制肝细胞增殖。本研究不足之处在于未运用腺相关病毒构建TRPM7敲低小鼠验证TRPM7对肝再生进程的影响。在接下来的实验中会深入探讨TRPM7参与PHx术后肝再生的详细机制。

