细胞微丝骨架在NDV诱导肺癌细胞凋亡中的作用
谢晓娟,金 燕,王 静,兰金苹,武彩霞,刘 宇,刘开扬
肺癌是当前全球发病率及死亡率排名前列的恶性肿瘤,对于肺癌的控制与治疗已成为全社会普遍关注的问题[1]。溶瘤病毒治疗肿瘤以其副作用小、疗效显著被研究者普遍接受[2]。新城疫病毒(newcastle disease virus, NDV)属于溶瘤病毒的一种[3],对人类的正常细胞无杀伤作用但对肿瘤细胞具有特异性的杀伤作用[4-5],课题组在前期的研究中发现,NDV HBNU/LSRC/F3株(NDV F3)对于一些消化道肿瘤细胞[6-7]有明显的诱导凋亡作用,而此凋亡过程是否与细胞关键结构微丝骨架相关尚未见报道。鉴于NDV为呼吸道病毒,该研究应用NDV F3株感染非小细胞肺癌NCI-H1299细胞,以期探究NDV对NCI-H1299细胞的影响及其与细胞微丝骨架的关系。
1 材料与方法
1.1 材料人非小细胞肺癌细胞株NCI-H1299及NDV F3株由河北北方学院生命科学研究中心分子病毒室保存。RPMI-1640基础培养基、胰酶及细胞松弛素D(Cytochalasin D)购自美国Gibco公司;胎牛血清购自上海ExCell Bio公司;CCK-8试剂盒购自日本同仁公司;Annexin V/PI双染色法凋亡试剂盒及Matrigel胶购自美国BD公司;抗体GAPDH购自武汉ABclonal公司;F-actin、RhoA、ROCK2、P-MYPT1及辣根过氧化物酶标记二抗购自北京博奥森公司;Transwell 3422购自美国康宁公司;流式细胞仪购自美国BD公司;扫描电镜购自日本日立公司。
1.2 方法
1.2.1细胞培养 NDV F3原液复感染指数(multiplicity of infection, MOI)值为100,将RPMI-1640培养基维持液稀释的NDV F3,稀释为不同MOI值(MOI=10、1、0.1、0.01、0.001、0.000 1、0.000 01);NCI-H1299细胞用含10%胎牛血清的RPMI-1640培养基在5%CO2、37 ℃的培养箱中培养,当细胞长至瓶底近80% 时,实验组加入0.5 ml RPMI-1640基础培养基稀释的NDV F3(MOI=1)感染的尿囊液,吸附1 h,加RPMI-1640基础培养基4.5 ml,使MOI最终为0.1。阴性对照组加入同样方式稀释的正常尿囊液。3个重复,培养至12、24、36、48、60 h 5个时相点,观察拍照。
1.2.2扫描电镜下观察不同药物及病毒作用后微丝骨架等超微结构改变 细胞爬片,调整细胞浓度为1×104/ml,待细胞长至对数生长期,实验组加入1 ml NDV F3(终浓度为MOI=0.1);阴性对照组加入1 ml正常尿囊液;阳性对照组加入浓度为10 mg/ml的5-氟尿嘧啶(5-Fluorouracil, 5-FU);Cytochalasin D组加入浓度为5 μmol/ml Cytochalasin D,培养24 h。设3个重复。24 h后加入戊二醛固定4 h,PBS洗3次,每次10 min。梯度乙醇脱水,叔丁醇置换2次,每次10 min,干燥、喷金后观察并拍照。
1.2.3CCK-8法检测NDV对NCI-H1299细胞增殖能力的影响 选取对数生长期的细胞,胰酶消化离心计数为1×104个/ml,种入96孔板,每孔200 μl,培养不同时相点,加入RPMI-1640无血清培养基稀释的不同MOI的NDV F3 200 μl(MOI= 1、0.1、0.01、0.001、0.000 1、0.000 01),对照组加入200 μl同样稀释方式的正常尿囊液,设3个重复,培养至各时相点后加入20 μl CCK-8试剂,4 h后,酶标仪450 nm波长下检测其OD值。
抑制率(%)=(1-OD实验组/OD对照组)×100%
1.2.4流式细胞仪检测NDV对NCI-H1299细胞凋亡的影响 取对数生长期NCI-H1299细胞,对照组为正常细胞,实验组加入NDV F3(终浓度为MOI=0.1),分别培养12、18、24 h后收集细胞并离心,冷PBS洗2次,计数至1×104个/ml。按Annexin V/PI双染色法凋亡试剂盒说明书操作,检测凋亡率。
1.2.5Western blot 检测NDV对NCI-H1299细胞蛋白表达的影响 取对数生长期细胞实验组加入NDV F3(终浓度MOI=0.1),培养24 、36、48 h后提取蛋白,对照组为正常细胞,根据蛋白定量结果加入样品。经过电泳、转膜、用5%奶粉封闭1 h、加入一抗4 ℃过夜、洗膜、加入二抗室温孵育2 h、再洗膜、检测拍照。GAPDH为内参使用Image J软件分析条带的灰度值。
1.2.6细胞划痕试验观察细胞感染病毒对其迁移能力的影响 细胞消化离心后计数至1×104/ml,接种于6孔板中,每孔2 ml,培养24 h, 待细胞进入对数生长期后,用RPMI-1640基础培养基洗3次,对照组用10 μl枪头在孔中心划一道直线,RPMI-1640培养基洗3次,对照组加入正常尿囊液;NDV-F3组加入终浓度MOI为0.1的NDV F3;5-FU组加入浓度为10 mg/ml的5-FU,培养48 h。分别在0、48 h拍照,每组设3个平行孔,测量两侧细胞间划痕距离,比较各组间划痕愈合的差异。
1.2.7Transwell试验观察病毒感染细胞后对其迁移能力的影响 Matrigel胶融化后用RPMI-1640基础培养基按1 ∶3稀释。Transwell板提前预冷,每孔加入50 μl稀释后的Matrigel胶,37 ℃放置1 h。细胞接种前用RPMI-1640基础培养基培养12 h去除血清对其影响,细胞消化离心计数至1×104个/ml,用MOI为0.1的NDV重悬细胞,每个小室中加入200 μl重悬细胞,下室加入含10%胎牛血清的RPMI-1640基础培养基,培养48 h后,PBS洗2次,多聚甲醛固定15 min,PBS轻洗1次,棉签轻轻擦去小室内的细胞,结晶紫染色20 min,PBS洗3次,风干后拍照。

2 结果
2.1 NDV感染人非小细胞肺癌NCI-H1299后细胞形态、数量及状态的改变对照组正常NCI-H1299细胞贴壁情况佳,形态正常,呈典型的上皮细胞型,铺石状,各细胞间边界清晰,有折光性;NDV感染12 h后,细胞折光性变差, 包浆中出现颗粒状物质,细胞间隙模糊;感染24 h后,细胞失去正常形态,细胞间隙更加模糊,细胞融合现象明显,瓶中出现悬浮死细胞,细胞失去折光性;感染36 h后,随感染时间的增加,胞浆中颗粒性物质增多,贴壁细胞逐渐减少,培养液中可见大量死细胞及细胞碎片;感染48 h后,死细胞进一步增多;感染60 h时,视野下几乎全为悬浮的死细胞和细胞碎片。见图1。
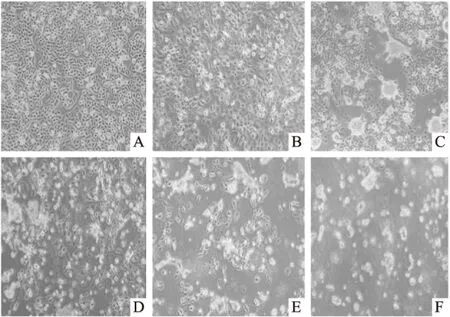
图1 普通倒置显微镜观察NDV感染NC1-H1299后细胞形态 ×100
A:对照组细胞;B:NDV F3感染细胞12 h;C:NDV F3感染细胞24 h;D:NDV F3感染细胞36 h;E:NDV F3感染细胞48 h;F:NDV F3感染细胞60 h
2.2 扫描电镜观察结果结果显示NDV与Cytochalasin D、5-FU都对细胞微丝骨架有极大的破坏作用。阴性对照组正常NCI-H1299细胞微绒毛纤长,包覆于整个细胞表面,细胞间界限清晰,细胞表面结构正常。NDV F3作用后,相邻细胞间的界限模糊甚至消失,细胞微绒毛变短,部分发生膨大甚至出现脱落断裂;微丝解聚阳性对照Cytochalasin D处理组细胞出现微绒毛的脱落断裂,细胞间间隙模糊,并且细胞表面出现空洞;阳性对照5-FU处理组细胞表面微绒毛脱落,表面粗糙。见图2。

图2 扫描电镜观察细胞 ×4 000
A:对照组细胞;B:NDV F3感染细胞24 h;C:Cytochalasin D 作用24 h;D:5-FU作用24 h
2.3 CCK-8法结果NDV F3对NCI-H1299细胞有显著的抑制作用,其作用呈浓度和时间的依赖性递增。其中NDV F3(MOI=0.1)抑制作用最佳,与阴性对照组比较,差异有统计学意义(P<0.05)。见图3。

图3 NDV感染NCI-H1299细胞后抑制率的影响与对照组比较:*P<0.05
2.4 流式细胞术分析早期凋亡结果NDV可诱导NCI-H1299细胞凋亡,病毒感染12 h,凋亡率为(8.20±2.36)%;感染18 h,凋亡率为(14.27±1.00)%;感染24 h,凋亡率为(18.3±0.56)%。与对照组(0.21±0.11)%相比,差异有统计学意义(P<0.01)。见图4。

图4 流式细胞仪检测NDV作用后NCI-H1299细胞凋亡的影响
A:对照组;B:NDV F3感染细胞12 h;C:NDV F3感染细胞18 h;D:NDV F3感染细胞24 h;E:凋亡率柱状图;与对照组比较:**P<0.01
2.5 Western blot蛋白表达结果结果发现NCI-H1299细胞随感染NDV F3(MOI=0.1)时间的延长,RhoA、ROCK2、F-actin、P-MYPT1蛋白表达水平均发生下调(P<0.05),F-actin及RhoA蛋白表达在24 h时出现明显下降,而ROCK2及P-MYPT1蛋白表达在36 h时出现明显下降。见图5。
2.6 细胞划痕试验结果NDV F3组细胞迁移率为(0.091±0.729)%;5-FU组细胞迁移率为(0.135±0.005)%;与对照组细胞迁移率(0.351±0.029)%比较,差异有统计学意义(P<0.01)。NCI-H1299感染NDV F3后其划痕愈合速度与对照组相比明显减慢,迁移率与对照组及5-FU组相比显著降低,并且NDV F3对NCI-H1299细胞迁移作用的影响比抗癌药物5-FU更显著。见图6。
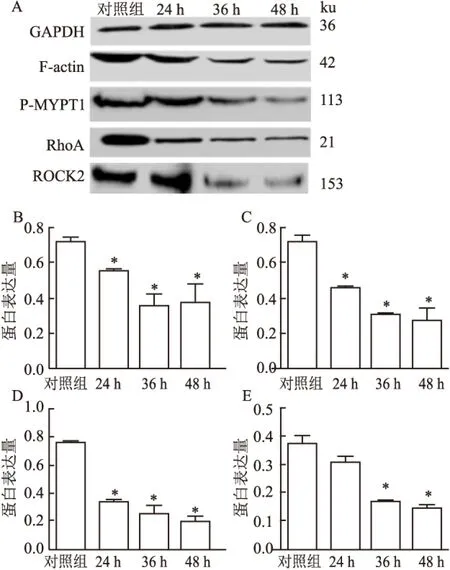
图5 Western blot分析NCI-H1299细胞F-actin、P-MYPT1、RhoA、ROCK2蛋白表达
A:蛋白表达结果;B:F-actin;C:P-MYPT1;D:RhoA;E:ROCK2;与对照组比较:*P<0.05

图6 划痕试验结果
A:各组细胞划痕后间距变化×100;B: 各组细胞划痕后迁移率;与对照组比较:**P<0.01
2.7 Transwell试验结果对照组穿膜细胞较多,感染NDV F3后穿膜细胞减少,迁移细胞数降低。见图7。

图7 Transwell试验结果 结晶紫染色 ×100与对照组比较:**P<0.01
3 讨论
微丝骨架为支撑细胞形态和促进细胞运动的关键结构,调控细胞的运动、分裂、摄粒和排粒,并且影响轴突的物质运输。其结构呈纤维网状,主要由微管、中等纤维、微丝等结构组成。近年研究[8-9]发现,微丝骨架与细胞凋亡关系密切,骨架的主要成分微丝、微管出现解聚或聚合异常以及中间丝的结构破坏,都会导致凋亡的发生。细胞发生凋亡时,细胞骨架内的结构会发生变化,细胞骨架重组,形成凋亡微管网及凋亡小体,影响肿瘤的侵袭与转移。有学者在研究HL-60细胞微丝骨架时发现,微丝的解聚与细胞凋亡有关[10]。
RhoA/ROCK信号通路与微丝骨架改变关系密切,它主要与F-actin结构的形成相关,主要过程为RhoA与GTP酶结合后,活化下游的ROCK(ROCK1和ROCK2结构域近90%同源性),进一步磷酸化相同底物:肌球蛋白轻链(MLC)和肌球蛋白磷酸酶亚基1(MYPT1),从而造成一些效应分子的改变,形成微丝、伪足等F-actin结构[11]。RhoA/ROCK信号通路在调节细胞骨架蛋白的降解、合成、收缩和移动方面发挥着重要的作用,也与细胞骨架的重建、细胞极性的改变有着密切的关系,并影响肿瘤基因的变化[12]。其中RhoA与应力纤维及黏着斑的形成有关并影响微丝骨架的组建。有研究[13]表明,RhoA在乳腺癌中呈现高表达状态。ROCK是Rho蛋白重要的下游效应器,介导下游MLC及MYPT1磷酸化水平,从而影响肌动蛋白、肌球蛋白的交联程度以及肌动蛋白微丝骨架的聚合来调控细胞迁移、形态改变,微丝骨架重组等多种生物学行为。有学者在研究膀胱癌患者中发现,RhoA与ROCK的表达与肿瘤的级别成正相关[11],RhoA与ROCK都能够影响微丝骨架的形成与重组,进而影响肿瘤细胞的增殖和迁移,并且MYPT1的磷酸化水平与他们活性成正相关。F-actin为微丝蛋白的多聚体,它的重组影响着细胞的形态以及运动、迁移。F-actin结构破坏,使得细胞间的连接减少,信号的传递功能减弱;应力纤维受损,使得细胞抵御外界压力的能力降低,影响细胞的生长[14]。该研究表明RhoA、ROCK2、F-actin、P-MYPT1蛋白表达水平均发生下调。这些蛋白表达的下调可能因为随着NDV F3作用时间的延长,抑制RhoA与ROCK2蛋白活性,造成其表达发生下调,从而影响下游的MYPT1的磷酸化,造成其磷酸化水平降低,进一步影响应力纤维、微丝等F-actin结构的形成,使得F-actin表达降低。此结果证实了NDV F3诱导NCI-H1299细胞凋亡可能与RhoA/ROCK通路有关。
F-actin结构的组成与细胞形态以及细胞运动、迁移有着密切关系,通过形态学观察病毒感染后细胞表面结构及超微结构发现,细胞结构发生明显改变,出现细胞微绒毛发生膨大断裂等现象,这种改变可能由于NDV F3株破坏细胞微丝结构,造成内部结构消失而形成。使用CCK-8法及流式细胞术检测到NDV F3株对NCI-H1299有抑制及诱导凋亡的作用。F-actin改变不仅与细胞凋亡相关,也可影响肿瘤细胞侵袭迁移能力,其中基质金属蛋白酶类发挥着重要的作用,它能够分解细胞外基质,使得细胞更容易侵袭和转移,通过在细胞小室中加入人工细胞外基质,观察通过小室的细胞数,检测细胞的侵袭能力,结果发现NDV F3具有抑制NCI-H1299细胞侵袭迁移的作用。

