超声胃镜联合腹腔镜在胃间质瘤手术中的应用分析
(武汉科技大学附属普仁医院胃肠外科,湖北 武汉 430000)
胃间质瘤是一种起源于胃壁固有肌层或黏膜肌层的潜在恶性肿瘤,常导致出血、糜烂等并发症。随着腹腔镜技术的发展,腹腔镜下胃间质瘤楔形切除已在各级医院广泛开展[1-2]。但因肿瘤位于肌层,腹腔镜对于较小的病灶定位困难,而部分患者通过普通胃镜仅能观察到胃腔隆起性改变,甚至不能发现异常,无法明确肿瘤累及层次和深度,导致手术进行困难[3-5]。为了弥补腹腔镜及普通胃镜的劣势,本研究采用超声胃镜联合腹腔镜的方法,可术中评估手术可切除性及判断病变确切起源、性质,对肿瘤侵犯深度和范围准确定位,在尽量保留正常组织的基础上确保肿瘤的完整切除,并由此探讨超声胃镜在胃间质瘤微创手术中的应用及临床价值。
1 资料与方法
1.1 临床资料
回顾性分析我院2015年1月至2019年6月78例在超声胃镜联合腹腔镜下行胃间质瘤手术患者的临床资料,其中男36例,女42例,年龄35~78岁,平均68.3岁。临床症状主要表现为上腹痛25例(32.1%),贫血35例(44.9%),辅助检查发现无临床症状者18例(23.0%)。肿瘤位于胃底15例,胃体55例,胃窦8例。术前均行超声胃镜检查,提示胃黏膜下隆起性病变,所有肿瘤直径均不超过5 cm,边界清楚,表面无破溃。纳入标准:①术后经病理证实为胃间质瘤;②既往无上腹部手术病史;③肿瘤为单发病灶,直径不超过5 cm;④三维医学影像检查示肿瘤未侵犯胰腺、脾及邻近周围重要器官、血管;⑤术前无肿瘤感染、坏死导致发热,肿瘤破溃出血等急诊症状,手术均为择期进行。
排除标准:①胃癌;②既往有胃手术史;③术前辅助检查提示肿瘤多发及大于5 cm;④三维医学影像检查提示肿瘤有坏死、破溃;⑤出血、侵犯周围器官及重要血管导致切除困难;⑥肿瘤上界距离贲门不超过2 cm。本研究已通过本院医学伦理委员会审批,所有患者均签署手术知情同意书。
1.2 方法
1.2.1 围手术期管理 所有患者均按加速康复外科理念进行围手术期管理,术前行血常规、生化全套、凝血相+D-二聚体等血液检查,常规行心电图、心脏彩超、腹部彩超、上腹部增强CT+三维医学影像等检查,均行超声胃镜检查,提示胃黏膜或肌层下隆起性病变,部分患者合并黏膜表面浅溃疡,内镜活检病理确诊2例(2.6%)。手术均由同一组经验丰富的外科医生和内镜医生完成,术中严格遵循肿瘤治疗原则,确保肿瘤切除完整切缘阴性,避免破损及细胞脱落腹腔。
1.2.2 双镜联合手术 患者取仰卧大字位,术者站双腿中间,超声胃镜位于患者左侧头部,常规于脐上10 mm以Trocar建立气腹并做观察孔,分别于中线左右两侧建立4个操作孔,穿刺孔一定要分开,不能太靠近,避免形成“筷子效应”。术中先在超声胃镜引导下于肿瘤黏膜下及环周注射美兰,肿瘤位于胃体前壁者用腔镜下切割吻合器直接楔形切除;位于胃后壁者先游离胃结肠韧带,将胃后壁翻起后切除。如肿瘤靠胃食管交界处、幽门及贲门较近楔形切除困难,则先采用内镜黏膜下剥离术将病损分离至黏膜下层,超声胃镜准确定位下切掉病损环周3/4或者1/2肌层和浆膜层,最后用腹腔镜来完成剩下病损全层的切除和胃壁的缝合。切缘距肿块至少2 cm,切除吻合后超声胃镜检查胃腔无出血、狭窄及吻合口瘘,注水判断吻合口牢固程度。术毕,取上腹正中小切口经标本袋取出标本。
1.3 术后及随访
术后3~5 d禁食水,予抑酸、静脉营养支持治疗,早期进食进行肠内营养,定期复查血常规、生化、腹部彩超、CT检查。出院后随访6~24个月,观察患者有无胃肠道梗阻、排空功能障碍、复发等并发症。
1.4 统计学分析
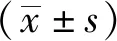
2 结果
本组78例患者均在腹腔镜联合超声胃镜下顺利完成胃间质瘤切除术,无中转开腹病例,肿瘤均完整切除。内镜操作时间5~15 min,平均(10.3±4.7)min,手术时间35~120 min,平均(72.8±18.2)min。胃肠道功能恢复时间15~37 h,平均(23.2±6.5)h,住院时间6~16 d,平均(8.5±2.3)d,术中无大出血、邻近重要器官损伤。
所有患者均于术后第2天拔除胃管,无胃腔出血、梗阻、穿孔、吻合口瘘、严重心脑血管意外等严重并发症及死亡病例。术后标本直径1~5 cm,平均(2.9±0.8) cm,均经病理及免疫组化证实,标本切缘无肿瘤组织残留。术后随访6~24个月,复查胃镜及腹部CT示无胃腔梗阻或梗阻,未发现肿瘤局部复发和远处转移,1例患者因冠心病而非手术因素死亡。
3 讨论
胃间质瘤是以梭形细胞和/或上皮样细胞为主的发生在胃肠道的最常见间叶组织来源肿瘤,占胃肠道肿瘤的1%~2%,以胃为最多见部位,占50%~70%[3],多起源于胃固有肌层,少数起源于黏膜肌层,既可形成胃腔内息肉样肿块,也可形成向腔外生长的浆膜下肿块,部分患者普通胃镜下腔内无肉眼可见异常[4]。常见症状有腹痛、消化道出血、腹部包块等,但绝大多数患者无明显症状,不易发现确诊。由于胃间质瘤具有非定向分化和潜在恶性的生物学特征,可引起患者贫血及上消化道出血,故及时手术治疗完整切除肿瘤尤为重要[5]。
传统胃间质瘤开放手术适用于肿瘤直径较大、位置特殊、难以采用腹腔镜或者胃镜手术治疗的患者,但存在手术创伤大、风险大、恢复慢等缺点,通常此类患者先口服伊马替尼,待病灶控制后限期手术[6]。消化内镜技术治疗胃间质瘤主要有内镜下黏膜剥离术、内镜下全层切除术,其缺点是容易产生消化道穿孔、出血等并发症,对术者要求高,学习曲线长[7]。胃间质瘤因很少淋巴结转移,扩大切除并不能明显改善预后,无需行淋巴结清扫,尤其适用于腹腔镜微创手术,其中应用最广泛的腹腔镜楔形切除术被认为是胃间质瘤的标准术式。有研究认为,为了减少腹腔镜手术的并发症,确保手术安全,对于肿瘤直径在5 cm以上的胃间质瘤,不宜使用腹腔镜手术治疗[8]。但也有研究认为,在内镜技术快速发展的背景下,肿瘤直径已不再是约束腹腔镜手术应用的不利因素,若能够合理应用内镜,坚持相应的手术操作要求和原则,对于肿瘤直径在5 cm以上的胃间质瘤患者,腹腔镜技术同样可以应用[9]。
因腹腔镜手术自身的局限性,常需要其他手段来对肿瘤进行定位,尤其对于腔内型肿瘤未侵透浆膜层的患者,胃体外壁与正常无异,不易准确定位切缘,且术后也无法判断胃腔内情况[10]。但是目前常用的普通胃镜仅能观察到胃腔隆起性改变,对于肿瘤未累及黏膜者甚至不能发现异常[11]。因此,本研究选择腹腔镜与超声胃镜相结合,可以很好地避免单一技术的劣势,不仅能准确定位肿瘤并能直视术中判断肿瘤累及层次和浸润范围,在尽量保留正常组织的基础上保证肿瘤的完整切除,避免因瘤体破裂引起的种植转移,同时还可以避免腹腔镜看不到的并发症,如肿瘤切除不完整、腔内出血、胃腔狭窄等。双镜联合应用充分发挥了两者的优势,在微创基础上最大程度拓宽了手术适应范围,提供了更合理的治疗模式[12-13]。
本研究认为,超声胃镜与普通胃镜相比较的优势在于,超声胃镜可更清晰地识别肿瘤组织部位及层次,判定肿瘤浸润深度,直视引导下使术者能最大限度地保留正常胃壁组织,保护胃的正常生理功能,避免术后出现管腔狭窄,在肿瘤完整切除后可再次行超声胃镜检查,充分评估吻合口有无出血、狭窄、误损伤等情况。胃食管交界处、幽门及贲门周围等部位肿瘤腹腔镜下吻合器操作困难,强行切除可能导致狭窄等严重并发症,针对这类不适合楔形切除部位的肿瘤,本研究选择先内镜再腹腔镜的方式。灵活机动地选择合适的手术方式是保证微创、根治及手术顺利完成的基础[14]。
2011年版我国胃肠间质瘤诊断治疗专家共识认为直径小于或等于5 cm的间质瘤应在有经验的中心进行腹腔镜切除,而2016年的美国胃间质瘤治疗指南未对肿瘤直径明确限制,仅指出如果肿瘤位置较好,可实施腹腔镜手术[15]。但随着微创技术及内镜诊疗水平的迅猛进展,本研究认为,超声胃镜联合腹腔镜手术治疗胃间质瘤尤其适用于以下几种情况:腹腔镜探查胃外壁难以找到肿瘤者;胃小弯或胃后壁者;瘤体靠近幽门或贲门者。
综上所述,超声胃镜联合腹腔镜治疗胃间质瘤能结合两者的优势,扬长避短,用微创的方法为患者提供最合理有效的治疗。随着内镜缝合技术的进步和设备的优化,消化内科与胃肠外科的界限已被打破,相信随着手术经验的积累和水平的提高,内镜下手术技术会在胃肠道疾病中有更广泛的应用前景。
