重组人源TNC诱导胰腺癌细胞系PANC1的EMT及迁移和侵袭
蔡 隽,沈文远,王 慧,谭 珵,赵秀梅,沈啸洪*
(1.天津市医药科学研究所 肿瘤药物研发中心,天津 300020;2.南开大学 医学院,天津 300071;3.天津医科大学总医院 骨科,天津 300052)
胰腺癌(pancreatic cancer)是一种发病隐匿、进程快、预后极差的恶性肿瘤,发病率呈逐年增长趋势,成为威胁人类健康的重要因素[1]。胰腺癌主要临床病理特征是肿瘤细胞周围存在着大量的纤维组织以及丰富的细胞外基质(extracellular matrix,ECM)成分,ECM的作用机制研究是近年来的研究热点。肌腱蛋白C(tenascin-C,TNC)作为一种重要的ECM成分,在胰腺癌组织及其浸润边缘高表达,并与胰腺癌转移和预后差密切相关[2-3],但目前TNC分子对胰腺癌转移作用的分子机制尚未明确,而且大多数对TNC生物学作用的研究常局限于TNC分子的外源合成或敲除,对TNC过表达的研究较少。本研究拟采用独特的PCR引物设计方法,构建重组人源TNC的真核表达质粒,并建立稳定过表达TNC的胰腺癌细胞系PANC1-TNC,检测分析其细胞迁移、侵袭能力以及上皮间质转化(epithelial mesenchymal transition,EMT)相关标志物的表达,以探讨TNC在胰腺癌转移过程中的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系、质粒及菌株:人胰腺癌细胞系PANC1(中国科学院典型培养物保藏委员会细胞库);pBS-HxB.L质粒(Addgene #65414)(北京中原合聚经贸有限公司);真核表达载体pCMV6-Entry(OriGene公司);菌株E.coliDH5α感受态细胞(北京全式金公司)。
1.1.2 试剂及试剂盒:Ex Taq酶、限制性内切酶KpnⅠ、EcoRⅤ及T4连接酶(大连宝生物有限公司);质粒小提及纯化试剂盒(Axygen公司);G418(Sigma Aldrich公司);RNA提取试剂盒、反转录试剂、SYBR和LipofectamineTM2000(Invitrogen公司);Transwell小室(BD公司);抗TNC抗体、辣根过氧化物酶标记(HRP)的羊抗鼠抗体和HRP标记的羊抗兔抗体(Santa Cruz公司),抗β-actin、E-cad和N-cad抗体(CST公司)。
1.2 方法
1.2.1 人TNC基因的引物设计与合成:根据NCBI数据库中人TNC基因的序列信息,使用Oligo7.0软件进行引物设计。在上下游引物中分别引入限制性酶切位点(划线处),上游引物:5′-GGGGTACCAG CAGCACCCAGCCAAACC-3′(KpnⅠ)及下游引物:5′-ATCTGCCCGTTTGCGCCTGCCTTCAA-3′(EcoRⅤ)。随后由上海生物工程技术服务有限公司合成。
1.2.2 重组人源TNC真核表达质粒的构建与筛选:以pBS-HxB.L质粒为模板,根据Primer STAR®GXL DNA Polymerase使用说明,进行PCR程序设定。经1%琼脂糖凝胶电泳检测,回收并纯化TNC扩增产物,使用KpnⅠ单酶切,将其连接于KpnⅠ/EcoRⅤ双酶切的pCMV6-Entry载体上,构建人TNC真核表达质粒。将TNC质粒转化DH5α感受态细胞,选取单一菌落加入LB液体培养基(含卡那霉素)37 ℃培养10 h。
1.2.3 细胞的转染与G418筛选:将构建好的TNC质粒按照脂质体Lipofectamine 2000使用说明书转染PANC1细胞,转染48 h后,开始加入含有G418的培养液,随后根据细胞增殖速度更换培养液。待组成克隆的细胞数约为60个时,胰蛋白酶消化细胞并进一步扩大培养,获得稳定表达TNC的PANC1细胞系(PANC1-TNC)。以pCMV6-Entry空载体稳定转染的PANC1(PANC1- vector)细胞和未处理的PANC1(PANC1-WT)细胞作阴性和空白对照。
1.2.4 RT-qPCR检测TNC mRNA的表达:收集细胞进行总 RNA的提取和反转录,采用SYBR法检测细胞中TNC的mRNA表达水平,上游引物:5′-GCTG GAAAGAAAGCACTCCC-3′,下游引物:5′-CCTCA AATGCCATCCCC TC-3′,同时以GAPDH为内参,上游引物:5′-TGACGCTGGGGCTGGCATTG-3′,下游引物:5′-GCTCTTGCTGGGGCTGGTGG-3′,RT-qPCR的CT值的差即△Ct,2-△△Ct则为该样本中TNC基因相对于GAPDH mRNA的表达量。
1.2.5 Western blot检测TNC蛋白的表达:分别收集PANC1-WT/vector/TNC细胞上清,检测蛋白浓度,每样品取40 μg总蛋白,经SDS-PAGE分离后转至PVDF膜上。5% 脱脂奶粉室温封闭1 h,加抗TNC抗体(一抗),4 ℃孵育过夜。TBS-T洗膜3次后,HRP标记的二抗,室温孵育1 h,再次洗膜后进行ECL化学发光,化学发光仪拍照后,用ImageJ分析条带的吸光度(A)值。
1.2.6 Transwell小室法检测迁移和侵袭:取对数期的细胞,胰蛋白酶消化后,细胞计数。上室加入500 μL含2.5×104个细胞的无血清RPMI-DMEM重悬液,迁移/侵袭下室加入750 μL含20% 胎牛血清的培养液。迁移/侵袭小室分别置于孵箱培养24/48 h后,用棉签擦去小室内的细胞,4%多聚甲醛固定20 min,Gimesa染色20 min后去离子水洗3遍,封片,镜下观察计数并采集图像。
1.3 统计学分析
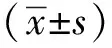
2 结果
2.1 TNC真核表达质粒的构建与鉴定
以pBS-HxB.L原核表达质粒为模板,使用TNC引物扩增目的条带,产物片段大小与理论值相符。回收并纯化TNC扩增产物,将其连接于pCMV6-Entry载体上,重组人源TNC真核表达质粒(图1A)。TNC质粒经KpnⅠ和EcoRⅤ双酶切鉴定,分别得到与预期分子质量大小一致的片段长度(图1B)。质粒测序以及BLAST序列比对的结果也表明TNC真核表达质粒构建成功。
2.2 PANC1-TNC细胞系的构建与鉴定
与对照细胞相比,PANC1-TNC细胞中TNC mRNA和蛋白表达分泌量均显著增加(图2)。
2.3 PANC1-TNC细胞形态学改变
PANC1-TNC细胞较PANC1-vector细胞呈现出不同的细胞表型。显微镜下观察,PANC1-vector细胞多为类椭圆形、连接紧密的上皮细胞形态,而PANC1-TNC细胞明显变得细长、伪足增多,间质化特征更加明显(图3)。

图1 TNC表达质粒的构建示意图(A)与鉴定(B)Fig 1 Schematic diagram (A) and identification (B) of the TNC expression plasmid
2.4 过表达TNC增强PANC1的迁移、侵袭运动能力
PANC1-TNC细胞发生迁移、侵袭的细胞数显著多于对照组。说明过表达TNC可增强PANC1的迁移和侵袭能力(图4)。
2.5 PANC1-TNC细胞发生EMT相关分子变化
间质标志物N-cadherin蛋白表达量均明显增多(P<0.05),而上皮标志E-cadherin在PANC1-TNC细胞中表达减少(P<0.05)(图5)。
3 讨论
胰腺癌恶性度极高,近年来其发病率逐年升高,严重威胁人类健康[1]。随着人们对胰腺癌生物学行为认识的不断加深,肿瘤微环境关键分子TNC在胰腺癌发生发展中所起的作用也受到越来越多的关注[4-6]。研究TNC对胰腺癌发生发展的作用以及肿瘤基质与肿瘤生长之间相互作用的分子机制,对胰腺癌早期诊断、治疗与预防有着重要的意义。
本研究构建了TNC真核表达质粒以及稳定过表达TNC的胰腺癌细胞系。本实验以pBS-HxB.L原核表达质粒为模板,避免了因TNC基因长度较长而造成的PCR克隆难度大的限制,提高了PCR产物的完整性和准确性。为了能够将TNC基因完整插入到pCMV6-Entry真核表达载体上,本研究设计的下游引物以EcoRⅤ(平末端)结尾,PCR产物可直接获得EcoRⅤ剪切后的互补核酸序列,从而既免除了TNC序列内部EcoRⅤ酶切位点可能对序列造成的破坏,又能将其完整插入到pCMV6-Entry真核表达载体中,这种方法优于其他质粒的构建[7],质粒表达稳定。TNC真核质粒的构建不仅可以应用于TNC分子机制的基础研究,而且这种质粒构建的方法还可以为构建其他超长基因质粒提供新的设计思路。

图3 PANC1-vector和PANC1-TNC细胞形态观察Fig 3 Cell morphology of PANC1-vector and PANC1-TNC(scale bar=20 μm)
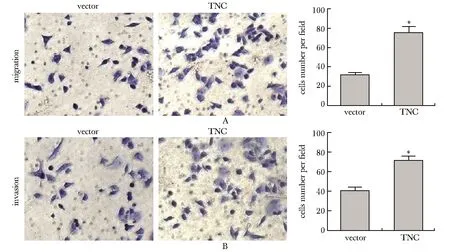
*P<0.05 compared with control图4 过表达TNC增强PANC1的迁移(A)和侵袭(B)能力Fig 4 Over-expressing of TNC promoted the migration (A) and invasion (B) ability of n=3)
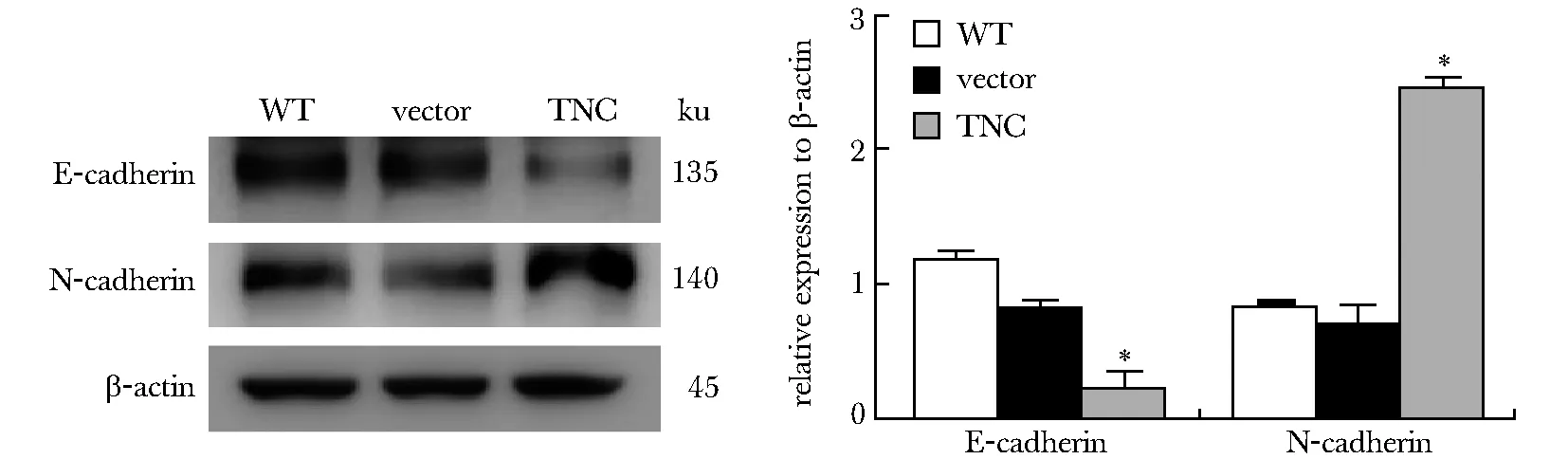
*P<0.05 compared with control图5 Western blot分析PANC1细胞系E-cadherin和N-cadherin蛋白的表达Fig 5 Western blot analysis E-cadherin and N-cadherin expression in PANC1 cell n=3)
EMT与肿瘤转移密切相关,在此过程中,连接紧密的上皮细胞丧失极性,获得间质表型特征,细胞浸润和转移能力增加[8-9]。本研究在PANC1-TNC细胞系的培养过程中观察发现,细胞较对照细胞更为细长;Transwell实验结果也显示,PANC1-TNC细胞的迁移和侵袭能力显著增强。这些生物学行为变化提示,TNC可能诱导胰腺癌细胞发生EMT,结合TNC可通过调控EMT增强乳腺癌、结直肠癌细胞迁移能力[10-12]的研究报道,本研究对PANC1细胞中的EMT相关分子进行了检测。结果发现,稳定过表达TNC的PANC1细胞中E-cadherin表达减少、N-cadherin表达增加,这就表明TNC过表达可诱导PANC1细胞发生EMT,诱导肿瘤细胞迁移与侵袭,这与以往的临床观察报告相一致[2-3]。因此,TNC可能是调节胰腺癌生长和发展的关键分子,也可作为胰腺癌早期诊断和治疗的新靶点,其相关分子机制需进一步研究证实。

