57例原发女性生殖系统淋巴瘤临床特征分析
任玉兰,林 洁,3,常 彬,王华英
1.复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;
3.福建省肿瘤医院妇外科,福建 福州 350014
原发女性生殖系统淋巴瘤(primary female genital system lymphoma,PFGSL)罕见,占女性生殖道恶性肿瘤不足0.5%,占非霍奇金淋巴瘤(non-Hodgkin’s lymphoma)1.5%左右[1]。目前关于PFGSL的报道较少,多为个案报道或小样本回顾性分析,对其临床诊断、治疗及预后也缺乏统一的标准。PFGSL患者大多以阴道流血、腹痛等症状首次就诊于妇科。由于多数妇科医师对此病认识不足,极易造成误诊。本文对2008年1月—2019年12月间复旦大学附属肿瘤医院收治的57例PFGSL进行回顾性分析,探讨其临床特征、诊治及预后。
1 资料和方法
1.1 临床资料
收集2008年1月—2019年12月经复旦大学附属肿瘤医院病理科确诊的57例PFGSL患者的临床资料。纳入标准:①病例均经活检或手术证实;② 淋巴瘤分类符合2008年世界卫生组织(World Health Organization,WHO)造血和淋巴组织肿瘤分类标准[2];③患者均经胸、腹、盆腔部CT、MRI或PET/CT及骨髓活检等检查以排除其他部位淋巴瘤及血常规,肝肾功能等检查;④ 6个月内无其他脏器淋巴瘤。
目前PFGSL诊断标准存在争议,Kosari等[3]将PFGSL定义为初诊时病灶仅局限在女性生殖道。但回顾外文文献,多数作者把PFGSL定义为主要病灶在女性生殖道[4-6]。本研究组认为主要病灶位于女性生殖器官,直接蔓延或侵犯邻近组织或区域淋巴结转移属于原发女性生殖道淋巴瘤范畴。若存在其他脏器或区域外淋巴结病灶,则不符合入组标准,总共入选57例。
1.2 治疗方式
按照治疗方式的不同分为单一治疗组(33例)和综合治疗组(24例)。化疗以CHOP方案(环磷酰胺+蒽环类药物+长春新碱+泼尼松)为主,2~8个周期,其中10例联合利妥昔单抗(R-CHOP方案)。放疗剂量30~45 Gy。手术术式包括“根治术”、“分期手术”、“全子宫+双附件切除术”、“盆腔肿块切除术”等。所有患者治疗前均签署知情同意书。
1.3 疗效评价
非手术患者按照国际工作组标准[7]评价疗效,疗效包括完全缓解(complete response,CR)、部分缓解(partial release,PR)、稳定(stable disease,SD)和疾病进展(progressive disease,PD)。手术患者以无病生存期(diseasefree survival,DFS)为评价标准。
1.4 随访
随访方式包括门诊复查、电话或者信件随访,所有患者随访至2020年10月30日,中位随访37.5个月(2.0~85.0个月)。随访主要指标包括患者生存状况、复发情况、死亡日期和死亡原因。确诊至复发时间为DFS(因患者治疗方式不统一,规定确诊时间为起点);确诊至死亡时间或随访终点为总生存期(overall survival,OS)。
1.5 统计学处理
采用SPSS 19.0软件包,用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 PFGSL检出情况
2008年1月—2019年12月期间共收治57例PFGSL患者,分别占同期复旦大学附属肿瘤医院收治的女性生殖道恶性肿瘤和淋巴瘤的0.17%和0.34%。
2.2 临床特征
57例患者中位年龄51岁(18~82岁)。按国际预后指数评分(International Prognostic Index,IPI),低危组(0~1分)占63.2%(36/57),中危组(2~3分)占36.8%(21/57)。按淋巴瘤分期标准,ⅠE期占63.2%(36/43),ⅡE期占33.3%(19/34),ⅢE期占3.5%(2/34)。病灶位于宫颈占70.0%(40/57)、卵巢占22.8%(13/57)、子宫占5.3%(3/57)、阴道占1.8%(1/57)。临床表现有阴道不规则流血(34.9%,17/57)、绝经后阴道出血(25.6%,12/57)、接触性阴道出血(14.0%,6/57)、经期延长(7.0%,1/57)、腹痛(7.0%,6/57)、腹胀(7.0%,4/57)、阴道排液(4.7%,2/57)、体检发现(7.0%,3/57)、腹部包块(2.3%,3/57)、排尿困难(2.3%,2/57)、白带增多(2.3%,1/57,表1)。
2.3 病理学特征
最常见的病理学类型为弥漫大B细胞淋巴瘤(73.7%,42/57)。其他类型有伯基特淋巴瘤(3.5%,2/57)、免疫母细胞性大B细胞淋巴瘤(3.5%,2/57)、结外NK/T细胞淋巴瘤(3.5%,2/57)、前体B-淋巴母细胞性淋巴瘤(3.5%,2/57)、黏膜相关性淋巴瘤(5.3%,3/57)、浆母细胞淋巴瘤(1.8%,1/57)、滤泡性淋巴瘤(1.8%,1/57)、前驱T淋巴母细胞性淋巴瘤(1.8%,1/57)和小B细胞淋巴瘤(1.8%,1/57,图1)。
2.4 治疗方式与疗效
单一治疗组共有33例(手术12例,化疗21例)。综合治疗组24例,其中手术+化疗12例,放疗+化疗10例,手术+放化疗2例。57例患者中复发14例,复发率为24.6%(14/57),12例位于单一治疗组,2例位于综合治疗组。复发位于中枢神经系统者4例,眼1例,局部复发者4例,全身多处转移者5例。3例经挽救化疗后达CR。11例死亡(1例死于骨髓干细胞移植,2例死于嗜血细胞综合征,8例死于PD)。本研究中,疾病分期构成在两组中差异有统计学意义,可能与病例数过少及分期晚的患者倾向于综合治疗有关。以是否复发为阳性指标,采用Fisher检测法对同一期别的PFGSL以不同治疗方式进行亚组分析,均表明综合治疗组疗效优于单一治疗组。
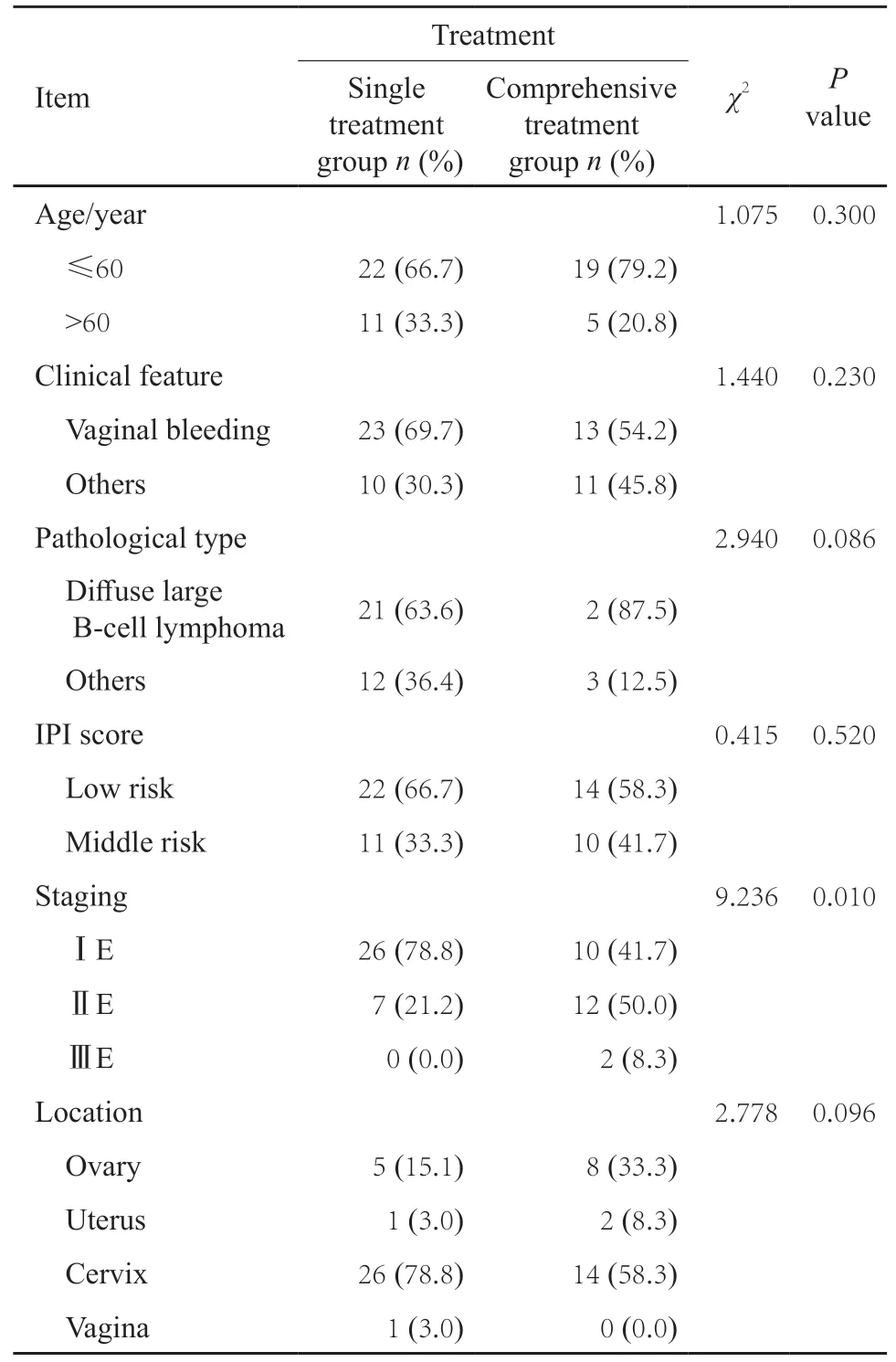
表1 57例原发女性生殖系统淋巴瘤患者临床特征Tab.1 The clinical characteristics of 57 PFGSL patients

图1 典型PFGSL(宫颈)H-E染色 (×200)Fig.1 Typical PFGSL (cervical) H-E staining (×200)
2.5 生存情况
57例患者3年OS率为82%,5年OS率为78%;3年DFS率为77%,5年DFS率为71%。其中,单一治疗组3年OS率为72%,5年OS率为64%;3年DFS率为67%,5年DFS率为57%。综合治疗组3年和5年OS率为95%;3年和5年DFS率为91%(图2)。采用Kaplan-Meier和COX回归对57例患者的OS率DFS率进行单因素和多因素分析。单因素分析发现,年龄、IPI评分和治疗方式(单一/综合治疗)与患者的DFS相关;IPI评分和治疗方式与患者OS相关。多因素分析发现,仅治疗方式(单一/综合治疗)与患者的DFS和OS相关(表2和图3)。


表2 各相关变量与患者生存的单因素及多因素分析Tab.2 Univariate and multivariate analyses of related variables and patient survival

图3 不同治疗方式分组的OS曲线及DFS曲线Fig.2 The OS and DFS curves of different treatment groups
3 讨 论
PFGSL发病率极低,占结外淋巴瘤的0.2%~1.1%[8-9]。且临床表现无特异性,初诊较难判断,极易造成误诊[3]。
本研究组对57例PFGSL患者临床资料分析发现,子宫或宫颈淋巴瘤多表现为阴道出血,卵巢淋巴瘤多表现为腹痛、腹部包块,这与Frey等[4]报道的相一致。本研究中,出现B症状(发热、盗汗、体质量减轻)的患者仅占3.5%(2/57),这与Dursun等[1]报道的PFGSL患者B症状较少相一致。Nasioudis等[8]报道了697例原发性PFGSL,发现主要病理学类型为弥漫大B细胞淋巴瘤,本研究结果与既往报道相符[10]。Kosari等[3]和Au等[5]发现PFGSL好发部位为宫颈与卵巢,而阴道及宫体受累较少见。Nasioudis等[8]亦报道卵巢是PFGSL最常见的部位,其次是宫颈。本研究中好发部位也主要位于宫颈和卵巢,子宫和阴道仅分别占5.3%和1.8%,与文献报道基本相符。值得注意的是,区分卵巢的继发性和原发性淋巴瘤是一个颇具挑战性的问题,尤其是在有淋巴结和结外疾病的情况下。且很多卵巢淋巴瘤发现时多为晚期,位于胃肠道、肺等部位的结外淋巴瘤进展时,常累及卵巢[1],因而晚期原发卵巢淋巴瘤较难与继发卵巢淋巴瘤相鉴别。本研究中去除了主要病灶在淋巴结和其他脏器的病例,所有病例的主要病灶均在妇科脏器。本研究中单纯治疗组ⅡE期患者占21.2%,而综合治疗组ⅡE和ⅢE期患者占58.3%,两者差异有统计学意义(P<0.05),这可能与病程相对较晚的患者倾向综合治疗有关。
对于PFGSL治疗尚形成共识,部分学者认为PFGSL需综合治疗,如放疗+手术/化疗、化疗+手术/放疗、手术+化疗等[5-6,11]。也有部分学者认为PFGSL仅需单一治疗(放疗、化疗或手术),若未达CR才需补充治疗[12]。那么,对于Ⅰ、Ⅱ期PFGSL患者,综合治疗或单一治疗哪种效果好?本研究中,分期为Ⅱ期的患者更趋向于综合治疗。单因素分析发现,年龄、IPI评分及治疗方式与患者的DFS相关,IPI评分及治疗方式与患者的OS相关;而多因素分析发现,仅治疗方式与患者的OS及DFS相关。综合治疗组OS、DFS明显优于单一治疗组。单一治疗组复发12例,复发率为36.4%。而综合治疗组仅复发2例,复发率仅为8.3%。多数学者也发现单一治疗的患者较易复发[11,13-14]。Stroh等[13]研究发现Ⅰ或Ⅱ期PFGSL单纯化疗者复发率为15%~30%,本研究中,单纯化疗者复发率为38.0%(8/21)。单纯放疗的Ⅰ、Ⅱ期患者也容易发生广泛播散。Živaljević等[11]和Chan等[14]也分别报道了单纯手术复发的病例。本研究中,1例单纯手术患者40个月后出现全身多处转移,挽救化疗无效死亡,而通过综合治疗的PFGSL患者复发率低,较易达到长期存活。Au等[5]研究证实综合放化疗能提高Ⅰ、Ⅱ、Ⅲ期女性生殖道淋巴瘤DSF率,甚至是OS率。本研究中,综合治疗组患者仅2例复发,这可能与以下几点有关:①PFGSL对放化疗敏感;② 多为早期PFGSL(Ⅰ~Ⅱ期),病灶局限,预后较好[12]。③淋巴瘤是全身系统性疾病,综合治疗组患者均采用化疗,可消灭微转移灶。本研究中,可能由于病例数较少及治疗选择的偏移,分期构成在两组之间有差异。经过亚组分析,同一期别的患者,综合治疗效果也较好。本研究观察到ⅡE期PFGSL患者经综合治疗预后较Ⅰ期单纯治疗者好。因此,我们认为综合治疗更有优势。
较多学者治疗PFGSL时采用手术联合其他方案的治疗模式[16-18],但关于术式无统一标准。就宫颈淋巴瘤而言,有报道[16]通过手术+化疗模式成功治疗了1例宫颈淋巴瘤患者,该术式为全子宫+双附件+盆腔患者淋巴结清扫术。而Gabriele等[17]也报道了1例类似病例,但术式为全子宫+双附件切除术,两患者均有较好的预后。Ahmad等[18]回顾性分析了33年间36例PFGSL诊治情况,其中77.8%的患者采用了手术治疗,该作者认为PFGSL要避免“激进”的手术方式。本研究中,手术患者共有26例,其中宫颈淋巴瘤有11例(单纯手术7例,联合化疗4例),单纯手术中,5例行宫颈癌根治术,2例行全子宫+双附件切除术,其中1例死亡为宫颈癌根治术者;联合化疗者1例行宫颈癌根治术,3例行全子宫双附件切除术,4例患者均存活。手术+化疗模式治疗的8例卵巢淋巴瘤患者中,2例行分期手术,2例行全子宫+双附件切除术,4例行肿瘤细胞减灭术,其中7例患者存活,1例死亡患者接受了肿瘤细胞减灭术。手术+化疗模式治疗的3例子宫淋巴瘤患者的术式均为全子宫+双附件切除术,3例患者均存活。从26例患者术式分析基本可以看出根治性及扩大性手术未必有优势。本研究组认为,PFGSL不适合按相应部位女性生殖系统恶性肿瘤的术式处理,手术应该以切除肿瘤为目的,简化手术方式,但有待扩大样本量进一步证实。
本研究入组57例PFGSL患者,虽较其他同类研究样本量多,但总体入组病例还是较少,并且淋巴瘤的病理学类型繁多,易造成统计效能不够,有待进一步扩大样本量且对综合治疗组治疗方法进行分层分析,从而找到PFGSL最佳的治疗方式。
原发女性生殖系统淋巴瘤发病率低,临床表现无特异性,极易造成误诊,应纳入其他常见妇科肿瘤的鉴别诊断。虽然早期诊断很困难,但制定适当的个体化治疗计划是关键。由于多数患者首次就诊妇科,妇科医师应提高对此疾病的认识,并参考化疗及放疗科医师的意见进行诊治。

