柱状苹果Co基因的筛选与候选基因分析
白团辉,李莉,郑先波,王苗苗,宋尚伟,焦健,宋春晖
柱状苹果基因的筛选与候选基因分析
白团辉,李莉,郑先波,王苗苗,宋尚伟,焦健,宋春晖
(河南农业大学园艺学院/河南省果树瓜类生物学重点实验室,郑州 450002)
【】柱状苹果是一种特殊的矮生突变类型,其节间短、短枝多、侧生分枝少、主干粗壮直立,是苹果实行矮化密植栽培的重要资源。本研究在前期精细定位的基础上,对定位区间的基因进行筛选,为阐明柱状苹果形成的分子机制和选育柱状苹果新品种奠定基础。以柱状苹果‘舞佳’和‘润太一号’,普通型苹果‘富士’和‘华硕’的芽、茎尖和叶片为试材,根据最新的苹果基因组以及与柱状相关的转录组信息,对精细定位区间27.66—29.05 Mb的基因进行注释分类,选择目标基因,查找其CDS序列,使用RT-PCR技术检测引物特异性,利用实时荧光定量PCR分析预测基因在不同组织器官中的表达特征,筛选出差异基因并将其作为候选基因。在苹果第10号染色体27.66—29.05 Mb区域内包含67个基因,其中12个为非编码RNA(ncRNA),其余为编码蛋白质的基因。根据RNA-seq分析,柱状和普通型苹果基因相对表达差异倍数在1倍以上的有25个基因,其中13个基因在柱状苹果中上调表达,12个基因在柱状苹果中下调表达。在预测的14个基因中,发现4个基因MD10G1184100、MD10G1185400、MD10G1185600和MD10G1190500在柱状和普通型苹果的主枝茎尖或侧枝茎尖中相对表达存在显著差异。其中,MD10G1184100和MD10G1185600在两个柱状苹果主枝茎尖中的相对表达量均显著高于两个普通型苹果。MD10G1185400和MD10G1190500在两个柱状苹果侧枝茎尖的表达量显著高于两个普通型苹果,而MD10G1184100在两个柱状苹果中的表达量显著低于普通型苹果。进一步对这4个候选基因进行不同组织或器官的基因表达特征进行分析,发现基因MD10G1184100在柱状苹果根部的表达显著高于其他部位,MD10G1185400和MD10G1185600在柱状苹果的侧枝茎尖中显著高表达,而MD10G1190500在柱状苹果的顶芽中显著高表达。在柱状和普通型苹果茎尖中筛选到4个表达显著差异的基因,可作为候选基因,为该基因的克隆和功能验证及苹果树树型定向遗传改良奠定了基础。
苹果;柱状树型;基因定位;基因表达;候选基因
0 引言
【研究意义】苹果(×Borkh.)是我国主要栽培的果树树种之一,其面积和产量均居世界首位,发展苹果产业,对增加农民收入、调整产业结构具有重要的意义。树型是苹果重要的农艺性状之一,对定植密度、机械采收、整形修剪以及栽培模式都有至关重要的作用[1]。柱状苹果是一种特殊的矮生突变类型,其节间非常短、侧生分枝少,且几乎不需修剪,被认为是苹果矮化密植栽培、集约化生产的理想树型[2-4]。开展柱状苹果的鉴定与分离,对实现定向遗传改良苹果树型和分子标记辅助选育柱状苹果具有重要意义。【前人研究进展】柱状苹果是1969年发现于McIntosh上的一个芽变,后来命名为McIntosh Wijcik[5]。最早研究报告显示柱状苹果是受显性单基因控制的质量性状[2]。随着生物技术的快速发展,国内外研究者相继开展了柱状苹果的分子标记和基因定位研究。CONNER等[6]用集群分类法(bulked segregant analysis,BSA)首次找到一个与连锁RAPD 标记 OA111000。CONNER等[7]用两个柱状杂交群体后代分离数据构建了3个亲本的遗传连锁图,包含283个标记,分布在17个连锁群上,被定位在第10个连锁群上。王彩虹等[8]利用AFLP结合BSA法在Spur Fuji×Telamon杂交组合中,筛选到了2个AFLP标记,分别与位点遗传距离为3.3和27.5 cM。TIAN等[9]报道了所在区域分子图谱,将界定在两个稳定的SSR标记(COL和CH02a10)之间,覆盖基因组长度为54.6 cM,标记间平均距离为4.55 cM。MORIYA等[10]将定位在两个SSR(CH03d11和Hi01a03)之间,进一步缩短了目的基因和标记的距离。随后,自2010年‘金冠’苹果基因组测序公布[11],研究者开始对基因开展了精细定位研究。笔者课题组前期研究将定位到第10条染色上物理距离75 kb以内[12]。BALDI等[13]分析了区域内的ORFs,发现区域内存在若干个潜在的候选基因,并对该区域内的36个基因进行了预测和注释。OTTO等[14]研究发现,在18.73—18.92 Mb区域内有一个柱型特异的8.2 kb的反转录转座子的插入,预测其可能与柱状树形有关。【本研究切入点】目前,柱状苹果基因的精细定位仍存在一些差异[15-19],还未能从分子水平上阐明柱状苹果形成机制。【拟解决的关键问题】本研究利用已发布的苹果参考基因组GDDH13(Golden Delicious doubled-haploid tree 13),通过NCBI中的序列阅读存档/表达序列标签数据库检索,对精细定位区间的基因进行注释分类、预测,选择目标基因,利用实时荧光定量PCR技术分析目标基因在不同组织器官中的表达特征并筛选出差异基因。
1 材料与方法
试验于2018—2019年在河南农业大学果树生物学实验室进行。
1.1 植物材料
本试验以3年生柱状苹果‘舞佳’(WJ)和‘润太一号’(RT),普通型苹果‘富士’(FJ)和‘华硕’(HS)植株为试材,于2018年3月萌芽后开始,分别采集萌芽期的顶芽和侧芽、生长期的主枝茎尖和侧枝茎尖、叶片、花、根和果实,其中植株的根部样品为组培苗的根,用锡箔纸包好放入液氮中速冻,迅速带回试验室于-80℃中保存。
1.2 试验方法
1.2.1 总RNA的提取、检测及反转录 使用改良CTAB法[20]提取样品总RNA。使用分光光度计(NanoDrop 2000,Thermo Scientific)检测RNA溶液的浓度及纯度,并使用1%的琼脂糖凝胶电泳检测RNA的质量和完整性。使用RNA反转录试剂盒Prime ScriptTM1st Strand cDNA Synthesis Kit(大连宝生物科技有限公司)进行反转录,严格按照说明书进行操作。
1.2.2 预测基因的遴选和生物信息学分析 根据分子标记与目标基因的遗传距离和物理距离[12-14],在苹果基因组注释数据库(https://iris.angers.inra.fr/gddh13)中对定位的染色体区段内的注释基因进行候选基因的遴选。根据NCBI中有关柱状苹果的转录组数据及普通型苹果不同组织的转录组数据,对区段内的基因进行表达量的初步筛选。
1.2.3 引物设计与验证 根据苹果参考基因组中mRNA序列,按照荧光定量PCR引物设计原则使用Premier 5.0软件设计引物,引物信息见表1,由生工生物工程(上海)有限公司合成。以柱状和普通型苹果的cDNA为模板,对设计的引物进行PCR特异性检测。PCR体系为Mix 10 μL,正、反向引物(10 mmol∙L-1)各1 μL,100 ng·μL-1cDNA 1 μL,ddH2O 7 μL,总体系20 μL。PCR反应程序为:94℃预变性2 min;94℃变性20 s,50—60℃退火20 s,72℃延伸30 s,28—32个循环,72℃延伸5 min,4℃保存。退火温度依据引物自身的Tm值进行相应的设置。使用1%的琼脂糖凝胶电泳检测扩增产物。
1.2.4 实时荧光定量PCR检测 荧光定量PCR检测在ABI7500荧光定量PCR仪上进行。使用SYBR® Green PCR Master Mix(美国应用生物系统公司)荧光定量试剂盒,反应体系为20 μL:10.0 μL SYBR® Green PCR Master Mix,2.0 μL 模板cDNA,上、下游引物各1.0 μL(引物浓度 10 μmol·L-1),6.0 μL ddH2O。荧光定量PCR的反应程序为:预变性过程,50℃ 20 s,95℃ 10 min,1次循环;95℃ 15 s,60℃ 1 min,并进行荧光信号采集;40次循环。每个样品设置3个生物学重复,所得数据使用2-ΔΔCT方法计算基因表达量[21-22]。
1.2.5 数据统计与分析 使用SPSS 17.0软件(IBM)对试验数据进行显著性分析(<0.05)。用Excel 2010进行数据分析和作图。
2 结果
2.1 Co定位区间基因的注释和筛选
根据已经发表的柱状基因定位区间,提取‘金冠’参考基因组GDDH13 10号染色体27.66—29.05 Mb区域内基因组信息,结果表明,这一段序列包含67个基因(表2),其中12个为非编码RNA(ncRNA),其余为编码蛋白质的基因。根据柱状和普通型苹果SRA RNA-seq数据,差异倍数1倍以上的有25个基因,其中13个基因在柱状苹果中上调表达,12个基因在柱状苹果中下调表达。通过比较67个基因在柱状和普通型苹果中的表达并结合基因功能预测,筛选到14个预测基因(表1)。其中,MD10G1192100、MD10G1192900、MD10G1188000、MD10G1194100、MD10G1193400、MD10G1189000和MD10G1192200在叶片、顶梢、茎、腋芽、根、果实和花中均表达(图1)。而MD10G1192900和MD10G1192100的表达量在各个器官中均较高,MD10G1194100和MD10G1187000在根中表达量高,MD10G1192200和MD10G1188000在果实中表达量较高。
2.2 预测基因在苹果主枝茎尖中的表达特征
对扩增到cDNA序列的14个预测基因,利用克隆到的基因序列设计qRT-PCR特异引物(表1),在柱状苹果‘舞佳’和‘润太’,普通型苹果‘富士’和‘华硕’的主枝茎尖进行表达分析。结果表明,MD10G1184100和MD10G1185600在两个柱状苹果主枝茎尖中的相对表达量均显著高于两个普通型苹果(图2-A和C)。MD10G1186300在‘华硕’中的表达量显著高于‘舞佳’和‘润太’,而在‘润太’与‘富士’中的表达量则无显著差异(图2-D)。MD10G1187000在‘润太’中的表达量显著高于‘富士’和‘华硕’,但是在‘舞佳’中的表达量又显著低于‘富士’和‘华硕’(图2-F)。MD10G1190500在‘润太’中的表达量显著高于其他3个品种,但在这3个品种之间则无显著差异(图2-G)。MD10G1190700在‘润太’中的表达量最低,在‘舞佳’中的表达量显著高于‘华硕’,但其与‘富士’之间无显著差异(图2-H);MD10G1191100在两个柱状苹果以及‘富士’中的表达量显著低于‘华硕’,但在‘舞佳’与‘富士’之间,其表达量无显著差异(图2-I);MD10G1192900在‘润太’中的表达量显著高于其他3个品种,但在‘舞佳’中的表达量显著低于普通型(图2-L)。则是在‘华硕’中的表达量显著高于其他3个品种,但其表达量在这3个品种间无显著差异(图2-M)。MD10G1192300和MD10G1192400在柱状与普通型中的表达量无显著差异。MD10G1194200在两个柱状苹果中的表达量显著低于两个普通型苹果(图2-N)。
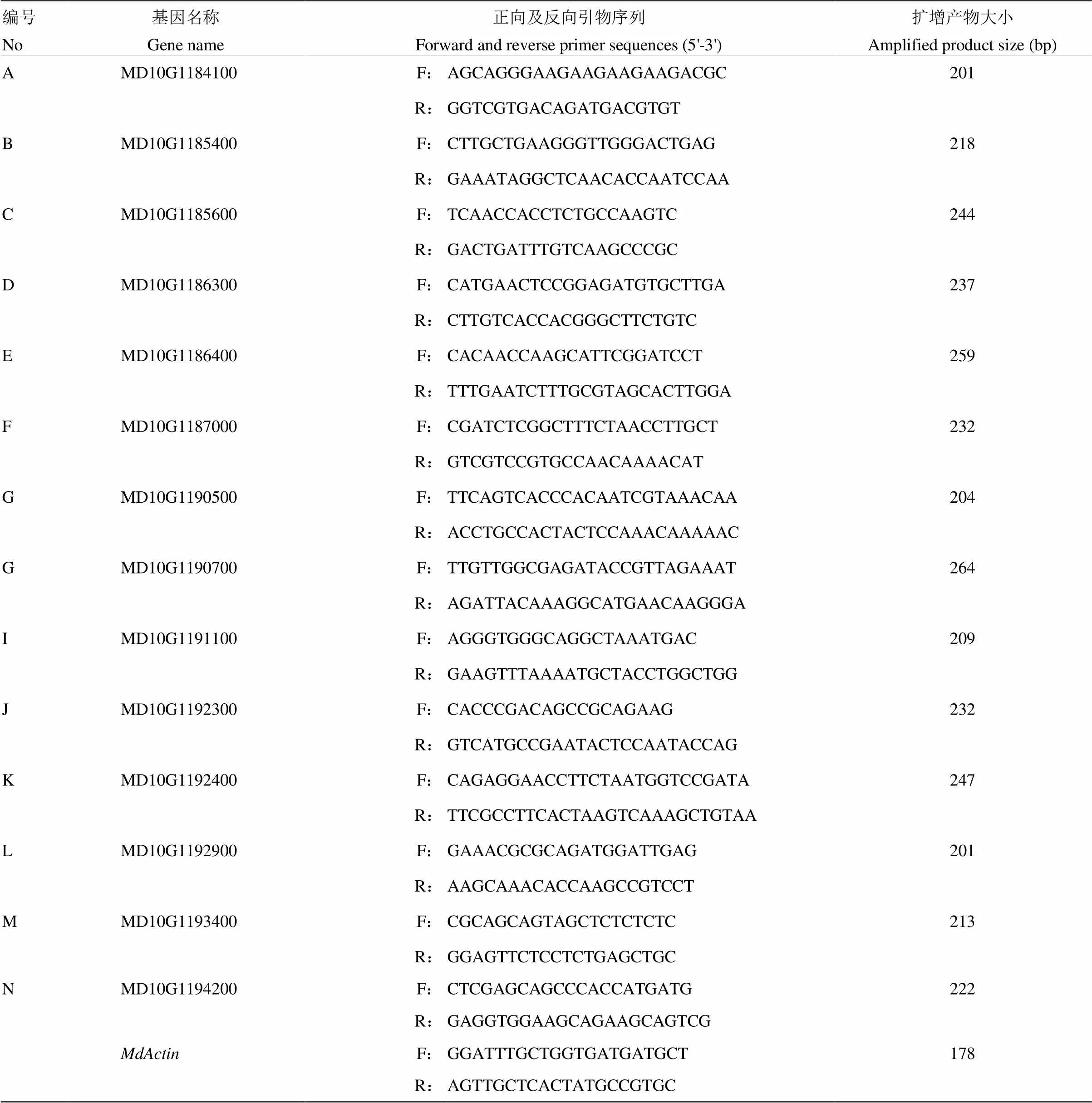
表1 14个预测基因相对表达实时荧光定量PCR引物序列
:肌动蛋白基因(内参基因): Actin gene (reference gene)

表2 苹果Co定位区间的基因初步筛选
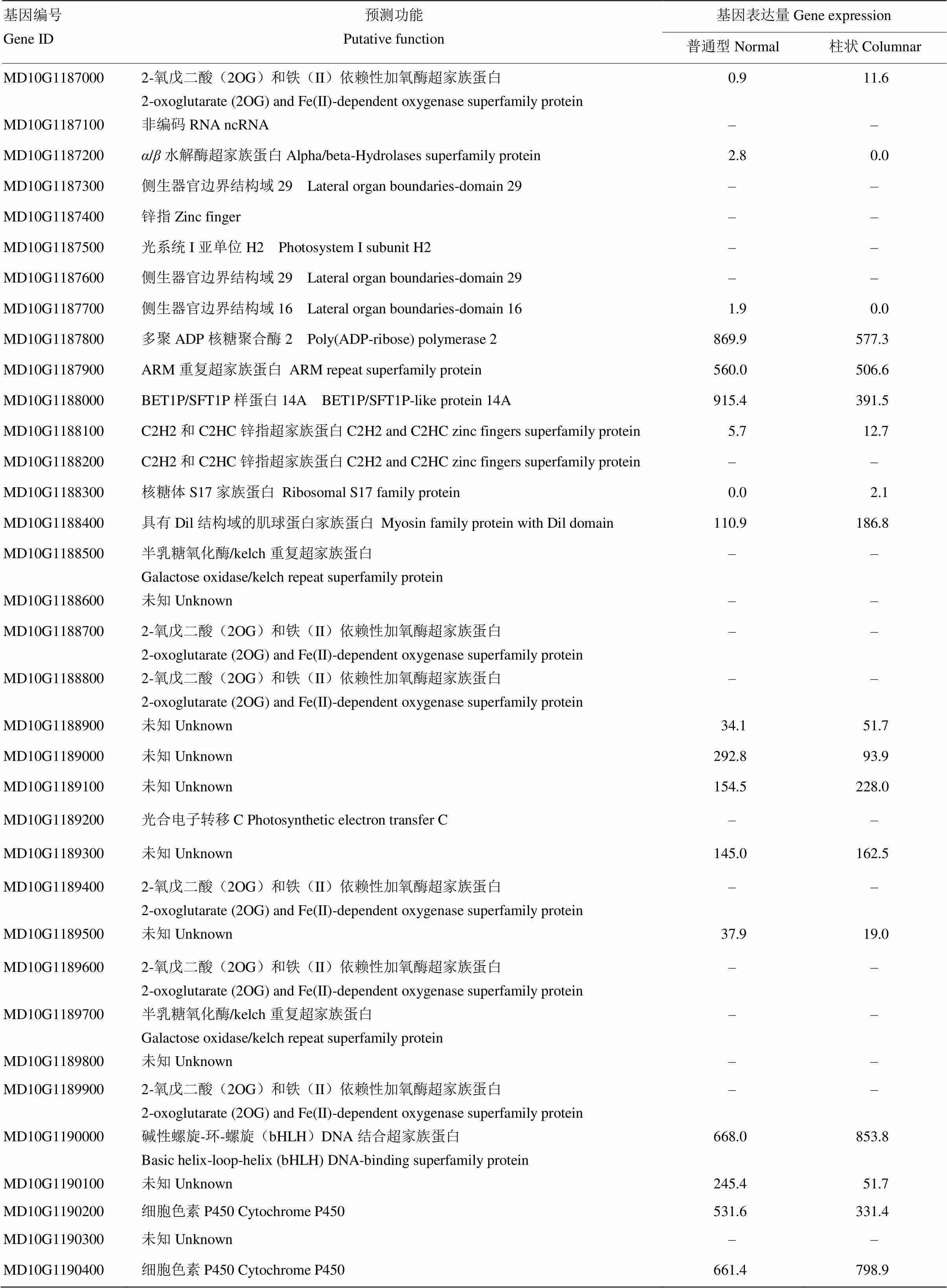
续表2 Continued table 2

续表2 Continued table 2

图1 初步筛选基因组织表达
2.3 预测基因在苹果侧枝茎尖中表达特征
对14个预测基因在柱状苹果‘舞佳’和‘润太’,普通型苹果‘富士’和‘华硕’的侧枝茎尖进行了表达分析。结果表明,MD10G1185400和MD10G1190500在2个柱状苹果侧枝茎尖的表达量显著高于两个普通型苹果(图3-B和G),而MD10G1184100和MD10G1186400在2个柱状苹果中的表达量分别显著低于2个普通型苹果(图3-A和E)。MD10G1185600在‘舞佳’与‘富士’中的表达量显著高于另外2个苹果品种,但是这两者之间无显著差异,并且在‘润太’中的表达量显著高于‘华硕’(图3-C),MD10G1186300在‘华硕’中的表达量显著高于其他3个苹果,但除‘华硕’外的3个品种间无显著差异(图3-D)。其他基因则是在品种间的表达无差异或在柱状与普通型苹果中的表达量存在不一致的现象,综合考虑,选择在柱状苹果‘舞佳’和‘润太’,普通型苹果‘富士’和‘华硕’的主枝茎尖以及侧枝茎尖中差异表达的4个基因MD10G1184100、MD10G1185400、MD10G1185600和MD10G1190500作为候选基因。
2.4 候选基因在不同组织部位中的表达分析
通过实时荧光定量PCR检测4个候选基因(MD10G1184100、MD10G1185400、MD10G1185600和MD10G1190500)在柱状和普通型苹果顶芽、侧芽、主枝茎尖、侧枝茎尖、根、叶、花、果实中的相对表达水平。结果表明,4个候选基因在顶芽、侧芽、主枝茎尖、侧枝茎尖、根、叶、花和果实中均有表达,但表达特征有差异(图4)。MD10G1184100在柱状苹果根部的表达量最高,显著高于其他部位,为普通型苹果根部表达量的65倍。MD10G1184100在顶芽、主枝茎尖、根和果实中的表达量显著大于普通型苹果。MD10G1185400在柱状苹果侧枝茎尖中高表达,在柱状苹果的侧枝茎尖、根、果实和叶片中的表达量显著高于普通型;而在花、侧芽和侧枝茎尖的表达量显著小于普通型。MD10G1185600在柱状苹果的侧枝茎尖中高表达,在主枝茎尖、侧枝茎尖、果实和叶片中的表达量显著大于普通型,而在顶芽、侧芽、根和花等组织中的表达量显著小于普通型。MD10G1190500在柱状苹果顶芽中的表达量最高,在顶芽、侧芽、侧枝茎尖、花、果实和叶片中表达量显著高于普通型。
3 讨论
苹果是世界上最重要的经济作物之一。近30多年来,世界苹果栽培制度发生了深刻的变化,欧美等发达国家苹果园的矮砧栽培比例高达90%以上,而中国苹果矮化栽培的比例不足10%[23]。随着农业产业结构的调整和城市化进程的日益加快,农村劳动力向城市大量转移,苹果种植从业人员不足的现象日益严重,矮砧密植栽培是我国苹果产业发展的必然趋势[22-24]。柱状苹果因其节间短、侧生分枝少,且几乎不需修剪,被认为是现代苹果矮砧密植栽培的理想树型[25-27]。但到目前为止,柱状苹果形成的分子调控机制尚不清楚。从分子水平上揭示柱状苹果独特的生长特性是实现苹果定向遗传改良树型的基础。前期研究表明,苹果柱状树型是受位于10号染色体上的单显性基因控制,并且在区域内有多个预测基因[6,28-30]。笔者课题组前期研究开发了7个与紧密连锁的SSRs标记,并构建了遗传连锁和物理图谱,将定位到第10条染色体分子标记16470_23262和C5629_32009之间物理距离75 kb以内[12]。本研究以柱状苹果与普通型苹果为试材,对定位区间的基因进行注释分类,发现在10号染色体27.66—29.05 Mb区域内包含67个基因,进一步发现4个基因(MD10G1185400、MD10G1184100、MD10G1185600和MD10G1190500)在柱状和普通型苹果的主枝茎尖或侧枝茎尖基因表达存在显著差异,推测这4个基因可能是候选基因。
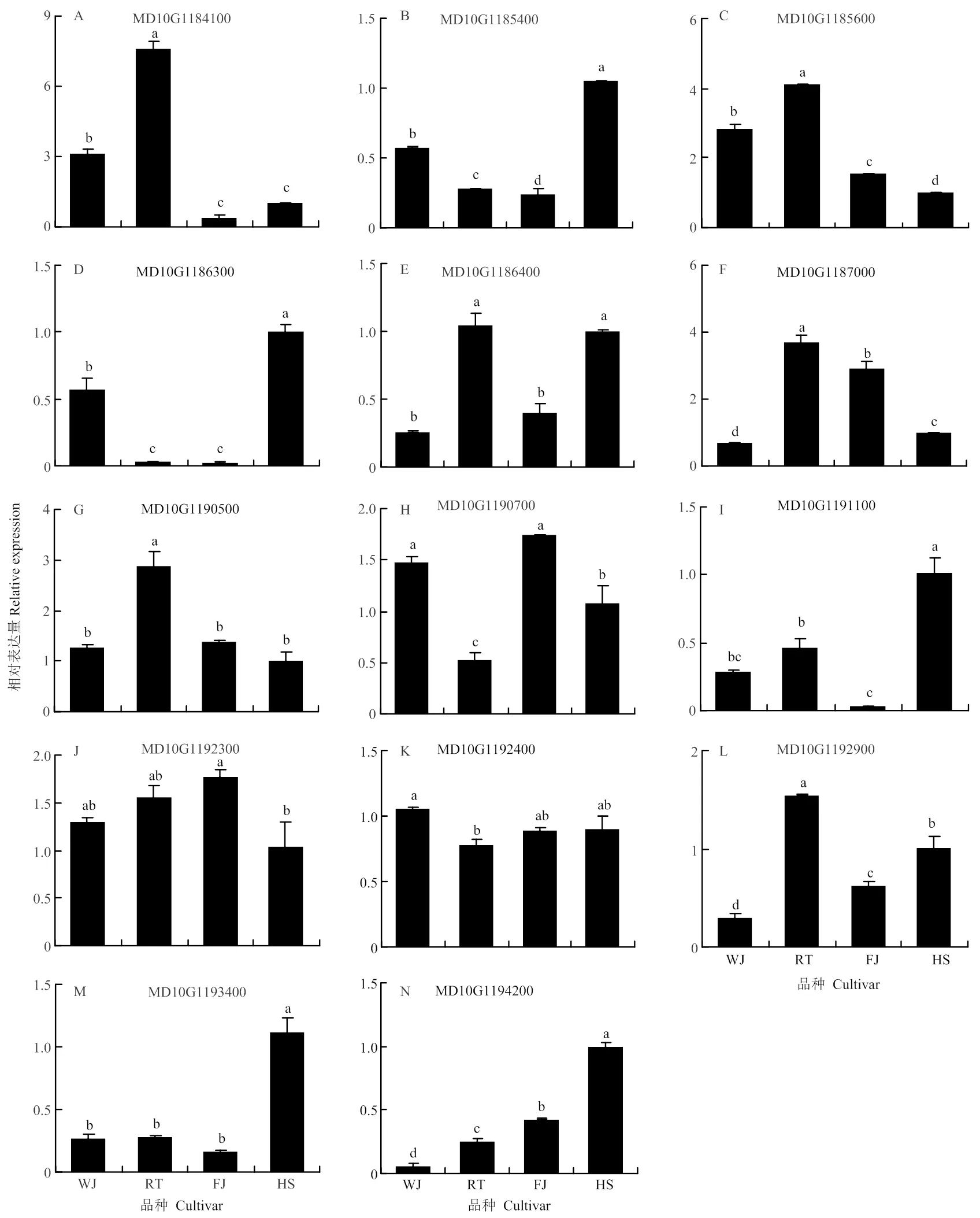
WJ:舞佳 Wujia;RT:润太 Runtai;FJ:富士 Fuji;HS:华硕 Huashuo。不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters indicate significant difference (P<0.05). The same as below
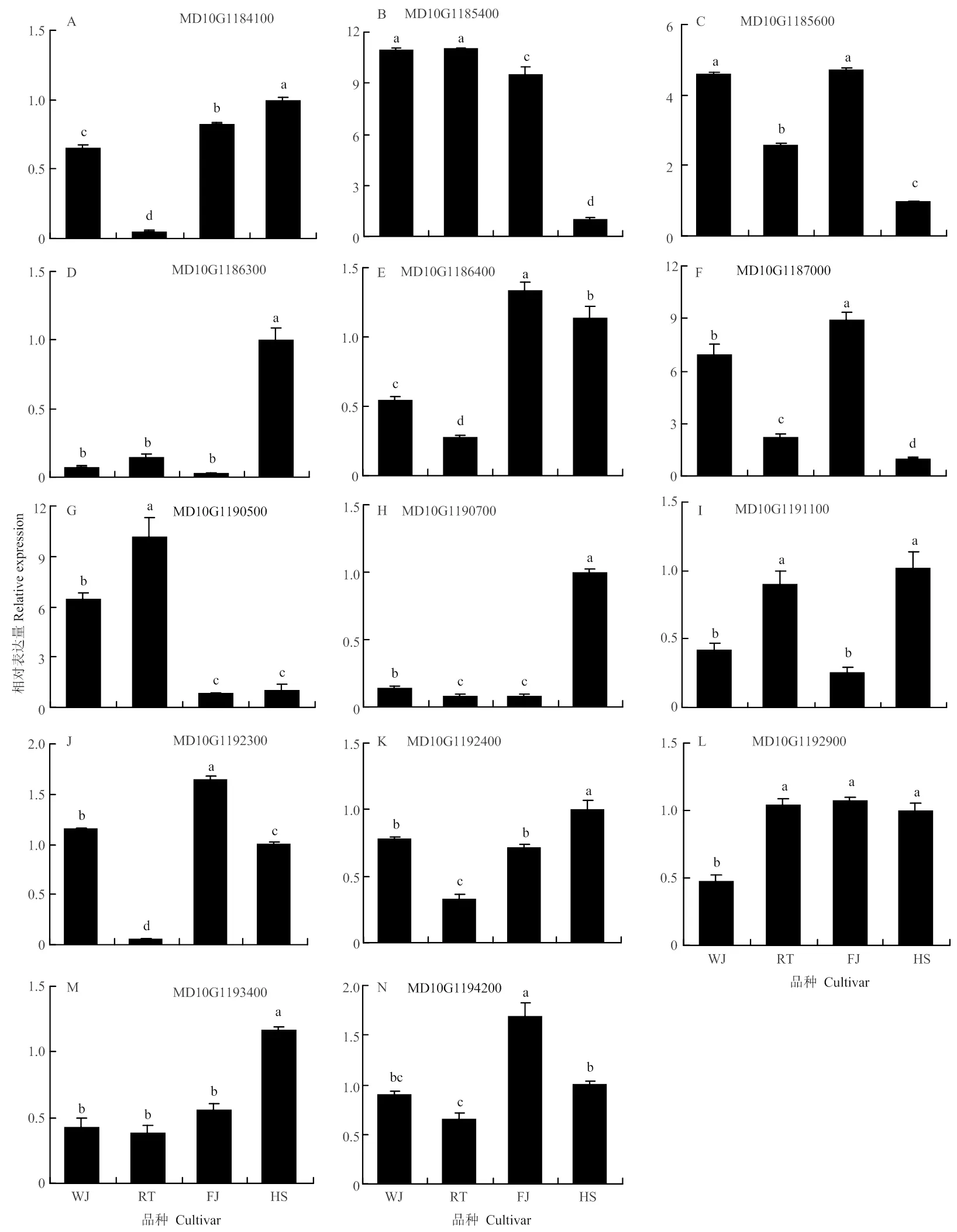
图3 预测基因在柱状和普通型苹果侧枝茎尖中的相对表达水平
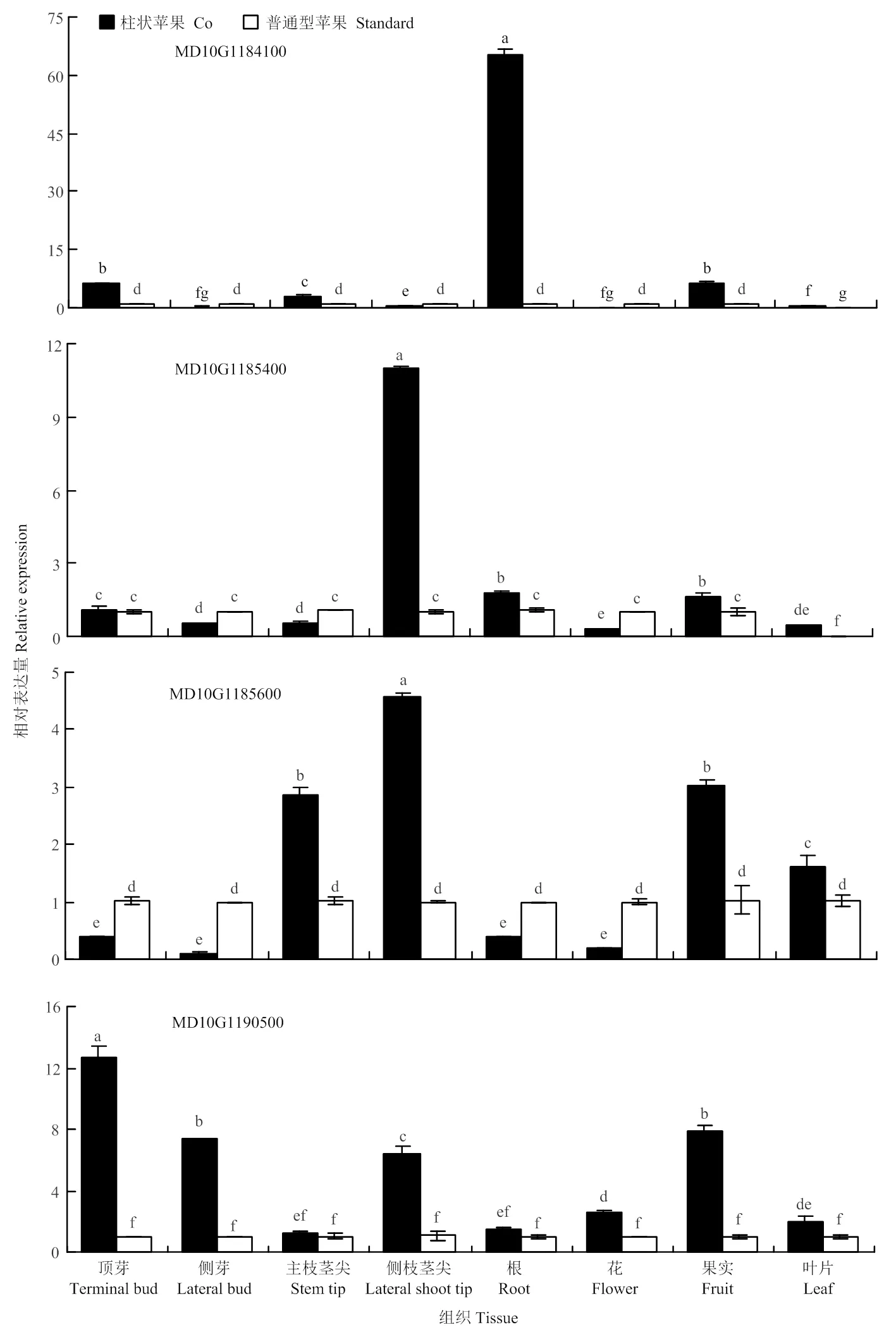
图4 候选基因在柱状和普通型苹果不同组织中的相对表达水平
在所预测的4个候选基因中,已有研究表明MD10G1185400可能参与调控苹果柱状树型[19,31]。经序列比对发现,MD10G1185400与WOLTERS等[31]报道的(downy mildew resistance 6-like)和OKADA等[19]报道的是同一个基因。WOLTERS等[31]发现,与普通型苹果相比,在柱状苹果腋芽部位显著上调表达。OKADA等[19]发现基因也是仅在柱状苹果中表达,而在普通型苹果中不表达。本研究与其相似,该基因在柱状苹果‘舞佳’和‘润太’的侧枝茎尖中高表达,并且在柱状苹果和普通型苹果不同部位以及不同时期中的表达量均有显著差异。OKADA等[19]将转入烟草中,发现转基因烟草的株高降低和节间长度变短,在苹果中过表达该基因也引起节间变短,依此推断,可能是候选基因,但柱状苹果的生长表型不仅仅是节间短。进一步通过对MD10G1185400进行分析,表明MD10G1185400属于2OGDs的DOXC41亚家族,DOXC41亚家族成员基因功能多样,参与各种特殊代谢,如莨菪碱6-羟化酶(H6H)和大麦铁缺乏,但苹果柱状性状与这几种物质代谢好像又关系不大,MD10G1185400的具体功能依然未知,其是否在激素通路或者其他通路中发挥作用,有待进一步研究。另外一个候选基因MD10G1184100是一个转录因子,为MYB domain protein 15,在柱状苹果中显著上调表达。拟南芥的同源基因在防御诱导的木质化和基础免疫中发挥着作用,沉默降低了防御诱导的木质素的含量,而过表达增加了木质素含量[32]。推测柱状苹果树主干上萌发出的直立侧枝,可能与木质素合成异常有关,因此,这个基因也有待验证。PETERSEN等[18]研究发现,MDP0000163720在状状苹果‘P28’的顶端分生组织中上调表达。通过BLAST比对发现,MDP0000163720与本研究中的MD10G1185600是同一个基因,且表达特征与其研究结果一致。MD10G1190500编码一个肌球结合蛋白基因(myosin-binding protein 1-like,Myob),可直接与肌球蛋白结合,并将其募集到囊泡样内膜膜室中,从而快速沿着F-肌动蛋白轨迹移动[33]。MD10G1190500在柱状苹果侧枝茎尖、花、果实和叶片中的表达量显著大于普通型苹果。肌球结合蛋白基因在植物中研究较少,MD10G1190500是否与苹果柱状树形有关,有待深入研究。具体哪一个基因调控柱状苹果树形,还需进一步验证候选基因的生物学功能,可能还与植物激素IAA、CK和GA的代谢和信号转导有关;同时,笔者在柱状的杂交群体中发现,杂交后代中柱状的植株比例通常小于50%的理论值。另外,柱状苹果的杂交后代中,有些植株携带着反转座子插入标记,但却表现出普通型的表型,表明其他基因可能对起修饰作用。
4 结论
通过对苹果定位区域进行注释分类和筛选,检测到67个基因,其中12个为非编码RNA,其余为编码蛋白质的基因。根据RNA-seq分析67个基因在柱状和普通型苹果表达特征并结合基因功能预测,筛选到14个预测基因,通过qRT-PCR分析发现4个基因(MD10G1184100、MD10G1185400、MD10G1185600和MD10G1190500)在柱状和普通型苹果的主枝茎尖或侧枝茎尖存在显著表达差异,可作为候选基因。
[1] 梁美霞, 乔绪强, 郭笑彤, 张洪霞. 柱型苹果生长特性及基因定位研究进展. 中国农业科学, 2017, 50(22): 4421-4430.
LIANG M X, QIAO X Q, GUO X T, ZHANG H X. Research progresses in mechanisms of growth habits andgene mapping of columnar apple (× Borkh.)., 2017, 50(22): 4421-4430. (in Chinese)
[2] LAPINS K O. Inheritance of compact growth type in apple., 1976, 101: 133-135.
[3] TOBUTT K R. Breeding columnar apple varieties at east malling.1984,35: 72-77.
[4] 祝军, 李光晨, 王涛, 张文, 赵玉军. 威赛克柱型苹果与旭的AFLP多态性研究. 园艺学报, 2000, 27(6): 447-448.
ZHU J, LI G C, WANG T, ZHANG W, ZHAO Y J. AFLP polymorphism between McIntosh and Wijcik columnar apple., 2000, 27(6): 447-448. (in Chinese)
[5] LAPINS K O. Segregation of compact growth types in certain apple seedling progenies., 1969, 49: 765-768.
[6] CONNER P J, BROWN S K, WEEDEN N F. Randomly amplified polymorphic DNA-based genetic linkage maps of three apple cultivars. J, 1997, 122(3): 350-359.
[7] CONNER P J, BROWN S K, WEEDEN N F. Molecular-marker analysis of quantitative traits for growth and development in juvenile apple trees., 1998, 96(8): 1027-1035.
[8] 王彩虹, 王倩, 戴洪义, 贾建航, 束怀瑞, 王斌. 与苹果柱型基因()紧密连锁的分子标记的筛选. 农业生物技术学报, 2001, 9(2): 187-190.
WANG C H, WANG Q, DAI H Y, JIA J H, SHU H R, WANG B. Screening of molecular markers closely linked to apple columnar () gene., 2001, 9(2): 187-190. (in Chinese)
[9] TIAN Y K, WANG C H, ZHANG J S,JAMES C, DAI H Y. Mapping, a gene controlling the columnar phenotype of apple, with molecular markers., 2005, 145(1/2): 181-188.
[10] MORIYA S, IWANAMI H, KOTODA N, TAKAHASHI S, YAMAMOTO T, ABE K. Development of a marker-assisted selection system for columnar growth habit in apple breeding., 2009, 78(3): 279-287.
[11] VELASCO R, ZHARKIKH A, AFFOURTIT J, DHINGRA A, CESTARO A, KALYANARAMAN A, FONTANA P, BHATNAGAR S K, TROGGIO M, PRUSS D, SALVI S, PINDO M, BALDI P, CASTELLETTI S, CAVAIUOLO M, COPPOLA G, COSTA F, COVA V, DAL R I A, GOREMYKIN V,. The genome of the domesticated apple (Borkh.)., 2010, 42(10): 833-839.
[12] BAI T H, ZHU Y D, FERNA´NDEZ-FERNA´NDEZ F, KEULEMANS J, BROWN S, XU K N. Fine genetic mapping of thelocus controlling columnar growth habit in apple., 2012, 287(5): 437-450.
[13] BALDI P, WOLTERS P J, KOMJANC M, VIOLA R, VELASCO R, SALVI S. Genetic and physical characterization of the locus controlling columnar habit in apple (×Borkh.)., 2013, 31(2): 429-440.
[14] OTTO D, PETERSEN R, BRAUKSIEPE B, BRAUN P, SCHMIDT E R. The columnar mutation (gene) of apple (×) is associated with an integration of a Gypsy-like retrotransposon., 2014, 33(4): 863-880.
[15] MORIYA S, OKADA K, HAJI T, YAMAMOTO T, ABE K. Fine mapping of, a gene controlling columnar growth habit located on apple (×Borkh.) linkage group 10., 2012, 131(5): 641-647.
[16] MORIMOTO T, BANNO K. Genetic and physical mapping of, a gene controlling the columnar trait of apple., 2015, 11(1): 807.
[17] WADA M, IWANAMI H, MORIYA S, HANADA T, MORIYA- TANAKA Y, HONDA C, SHIMIZU T, ABE K, OKADA K. A root-localized gene in normal apples is ectopically expressed in aerial parts of columnar apples., 2018, 85(3): 389-398.
[18] PETERSEN R, DJOZGIC H, RIEGER B, RAPP S, SCHMIDT E R. Columnar apple primary roots share some features of the columnar- specific gene expression profile of aerial plant parts as evidenced by RNA-Seq analysis., 2015, 15(1): 34.
[19] OKADA K, WADA M, MORIYA S, KATAYOSE Y, FUJISAWA H, WU J Z, KANAMORI H, KURITA K, SASAKI H, FUJII H, TERAKAMI S, IWANAMI H, YAMAMOTO T, ABE K. Expression of a putative dioxygenase gene adjacent to an insertion mutation is involved in the short internodes of columnar apples ()., 2016, 129(6): 1109-1126.
[20] GASIC K, HERNANDEZ A, KORBAN S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction., 2004, 22(4): 437-438.
[21] 樊连梅, 王超, 刘更森, 原永兵. 苹果着色期实时定量PCR内参基因的筛选和验证. 植物生理学报, 2014, 50(12): 1903-1911.
FAN L M, WANG C, LIU G S, YUAN Y B. Screening and validation of real-time quantitative PCR internal reference genes in apple coloring period., 2014, 50(12): 1903-1911. (in Chinese)
[22] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using Real time quantitative PCR and the 2-ΔΔCTmethod., 2001, 25(4): 402-408.
[23] 李民吉, 张强, 李兴亮, 周贝贝, 杨雨璋, 周佳, 张军科, 魏钦平. SH6 矮化中间砧‘富士’苹果不同树形对树体生长和果实产量、品质的影响. 中国农业科学, 2017, 50(19): 3789-3796.
LI M J, ZHANG Q, LI X L, ZHOU B B, YANG Y Z, ZHOU J, ZHANG J K, WEI Q P. Effect of three different tree shapes on growth, yield and fruit quality of ‘Fuji’ apple trees on dwarfing interstocks., 2017, 50(19): 3789-3796. (in Chinese)
[24] ROBINSON T L. Recent advances and future directions in orchard planting systems., 2004, 732: 367-381.
[25] 马宝焜, 徐继忠, 孙建设. 关于我国苹果矮砧密植栽培的思考. 果树学报, 2010, 27(1): 105-109.
MA B K, XU J Z, SUN J S. Consideration for high density planting with dwarf rootstocks in apple in China., 2010, 27(1): 105-109. (in Chinese)
[26] KIM M Y, SONG K J, HWANG J H, SHIN Y U, LEE H J. Development of RAPD and SCAR markers linked to thegene conferring columnar growth habit in apple (Mill.)., 2003, 78(4): 559-562.
[27] IKASE L, DUMBRAVS R. Breeding of columnar apple-trees in Latvia., 2004, 2: 8-10.
[28] HEMMAT M, WEEDEN N F, CONNER P J, BROWN S K. A DNA marker for columnar growth habit in apple contains a simple sequence repeat., 1997, 122(122): 347-349.
[29] KELSEY D F, BROWN S K. ‘McIntosh Wijcik’: A columnar mutation of ‘McIntosh’ apple proving useful in physiology and breeding research., 1992, 46(2): 83-87.
[30] KROST C, PETERSEN R, SCHMIDT E R. The transcriptomes of columnar and standard type apple treesBorkh.) –A comparative study., 2012, 498(2): 223.
[31] WOLTERS P J, SCHOUTEN H J, VELASCO R, SI-AMMOUR A,BALDI P. Evidence for regulation of columnar habit in apple by a putative 2OG-Fe(II) oxygenase., 2013, 200(4): 993-999.
[32] CHEN Y H, ZHANG X B, WU W, CHEN Z L, GU H Y, QU L J. Overexpression of the wounding-responsive gene atmyb15 activates the shikimate pathway in., 2006, 48 (9): 1084-1095.
[33] CITOVSKY V, LIU B. Myosin-driven transport network in plants is functionally robust and distinctive., 2017, 114(8):1756-1758.
Screening and Expression Analysis ofCandidate Genes in Columnar Apple
BAI TuanHui, LI Li, ZHENG XianBo, WANG MiaoMiao, SONG ShangWei, JIAO Jian, SONG ChunHui
(College of Horticulture, Henan Agricultural University/Henan Key Laboratory of Fruit and Cucurbit Biology, Zhengzhou 450002)
【】Columnar growth in apple (×Borkh.) is a special type of dwarf mutation. Due to short internodes and lateral branches, a limited canopy and minimal pruning, columnar apple trees are well adapted to high density plantings. Based on the fine mapping of, the genes in the localization interval were screened, which laid a foundation for elucidating the molecular mechanism of columnar apple formation and breeding new varieties of columnar apples.【】Based on the latest apple genome data and transcriptome information, the buds, stem tips and leaves of columnar apple Wujia, Runtai No.1 and standard apple Fuji and Huashuo were used as test materials, and the genes between the fine mappinggene in interval from 27.66 Mb to 29.05 Mb were annotated and predicted. The coding sequence of the target gene was selected to detect primer specificity by RT-PCR, the real-time quantitative PCR was used to analyze the expression characteristics of target genes in different tissues and organs, and differential genes were screened out as candidate genes.【】The results showed that there were 67 genes between 27.66 Mb and 29.05 Mb in chromosome 10, 12 of which were non-coding RNAs (ncRNA), and the rest were genes with encoding proteins. According to the columnar and standard apple RNA-seq, there were 25 genes with more than 1 fold difference, 13 of which were up-regulated, and 12 genes were down-regulated in columnar apples. Among the 14 predicted genes, there were significant differences in the relative expression of the four genes MD10G1184100, MD10G1185400, MD10G1185600 and MD10G1190500 between shoot tips and lateral shoot tips in columnar and standard apples. The relative expression levels of MD10G1184100 and MD10G1185600 in the tip ofterminal bud of two columnar apples were significantly higher than those of both standard apples. The relative expression of MD10G1185400 and MD10G1190500 genes in the tip of lateral bud of two columnar apples was significantly higher than that of two standard apples, while the expression of MD10G1184100 gene in two columnar apples was significantly lower than that of standard apples. The gene expression patterns of different tissues or organs of four candidate genes were analyzed. The result showed that the expression of MD10G1184100 gene in the roots of columnar apples was significantly higher than that in other tissues. The MD10G1185400 and D10G1185600 genes were significantly expressed in lateral tips in columnar apples, while MD10G1190500 gene was prominently expressed in the terminal bud of columnar apples.【】4 genes with significant differences in columnar and standard apple could be regarded ascandidate genes, which laid a foundation for gene cloning and functional verification and apple tree-oriented genetic improvement.
apple; columnar trait; gene mapping; gene expression; candidate gene analysis

10.3864/j.issn.0578-1752.2019.23.015
2019-07-17;
2019-09-06
国家重点研发计划(2018YFD1000300)、河南省高等学校青年骨干教师培养计划(2018GGJS029)、河南省自然科学基金(162300410132)、河南省教育厅科学技术研究重点项目(13A210475)
通信作者白团辉,E-mail:tuanhuibai88@163.com。通信作者宋春晖,E-mail:songchunhui060305@126.com
(责任编辑 赵伶俐)

