UPLC-MS/MS测定普洱茶中黄曲霉毒素B1,B2,G1和G2
陈晓嘉 ,周芳梅 ,钟舒洁 ,李志龙 ,冯志强
1. 广东省食品质量监督检验站(广州 510308);2. 广东省食品工业研究所有限公司(广州 510308);3. 广东省食品工业公共实验室(广州 510308)
黄曲霉毒素由真菌黄曲霉和寄生曲霉产生,主要有4种:AFTB1,AFTB2,AFTG1和,是自然界已发现的理化性质最稳定的真菌毒素,有很强的毒性、致癌性和致畸毒性[3]。1993年,世界卫生组织将黄曲霉毒素划定为Ⅰ类致癌物质[4]。中国是茶叶生产、出口和消费大国,茶叶安全问题深受社会关注,近年来更是流传“普洱茶致癌说”,安全问题已演变为普洱茶生产、流通领域的重大挑战。目前黄曲霉毒素检测方法主要有酶联免疫吸附法[5-6]、薄层色谱法[7]、高效液相色谱(FLD)[8]、液相色谱质谱串联法[9]。ELISA、HPLC法检测普洱茶中四种黄曲霉毒素均存在假阳性,GB 5009.22—2016中液相色谱质谱串联法适用基质不包含茶叶类别。
试验采用免疫亲和柱进行净化处理,UPLC-MS/MS法测定普洱茶中AFTB1,AFTB2,AFTG1和AFTG2的含量。
1 材料与方法
1.1 仪器
Triple Quad 3500超高液相质谱联用仪(美国AB SCIEX公司);Turbo Vap LV 50位自动氮吹浓缩仪(瑞典Biotage公司);AG204电子分析天平(瑞士Mettler Toledo);KQ-500DE超声波清洗仪(昆山牌);CF15 RXII高速冷冻落地式离心机(日立);特异性免疫亲和柱(美国Romer Labs公司)。
1.2 材料与试剂
黄曲霉毒素混标(纯度98%,美国O2SI公司,ATFB1,ATFB2,ATFG1和ATFG2浓度分别为0.999 6,0.300 2,0.999 6和0.305 5 mg/L)。
乙腈(色谱纯,默克);氯化钠(分析纯,广州化学试剂厂);十二水磷酸氢二钠(分析纯,天津市化学试剂一厂);磷酸二氢钾(分析纯,广州化学试剂厂);氯化钾(分析纯,广州化学试剂厂);吐温-20(分析纯,阿法埃莎(天津)化学有限公司);甲醇(分析纯,天津市化学试剂一厂)。
1.3 色谱条件
Waters ACQUITY UPLC BEH C18液相色谱柱(2.1 mm×50 mm,1.7 μ m),流动相为0.1%甲酸乙腈+0.1%甲酸水,梯度洗脱,见表1;流速0.5 mL/min;进样量10.0 μL;柱温40 ℃。

表1 黄曲霉毒素流动相洗脱梯度
1.4 质谱条件
电喷雾离子源(ESI+),正离子扫描方式,多反应监测模式(MRM),电喷雾电压为5 500 V,离子源温度为550 ℃,气帘气(CUR)压力为38 psi,雾化器压力(GAS1)为55 psi,辅助加热器压力(GAS2)为60 psi。黄曲霉毒素AFTB1,AFTB2,AFTG1和AFTG2的其他相关质谱参数如表2所示。
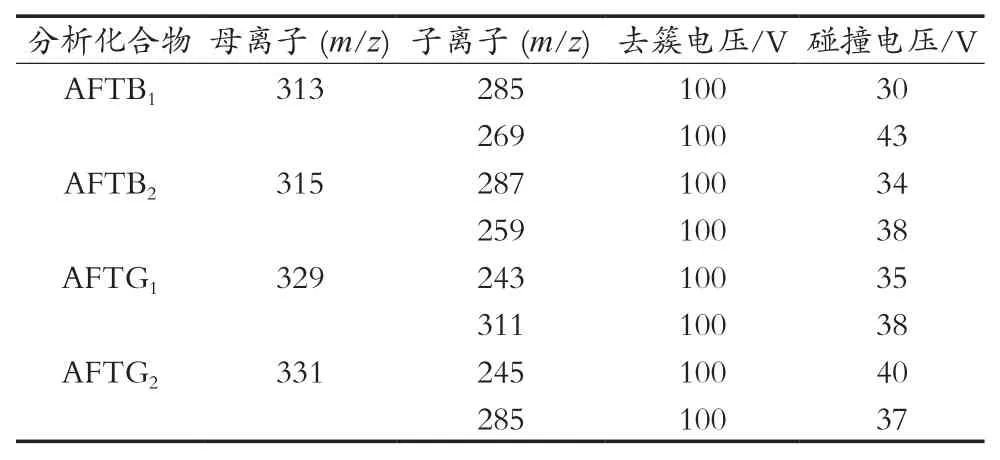
表2 黄曲霉毒素目标物选择反应检测优化参数
1.5 标准物质溶液配制
准确移取1.0 mL混标溶液于100 mL容量瓶中,加50%甲醇水稀释配制成储备液(AFTB1和AFTG1的质量浓度为10 ng/mL,AFTB2和AFTG2的质量浓度为3 ng/mL),精确移取0.01,0.05,0.1,0.2,0.5和0.8 mL储备液于1.0 mL容量瓶中,用50%甲醇水稀释定容,作为标准曲线溶液(其中0.01 mL仅含AFTB1和AFTG1),AFTB1和AFTG1曲线质量浓度为0.1,0.5,1,2,5和8 ng/mL,AFTB2和AFTG2曲线质量浓度为0.15,0.3,0.6,1.5和2.4 ng/mL。
1.6 样品处理
1.6.1 样品制备
取500 g普洱茶样品,经高速粉碎机磨细后过20目筛备测,取5.0 g待测样品加入25 mL 70%甲醇水溶液进行提取,超声30 min,以10 000 r/min离心5 min。取2 mL上清液,加入12 mL吐温溶液,旋涡1 min,待测。
1.6.2 样品净化
样品待测液以1 mL/min流速全部通过特异性免疫亲和柱,先用5 mL PBS溶液和5 mL水以1 mL/min流速淋洗亲和柱去掉杂质,再用2 mL甲醇洗脱,抽干亲和柱,收集全部洗脱液至试管中,在50 ℃下用氮气将洗脱液吹至近干,用50%甲醇水定容至1.0 mL,旋涡1 min复溶,用微孔过滤膜(0.2 μ m)压滤后进样上机。
2 结果与讨论
2.1 样品提取液的优化
对于茶叶的前处理,首先要加提取液进行浸泡超声提取毒素,黄曲霉毒素极性大,试验提取液体系选择了以甲醇-水(体积比为30︰70,50︰50和70︰30)和乙腈-水(体积比为30︰70,50︰50和70︰30)为提取剂对样品进行提取,检测含量,计算回收率,回收率结果见图1。结果表明,甲醇-水(体积比70︰30)和乙腈-水(体积比70︰30)的提取效率最高,回收率均在80.3%以上。乙腈毒性较大,故试验选择了甲醇-水(体积比70︰30)作为提取剂。
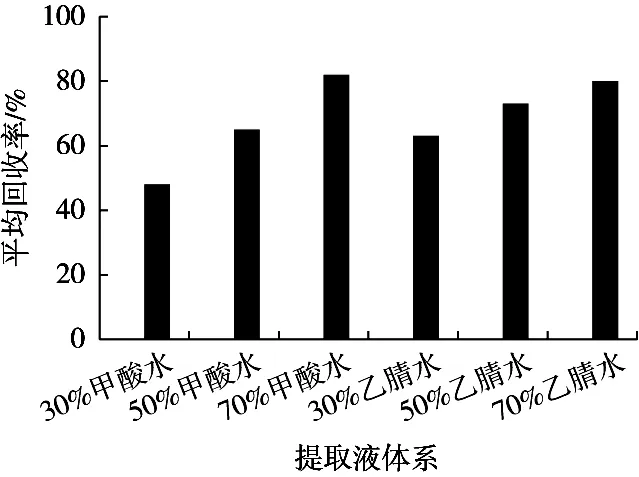
图1 不同提取液体系回收率
2.2 样品净化的优化
试验同时选用了多功能净化柱与免疫亲和柱对净化效果做比对,使用多功能净化柱进行净化测定普洱茶中的4种黄曲霉毒素的加标回收率在101%~135%之间,使用免疫亲和柱进行净化测定普洱茶中的黄曲霉毒素的加标回收率在80.3%~116%之间。经多功能净化柱净化后的样品仍有明显的基质干扰,净化效果不理想,导致含量偏高。多功能净化柱操作方便快捷,但不如免疫亲和柱的特异性显著,能有效吸附杂质;多功能净化柱适用于简单基质的样品,对于茶叶这种基质复杂的样品,免疫亲和柱更为适用。
2.3 色谱条件的优化
试验选择了Waters ACQUITY UPLC BEH C18液相色谱柱(2.1 mm×50 mm,1.7 μm)为分离柱,在正离子模式下,流动相中加入0.1%甲酸水溶液,有利于化合物的离子化。大多数真菌毒素易溶于甲醇和乙腈等有机试剂。流动相分别选择甲醇和乙腈做比对。结果证明,选择甲醇作流动相时,色谱分离效果比乙腈好,但是离子化程度受抑制,离子响应值下降,灵敏度较低;乙腈的离子化程度高于甲醇,离子响应值较高,灵敏度增高,因此采用0.1%甲酸乙腈+0.1%甲酸水作为流动相。经过优化,确定了流动相比例和梯度条件,优化后的流动相洗脱梯度见表1。
2.4 质谱条件优化
试验以0.1%甲酸乙腈+0.1%甲酸水作为流动相,对4种黄曲霉毒素进行质谱条件的优化,选用MRM多反应监测模式检测4种黄曲霉毒素,4种黄曲霉毒素在正离子模式下获得[M+H]+的响应值最大,通过母离子扫描模式,确定母离子去簇电压最优参数,再通过子离子模式,进一步优化碰撞电压,选择响应最佳的子离子用于定量,优化后的MRM条件见表2。
2.5 质谱结果
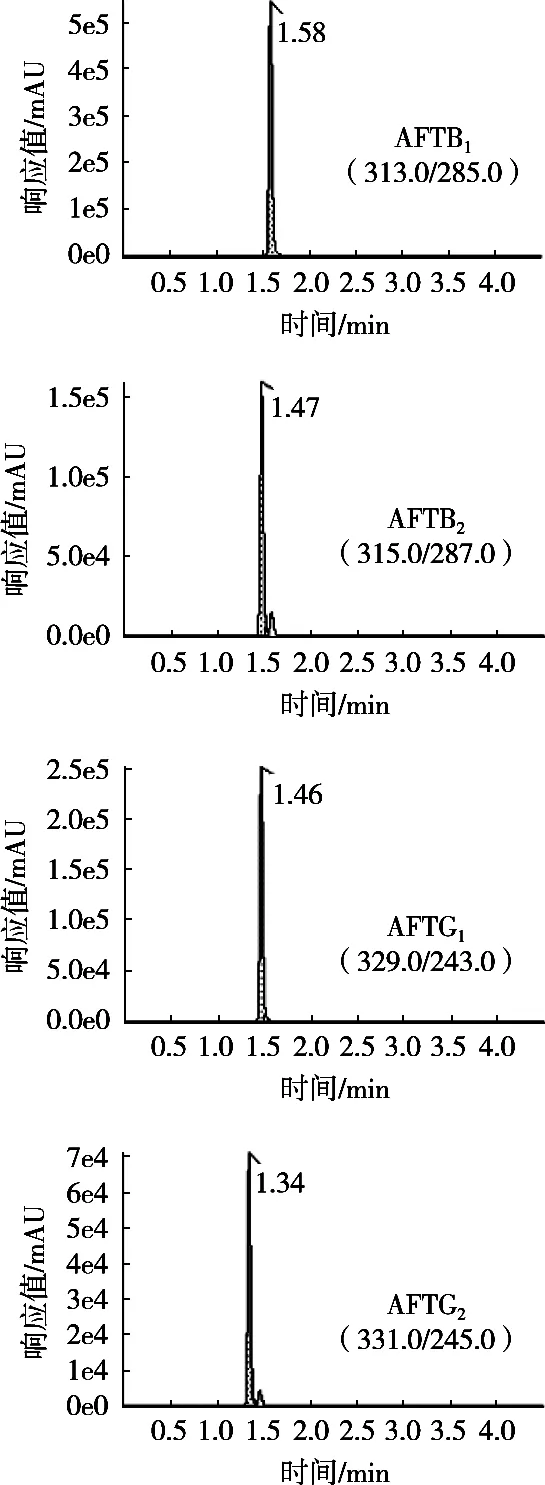
图2 4种黄曲霉毒素的MRM离子图
取标样溶液(含80 ng/mL AFTB1和AFTG1,24 ng/mL AFTB2和AFTG2)上机分析,AFTB1,AFTB2,AFTG1和AFTG2的 MRM离子图如图2所示。
2.6 线性关系、检测限和定量限
以待测黄曲霉毒素定量离子色谱峰面积为纵坐标,黄曲霉毒素浓度为横坐标,进行线性关系考察。黄曲霉毒素B1和G1在0.1~8 ng/mL质量浓度范围内呈良好线性关系,相关系数为0.999 4~0.999 6;黄曲霉毒素B2和G2在0.15~2.4 ng/mL质量浓度范围内呈良好线性关系,相关系数为0.999 0~0.999 1,具体见表3。
取阴性样品,加入标液,同样品处理方法制备、测定,以3倍信噪比确定检出限(LOD),以10倍信噪比计算方法确定定量限(LOQ)。黄曲霉毒素B1,B2,G1和G2的检出限(LOD)均为0.25 μg/kg,定量限(LOQ)分别为0.60,0.60,0.60和0.80 μg/kg,具体见表3。
2.7 精密度
取阴性样品,加入适当的稀释混合储备液,最终含量分别为:AFTB1和AFTG150 μg/kg;AFTB2和AFTG215 μg/kg。样品处理方法平行制备6份,进行4种黄曲霉毒素精密度测试。黄曲霉毒素B1,B2,G1和G2的RSD(n=6)分别为2.7%,3.4%,2.4%和3.6%,具体见表3。
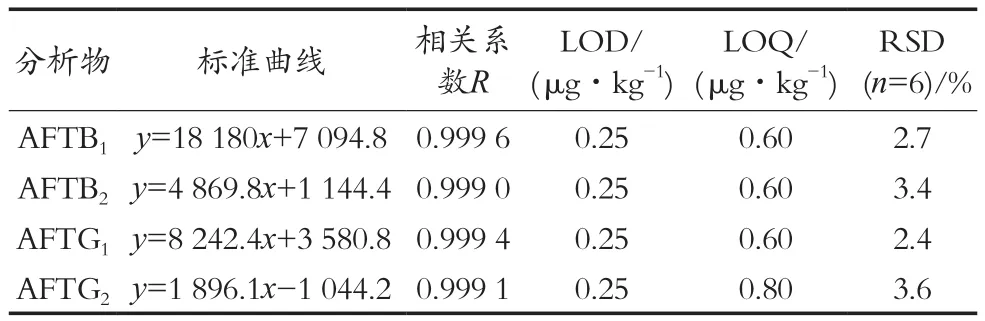
表3 4种黄曲霉毒素线性关系、检测限、定量限和重复性
2.8 方法回收率
取阴性样品,分别加入适量的混合标准溶液,最终加标含量成低、中、高3个浓度,每个浓度各测6次。分别在5 g样品中加入适量的混合标液,使AFTB1和AFTG1含量分别为0.25,5和20 ng/g,AFTB2和AFTG2含量分别为0.75,1.5和6 ng/g,同样品处理方法制备,检测含量,其回收率为80.3%~116.7%,相对标准偏差≤5.2%,具体见表4。
2.9 检测方法的对比和分析
目前检验黄曲霉毒素的常用检测方法主要有酶联免疫吸附法(ELISA)、薄层色谱法(TLC)、免疫亲和柱净化-柱后衍生化-高效液相色谱-荧光检测方法。试验选用酶联免疫吸附法(ELISA)、免疫亲和柱净化-柱后衍生化-高效液相色谱-荧光检测方法(HPLC-FLD)与所建立的超高效液相色谱-串联三重四级杆质谱法(UPLC-MS/MS)三种方法对普洱茶中4种黄曲霉毒素进行方法比对检测,方法比对结果见表5。ELISA法与HPLC-FLD法检测普洱茶中的黄曲霉毒素B1,B2,G1和G2含量均出现假阳性结果。由于茶叶含有酚类物质,故不适用于ELISA法检测黄曲霉毒素。HPLC-FLD方法主要用分析物的保留时间作定性依据,茶叶基质复杂,基质中的组分与分析物极性相似,导致保留时间相似,故有误判,因此HPLCFLD方法不适用于检测普洱茶中的4种黄曲霉毒素。
UPLC-MS/MS方法采用分析物的保留时间和离子对作为定性依据,不存在误判。因此在分析物定性方面,UPLC-MS/MS方法优于HPLC-FLD方法,样品经过特异性免疫亲和柱后,在MRM多反应监测模式下,可有效屏蔽茶叶的复杂基质,实现对目标物质的净化,能准确、快速地检测茶叶中的4种黄曲霉毒素含量,有效地避免假阳性或者假阴性结果的出现。免疫亲和净化-超高效液相色谱串联质谱法具有快速、准确、灵敏等特点,有助于提高分析效率,降低成本,为茶叶中4种黄曲霉毒素含量的测定提供参考。
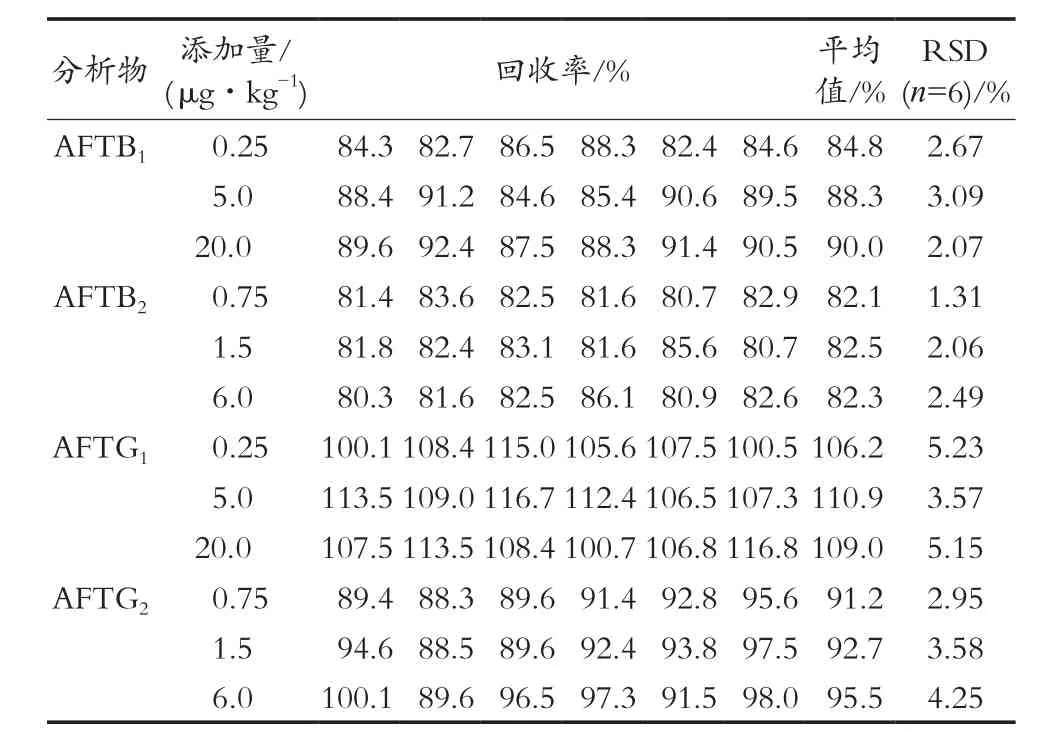
表4 4种黄曲霉毒素回收率和重复性
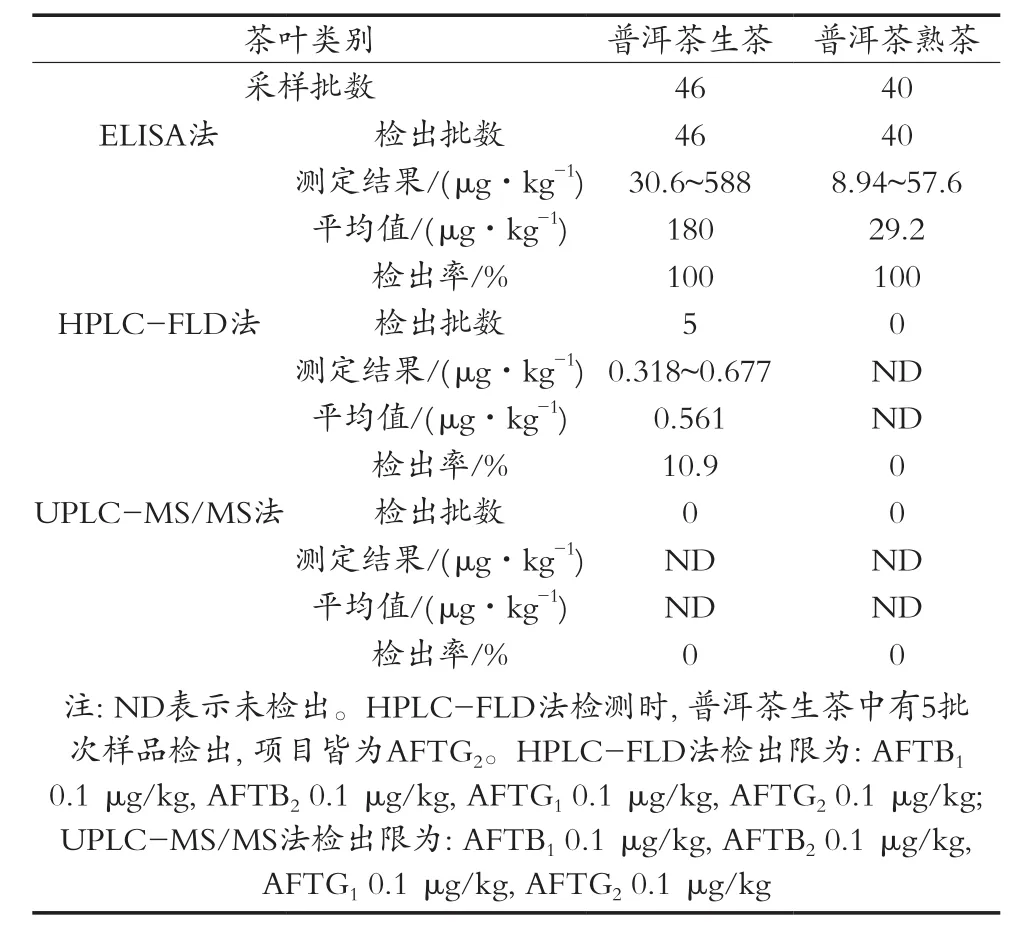
表5 三种检测方法结果对比
3 结论
试验建立了超高效液相色谱-串联三重四级杆质谱法测定普洱茶中黄曲霉毒素B1,B2,G1和G2的方法。普洱茶样品经甲醇-水(70︰30,V/V)提取后,采用免疫亲和柱净化样品提取液,减少样品杂质的干扰。试验分别对样品前处理方法、色谱条件、质谱条件进行了比较和优化,所建立的方法操作简单,回收率和精密度高,灵敏度高,解决了原有方法测定普洱茶中黄曲霉毒素假阳性的问题。该方法适用于普洱茶中黄曲霉毒素B1,B2,G1和G2的检测。

