HPLC法测定缓解视疲劳片中全反式叶黄素含量
胡宝玲,于桂芳,郭小莉,胡军华,王婧,萧伟*
江苏康缘药业股份有限公司(连云港 222001)
缓解视疲劳片是由肉苁蓉、枸杞、菊花、葛根、叶黄素及辅料经加工制成的具有缓解视疲劳作用的保健食品,叶黄素为其主要有效成分。叶黄素是从万寿菊花瓣和玉米中提取而来的一种类胡萝卜素,被广泛应用于眼科疾病的保健食品中[1]。有文献报道,叶黄素有多种几何异构体,经光碘化全反应主要产生6种顺式异构体[2],但在自然界中顺式叶黄素含量极低,其生物活性也很低[3];另外,从植物中提取的叶黄素和玉米黄素是共存的,它们互为同分异构体[4],很难将2种物质完全分离。目前国内外文献报导的叶黄素常用的检测方法有紫外分光光度法[5-6]、HPLC-UV法[7-10]、HPLC-MS法[3-11]。紫外分光光度法测定的结果是总类胡萝卜素含量,包括全反式叶黄素、多个顺式叶黄素及玉米黄素;HPLC-UV法,大多采用C18色谱柱[12-14],不能将叶黄素的几何异构体分开。惠伯棣等[8]使用C30色谱柱将叶黄素和玉米黄素分开,但只是定性分析,未能将全反式叶黄素进行定量。李宁等[10]使用C30色谱柱将叶黄素和玉米黄素分别进行定量,但供试品的前处理较繁琐;HPLC-MS法虽然能将全反式叶黄素和顺式异构体分开,但是质谱仪价格昂贵,成本较高,不具有普适性。目前,关于保健食品中叶黄素的测定方法多采用国标[15],国标中供试品的处理针对的是食品和乳制品,不适用于微囊包合类产品的含量测定,而且国标在结果处理方面将全反式和顺式叶黄素之和计算叶黄素含量,不能真实反映产品质量。因此,建立一个快速高效测定全反式叶黄素的方法非常必要。
针对研发的保健食品的特点,开发一种操作简便、能够很好地分离叶黄素几何异构体和同分异构体、结果处理简单的方法,并进行系统方法学验证,该方法分离度、准确性、重复性、灵敏度均符合要求。该方法可为监管缓解视疲劳类产品中叶黄素的质量控制提供参考。
1 材料
1.1 仪器设备
液相色谱仪(SHIMADZU-20AT);电子天平(METTLER TOLEDO XP6,METTLER TOLEDO MS-105Du,METTLER TOLEDO AL204);数控超声清洗器(KQ-500DB型,昆山市超声仪器有限公司);台式离心机(TG16MW,湖南赫西仪器装备有限公司);超纯水机(Milli-Q Academic,美国MiLLipore)。
1.2 试剂
3批保健品缓解视疲劳片样品(江苏康缘药业股份有限公司在研品种,由硬脂酸镁、交联纤维素钠、叶黄素、肉苁蓉、枸杞、菊花、葛根经加工制成的具有缓解视疲劳作用的保健食品,分别为20180901批、20180902批和20180903批);叶黄素对照品(纯度85.6%,LOT LRAB3708批,Sigma公司);甲醇(色谱纯,LOT 17070505批,TEDIA);二丁基羟基甲苯(化学纯,20171011批,国药集团化学试剂有限公司);甲基叔丁基醚(色谱纯,LOT 095170批,MREDA);N, N-二甲基甲酰胺(色谱纯,LOT LS30R61批,北京百灵威科技有限公司);乙醇(色谱纯,LOT 017112批,MREDA)。
2 方法与结果
2.1 色谱条件
采用YMC Carotenoid C30(4.6 mm×250 mm,5 μm)为色谱柱;以甲醇/水(88︰12,V/V)为流动相A相,以甲基叔丁基醚为B相,2项均含有0.1%BHT,梯度洗脱;流速0.8 mL·min-1;柱温30 ℃;检测波长445 nm;进样体积20 μL。
2.2 对照品溶液的制备
取5.512 mg对照品,精密称定于100 mL棕色量瓶中,用0.1% BHT的乙醇溶液溶解,并定容至刻度,摇匀,即得储备液。分别精密移取0.2,0.4,0.8,1.2,1.6和2.0 mL储备液于10 mL棕色容量瓶中,用0.1%BHT的乙醇溶液定容,稀释成质量浓度为0.94,1.89,3.77,5.66,7.55和9.44 μg·mL-1的系列标准溶液。
2.3 供试品溶液的制备
取样品,除去薄膜衣片,研细,取300 mg粉末,精密称定,置于100 mL棕色量瓶中,加入5 mL水,超声分散20 min,加0.1% BHT的乙醇溶液至接近刻度,超声5 min,用0.1% BHT的乙醇溶液定容至刻度,摇匀,离心,即得。
2.4 专属性考察
阴性供试品溶液的制备:取300 mg不含叶黄素的本品粉末,按照2.3小节制备阴性供试品溶液,分别吸取阴性供试品溶液、供试品溶液和对照品溶液,各20 μL注入高效液相色谱仪,由图1可以看出,供试品色谱中呈现与对照品色谱主峰保留时间一致的色谱峰,阴性供试品色谱图中在待测成分保留时间处无杂质峰出现,表明此方法专属性良好。
2.5 线性关系考察
取2.2小节的系列浓度,平行进样2针,以色谱峰面积的平均值为纵坐标,以浓度为横坐标,绘制标准曲线。得出线性方程y=285 403x-560.6(r=0.999 9),全反式叶黄素在0.94~9.44 μg·mL-1质量浓度范围内与峰面积线性关系良好。
2.6 检出限
取线性用低浓度对照品溶液逐级稀释,以信噪比S/N=3相应值为检出限,以取样量300 mg,定容体积100 mL计算,全反式叶黄素检出限为9.1×10-6mg·kg-1。
2.7 精密度试验
取2.2小节的5.66 μg·mL-1含全反式叶黄素的对照品溶液及2.3小节的供试品溶液,按照2.1小节的色谱条件分别连续进样6次,测得峰面积,计算RSD,对照品溶液和供试品溶液的RSD分别为0.62%和0.52%。RSD均小于2%,表明仪器精密度良好。
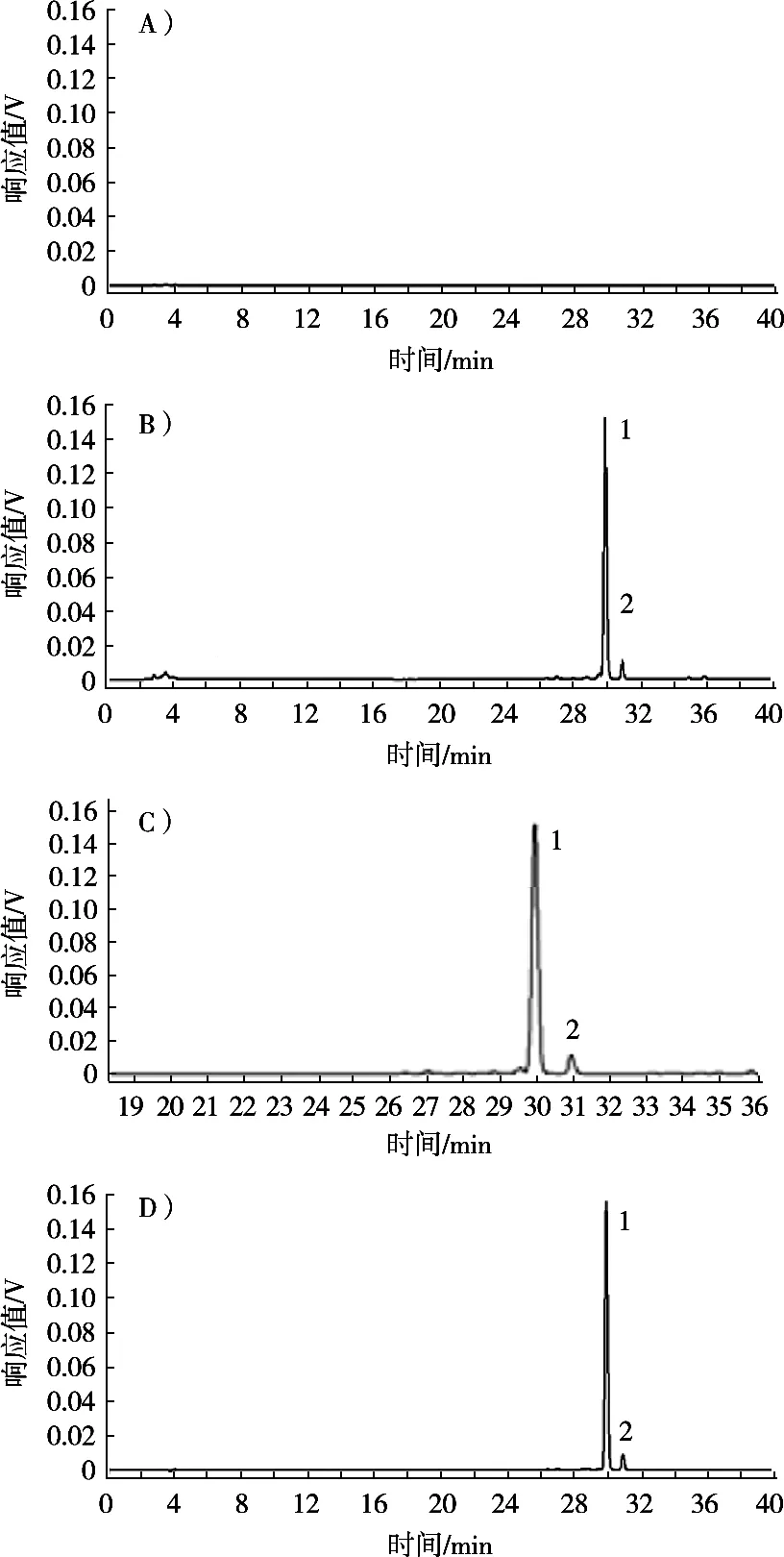
图1 保健食品缓解视疲劳片的HPLC图
2.8 稳定性试验
分别取同一对照品溶液和同一供试品溶液,分别于0,1,2,4,6,9,12,15,22,23和24 h按照2.1小节的色谱条件各进样1次,测得全反式叶黄素峰面积,计算RSD。对照品溶液和供试品溶液的RSD分别为0.98%和0.51%,均小于2%,表明对照品溶液和供试品溶液在24 h内稳定性良好。
2.9 重复性试验
取同一批样品(20180901批),按照2.3小节平行制得6份供试品溶液,按照2.1小节的色谱条件测定,计算全反式叶黄素的含量及RSD值。结果表明,全反式叶黄素含量为2.04 mg·g-1,RSD为1.26%,表明该方法重复性良好。
2.1 0 回收率试验
取7.964 mg对照品(纯度0.856%),精密称定于25 mL棕色量瓶中,用0.1% BHT的乙醇溶液溶解,并定容至刻度,摇匀,即得质量浓度为0.272 7 mg·mL-1的加标溶液。
取150 mg(样品中叶黄素含量为0.002 04 mg·kg-1)本品(20180901批),精密称定于100 mL棕色容量瓶中,分别加入0.5,1.0和1.5 mL对照品溶液,按照2.3小节分别制备低(0.5︰1)、中(1.0︰1)、高浓度(1.5︰1)的加样供试品溶液,每种浓度分别制备3份平行样,共9份。按照2.1小节的色谱条件进行测定。结果见表1。全反式叶黄素的平均回收率为100.48%,RSD为1.59%。平均回收率均为95%~105%,RSD小于2%,说明方法准确性较好。
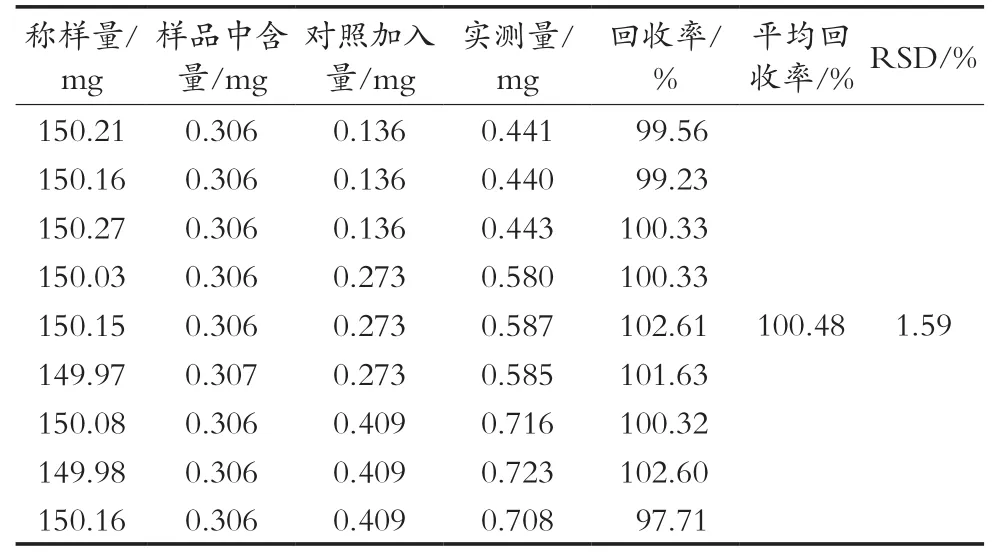
表1 全反式叶黄素的加样回收率试验(N=9)
2.1 1 样品含量测定
取3批缓解视疲劳片样品(批号分别为20180901,20180902和20180903),按照2.3小节制备供试品溶液,按照2.1小节的色谱条件进行测定,结果见表2。计算全反式叶黄素的理论含量为1.9 mg·kg-1,由表2可知实测值与理论值较为接近。

表2 3批样品含量测定结果
3 讨论
3.1 色谱柱的选择
通过查阅文献,C30为固定相色谱柱分离类胡萝卜素的几何异构体具有明显的优势[16]。因此选择Reprospher C30-DE(4.6 mm×250 mm,5 μm)、Welch ultimate® XB-C30(4.6 mm×250 mm,5 μ m)、YMC Carotenoid C30(4.6 mm×250 mm,5 μ m)3种不同品牌的C30色谱柱作为考察对象。结果表明,使用Reprospher C30色谱柱,全反式叶黄素和玉米黄质合并为1个峰,无法将2种物质分离;使用Welch ultimate®XB-C30色谱柱,全反式叶黄素和玉米黄素未达到基线分离;使用YMC Carotenoid-C30色谱柱,全反式叶黄素和玉米黄素达到基线分离,峰型好,所以选择YMC Carotenoid-C30(4.6 mm×250 mm,5 μm)色谱柱。
3.2 流动相的选择
对乙腈-甲基叔丁基醚、乙腈-甲醇-甲基叔丁基醚、甲醇-水-甲基叔丁基醚分别进行考察,确定甲醇-水-甲基叔丁基醚为流动相,为使全反式叶黄素与杂质峰能达到基线分离,降低B相甲基叔丁基醚的比例,发现随着甲基叔丁基醚比例降低,全反式叶黄素出峰时间延长,全反式叶黄素与杂质分离效果越好,但是降低到一定程度,全反式叶黄素出峰时间太长,峰型较宽。通过对比例的摸索,确定流动相0~30 min,B 0%~50%;30.0~30.1 min,B 50%~0%;30.1~40.0 min,B 0%。在此条件下,全反式叶黄素、顺式叶黄素及玉米黄素均可得到基线分离。
3.3 破囊溶剂的选择
为增加叶黄素在制剂中的稳定性,叶黄素往往以微囊包合物的形式加入到产品中[17],对于供试品的制备方法,需先进行破囊处理,由于囊材是由玉米淀粉和辛烯基琥珀酸淀粉钠包合成微囊,因此选择对微囊具有一定溶解性的溶剂先进行破囊处理。分别考察水、N, N-二甲基甲酰胺、无水乙醇不同破膜溶剂,发现N, N-二甲基甲酰胺和水对全反式叶黄素含量无显著性差别,但是水经济、环保,最终确定水作为破囊溶剂。
3.4 指标选择
国家标准以全反式及顺式叶黄素之和计算叶黄素的含量,原因是食品中未经包合的叶黄素容易受外界环境的影响转变成顺式,但叶黄素经微囊包合后稳定性提高。研发的产品经影响因素考察(高温60 ℃、高湿90%、强光),5和10 d的叶黄素含量均无明显变化,确实说明该产品的稳定性较好,且顺式异构体中含量最高的占全反式比例的1.5%,顺式异构体总和约占全反式比例的4.5%,含量较低。另外,有文献报道,顺式叶黄素生物活性低[3],决定产品质量的成分为全反式叶黄素。因此选择含量高、稳定性好、生物活性高的全反式叶黄素进行定量。
3.5 对照品浓度的校准
国家标准中规定对照品的纯度为98%,但经文献研究,叶黄素中总会混有3%~6%的玉米黄素,二者为同分异构体[18],分离十分困难,试验采用Sigma公司的对照品,经GC-MS联用测得全反式叶黄素纯度为85.6%,这与采用HPLC-UV测得的结果一致,全反式叶黄素在24 h内稳定存在,因此无需对对照品浓度进行校正。
4 结论
采用YMC Carotenoid-C30色谱柱能够将全反式叶黄素和玉米黄素分开,且能对全反式叶黄素准确定量。经过系统方法学验证,该方法专属性、精密度、准确性、重复性等均符合要求。该方法供试品处理操作简便,结果计算简单,适用于缓解视疲劳类产品中全反式叶黄素的含量测定,为该类产品的质量控制提供参考依据。

