不同蛋白酶水解小米分离蛋白工艺
张建萍,陈振家,闫舟,王美玉,王玥,刘恩岐*
1. 徐州工程学院江苏省食品资源开发与质量安全重点建设实验室(徐州 221111);2. 山西农业大学食品科学与工程学院(太谷 030801)
谷子又称为栗,是山西省的主要农作物之一,也是古代的“谷神”,更是中华民族上下五千年历史中占有重要地位的旱作农作物[1]。将谷子脱壳,就制成小米,小米不仅营养全面,而且也是绝佳的保健食品。小米蛋白是一种低敏性无过敏原蛋白,近年来国内一些专家学者开始转向对小米蛋白的研究[2]。随着对小米保健功能、营养特性的关注,小米多肽出现在人们视线中。小米多肽是指小米蛋白经过酶解或者微生物技术等处理方式所得到的酶解产物,即形成不同分子量的多肽段;与小米蛋白相比,小米多肽具有易于消化吸收、可降低胆固醇含量、促进脂肪代谢的生理功能,营养价值更高[3-4]。研究指出小米蛋白提取碱法优于盐法[5],使用超声辅助后小米蛋白的提取率显著提高[6],试验采用碱提酸溶法并加以超声辅助提取小米蛋白[7-8]。采用胃蛋白酶和碱性蛋白酶来水解小米蛋白,以水解度为衡量,获得产量更大的多肽混合物,以便后续对小米多肽功能特性的研究,并采用OPA法测定小米蛋白水解度[9-11]。
1 材料与方法
1.1 试验材料
小米(晋谷21号,山西晋中乐民恒兴杂粮加工厂)。
1.2 试验试剂与设备
试剂均为分析纯,均用普通蒸馏水配制即可。
石油醚(沸程30~60 ℃)、盐酸、氯化钠、无水乙醇、氢氧化钠、尿素、甲醇(天津市凯通化学试剂有限公司);蛋白酶(酶活力>10万 U/g)、碱性蛋白酶(酶活力>20万 U/g)、对二苯甲醛(OPA)、硫苏糖醇(DTT)、丝氨酸标准品、考马斯亮蓝G-250(考马斯亮蓝比色法用)、牛血清蛋白、SDS、巯基乙醇、溴酚蓝、丙烯酰胺、Tris、APS、氨基乙酸、低分子量蛋白质Marker(14.4~97.4 kD):Solarbio品牌。
小型高速粉碎机(YS-04 A,北京燕山正德机械设备有限公司);数显式电热恒温水浴锅(上海跃进医疗器械有限公司);数控超声波清洗器(KQ 5200 DE型,昆山市超声仪器有限公司);pH酸度计(奥豪斯仪器(常州)有限公司);高速离心机(安徽中科中佳科学仪器有限公司);723可见分光光度计(上海菁华科技有限仪器公司);DYY-7 C型电泳仪电源(北京市六一仪器厂);DYCZ-4 OG型电泳仪(北京市六一仪器厂)。
1.3 试验方法
1.3.1 小米蛋白粉制备
将小米粉碎,用石油醚搅拌脱脂,真空抽滤得到脱脂小米粉;称取适量脱脂小米粉,以1︰8固液比加入蒸馏水,搅拌均匀后调节pH 9.0,浸提2 h;50 ℃在50 W功率下,超声提取10 min,4 000 r/min离心15 min;取上清液调节pH 4.5,静置2 h;弃去上清液,4 000 r/min离心10 min;弃去上清液,水洗2次,沉淀即为小米蛋白粗提物;将制得的蛋白粗提物配成200 mL溶液,搅拌均匀,调节pH 7.0,匀浆机匀浆至出现大量泡沫,调节pH 7.0,真空冷冻干燥所得的中性溶液,即得到小米蛋白粉。
1.3.2 水解反应单因素试验
配制浓度为1%的蛋白溶液,按照[E]/[S]为0.5%,1.0%,5.0%,10.0%和20.0%比例加入碱性蛋白酶,置于35,40,45,50和55 ℃水浴锅中,在pH 7,8,9,10和11条件下进行水解,分别在酶解0,5,10,15,20,25,30,40,50和60 min时进行取样,取样后立即将酶解液置于85 ℃灭酶10 min。
按照[E]/[S]为0.5%,1.0%,5.0%,10.0%和20.0%比例在浓度1%蛋白溶液中加入胃蛋白酶,置于25,30,35,40和45 ℃水浴锅中,在pH 0,1,2,3和4条件下进行水解,分别在酶解0,5,10,15,20,25,30,40,50和60 min时进行取样,取样后立即将酶解液置于85 ℃灭酶10 min。
1.3.3 OPA法
波长选择。选择340 nm作为小米蛋白水解度测定波长。
标准曲线的绘制。分别吸取0,400,480,560,640,720和800 μL L-丝氨酸标准溶液于试管中,不足800 μ L的加水补足,分别加入6 mL OPA试剂,混合均匀,反应2 min后,在340 nm下测定其吸光度,以丝氨酸浓度为横坐标,吸光度为纵坐标绘制标准曲线。
水解液水解度的测定。取200 μL水解液,稀释至测得的数值在标准曲线的范围内,取800 μL稀释水解液,加入6 mL OPA试剂,反应2 min,测得吸光度。在标准曲线上查出Cserine-NH2(mmol/g),利用式(1)~(3)计算水解度。
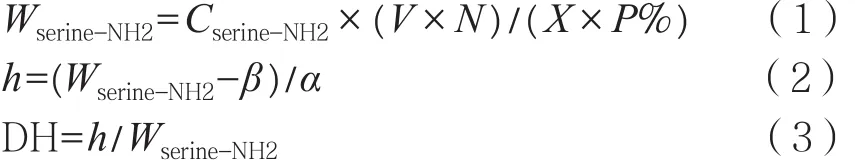
式中:Cserine-NH2为每克蛋白中所含有L-丝氨酸含量,mmol/g;X为样品质量,g;P%为样品中蛋白质质量分数;V为样品中水解液体积,L;N为水解液的稀释倍数;H为水解过程中,每克小米蛋白被断裂肽键数目,mmol/g;Wserine-NH2,即Htot,为小米蛋白中含有的总肽键数目,mmol/g;α、β均为修正因子,α视为常数1.00,β为每次测在0 min时所测定的水解度吸光度的平均值。
1.3.4 小米蛋白组分SDA-PAGE电泳[12]
组装电泳装置→制分离胶→制浓缩胶→加入缓冲液→上样→通电源→固定→染色→脱色→成像分析
2 结果与分析
2.1 小米蛋白水解时间的确定
2.1.1 胃蛋白酶水解时间确定
由图1可知,胃蛋白酶在蛋白浓度1%,[E]/[S]=10%,pH 2,温度35 ℃条件下进行水解,在1 h内水解度呈现急速增长状态,而2~6 h时水解度呈现极其缓慢上升趋势;从图2该水解反应所对应的电泳图谱可见,水解过程进行1 h,大分子量的肽水解完全,水解2~6 h过程中,水解所形成的小肽基本不再发生变化,所以对于试验来讲,只要测定胃蛋白酶在1 h内的水解度变化便可以找到最佳水解温度、pH及底物浓度[E]/[S]最适比例。
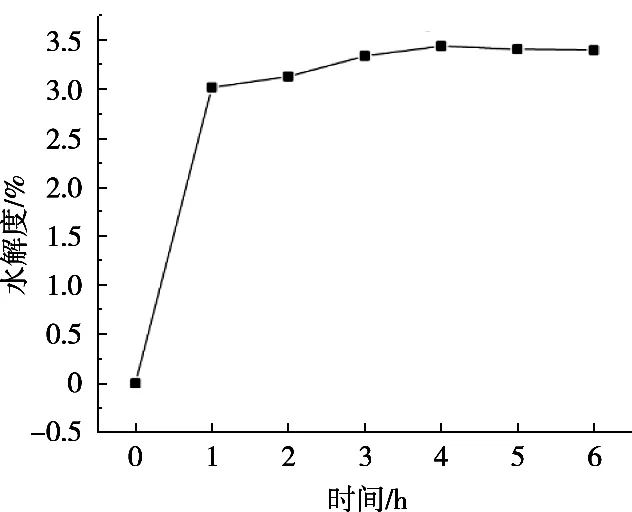
图1 不同时间胃蛋白酶的水解度
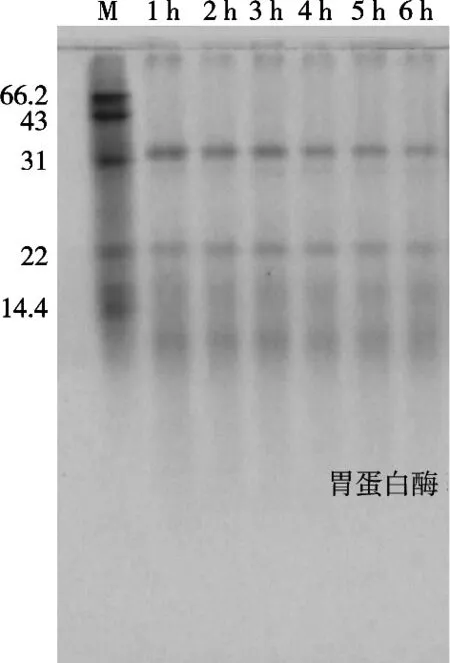
图2 不同时间胃蛋白酶水解小米蛋白电泳图
2.1.2 碱性蛋白酶水解时间确定
由图3可知,碱性蛋白酶在蛋白浓度1%,[E]/[S]=10%,pH 9,温度45 ℃条件下进行水解,在1 h内水解度呈现急速增长状态,而2~6 h时水解度呈现比较缓慢上升趋势;从图4该水解反应所对应的电泳图谱可见,水解过程进行1 h,大分子量的肽早已水解完全,水解2~6 h,水解所形成的小分子肽基本没有发生变化,所以试验只要测定碱性蛋白酶在1 h内的水解度变化,便可找到最佳水解温度、pH及底物浓度[E]/[S]最适比例。
2.2 胃蛋白酶水解单因素试验结果
2.2.1 不同底物浓度对胃蛋白酶水解度的影响
由图5可知,胃蛋白酶在pH 2,温度35 ℃,仅以底物浓度[E]/[S]比例为变量的单因素试验中,随着底物浓度升高,水解度呈上升趋势,但底物浓度比例上升至10%和20%时的水解度变化不是很大,为在相同条件下,能用较少酶量就可达到相接近的效果,所以选择底物浓度[E]/[S]=10%为最佳水解条件。
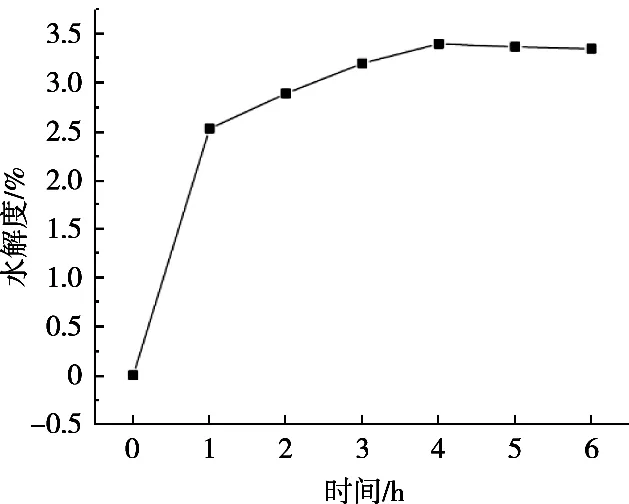
图3 不同时间碱性蛋白酶的水解度
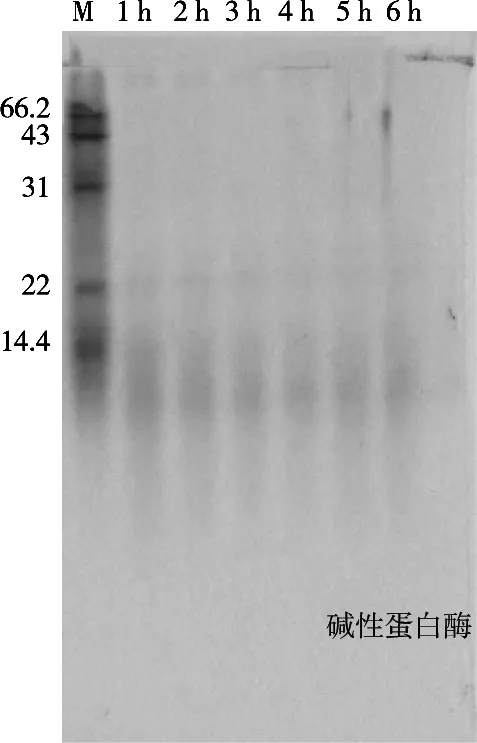
图4 不同时间碱性蛋白酶水解小米蛋白电泳图
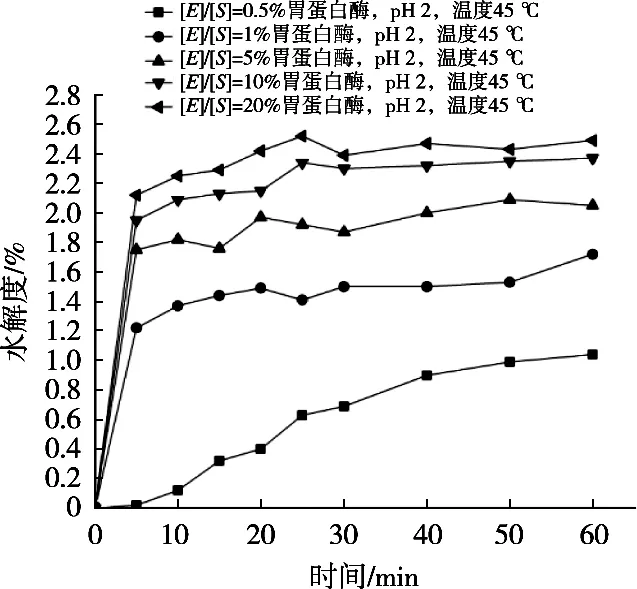
图5 不同底物浓度下胃蛋白酶的水解度
2.2.2 不同温度对胃蛋白酶水解度的影响
由图6可知,胃蛋白酶在底物浓度[E]/[S]=10%,pH 2,仅以温度为变量的单因素试验中,在1 h水解过程中,随着温度上升,在25~35 ℃水解度呈现逐渐上升趋势,但在35~45 ℃水解度变化不明显,所以水解温度选取35 ℃为胃蛋白酶最佳水解温度,在相同前提条件下,选择较低温度便可达到相接近结果,节能且高效。
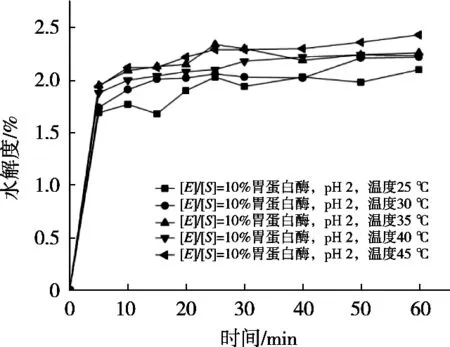
图6 不同温度下胃蛋白酶的水解度
2.2.3 不同pH对胃蛋白酶水解度的影响
由图7可知,胃蛋白酶底物度[E]/[S]=10%,温度35 ℃,仅以pH为变量的单因素试验中,在1 h水解过程中,随着pH升高水解度逐渐增高,但在pH 2,1和0时水解度的上升趋势极度缓慢,所以pH 2为胃蛋白酶最佳水解pH,在相同前提条件下,选择较低pH即可达到相接近的效果,条件较为温和。
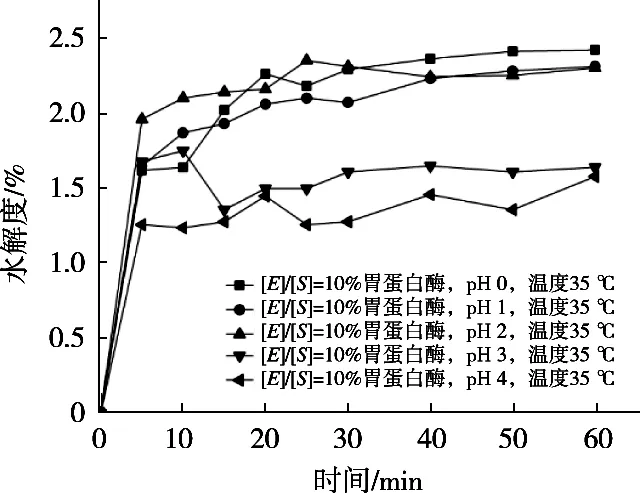
图7 不同pH下胃蛋白酶的水解度
2.3 碱性蛋白酶水解单因素试验结果
2.3.1 不同底物浓度对碱性蛋白酶水解度的影响
由图8可知,胃蛋白酶在pH 2,温度35 ℃,仅以底物浓度[E]/[S]比例为变量的单因素试验中,随着底物浓度升高,碱性蛋白酶水解度先快速升高后下降,[E]/[S]=10%时水解度达到最高;为了在相同前提条件下,能用较少酶量就可以达到最佳效果,所以选择底物浓度[E]/[S]=10%为最佳水解条件。
2.3.2 不同温度对碱性蛋白酶水解度的影响
由图9可知,碱性蛋白酶在底物浓度[E]/[S]=10%,pH 9,仅以温度为变量的单因素试验中,在1 h水解过程中,随着温度上升,水解度变化不明显,在温度35℃时水解度达到最高;所以水解温度选择35 ℃为碱性蛋白酶最佳的水解温度,使得在相同前提条件下,使用较低温度便可获得较好水解效果,节约能源。
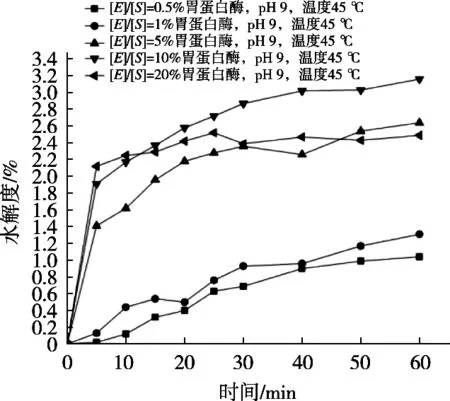
图8 不同底物浓度下碱性蛋白酶的水解度
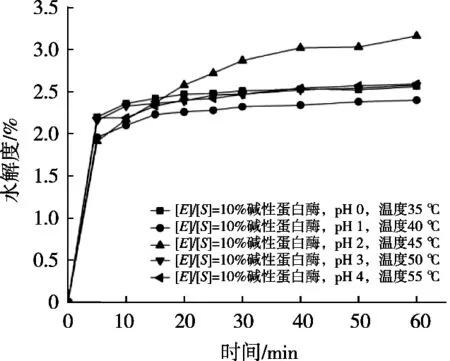
图9 不同温度下碱性蛋白酶的水解度
2.3.3 不同pH对碱性蛋白酶水解度的影响
由图10可知,碱性蛋白酶的底物浓度[E]/[S]=10%,温度45 ℃,仅以pH为变量的单因素试验中,在1 h水解过程中,随着pH升高水解度呈现先快速升高再缓慢下降趋势,并且pH 2时水解度达到最高;所以pH 2为碱性蛋白酶最佳水解pH,使得在相同前提条件下,选择较低pH即可达到最佳的水解效果,水解条件也较为温和。
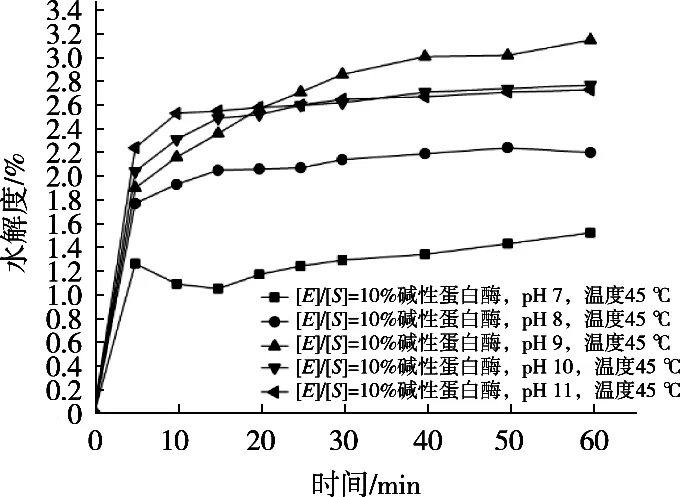
图10 不同pH下碱性蛋白酶的水解度
2.4 1 h内胃蛋白酶和碱性蛋白酶水解小米蛋白电泳分析
图11 为1 h内小米蛋白用胃蛋白酶水解。在pH 2,温度35 ℃,底物浓度[E]/[S]=10%时,可以看到清晰的分子肽逐步消失的过程,最上端的亚基先被水解掉,分子量较大的肽段逐步消失,剩下较小的分子量的肽段。图12为1 h内小米蛋白用碱性蛋白酶水解。在pH 9,温度45 ℃,底物浓度[E]/[S]=10%时,可以看到肽段逐步消失的过程,大分子量的肽段在该酶作用下极其容易水解,如果研究较大分子量肽段,不应利用该种酶水解提取。采用SDS-PAGE凝胶电泳技术,可将电荷和形状对蛋白质原的影响消除,使影响电泳结果的主要因素为蛋白质分子量大小,小分子蛋白受到的阻力较小,因而迁移速率快,跑出的条带位于下方;大分子蛋白受到的阻力较大,因而迁移速率慢,跑出的条带位于上方。因此,在试验中采用该项技术,可展现小米蛋白在碱性蛋白酶和胃蛋白酶经过不同条件的处理进行水解后所形成的肽段分布;伴随着水解过程进行,小米蛋白在不同酶作用下逐步水解成肽段的动态分布变化过程。
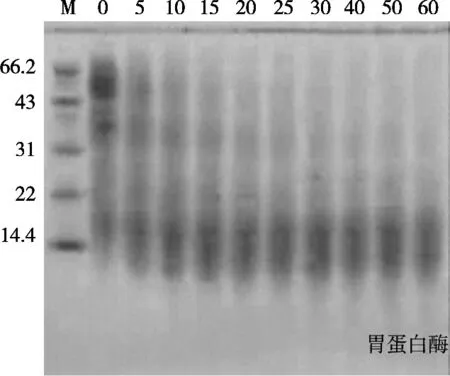
图11 1 h内胃蛋白酶水解小米蛋白电泳图
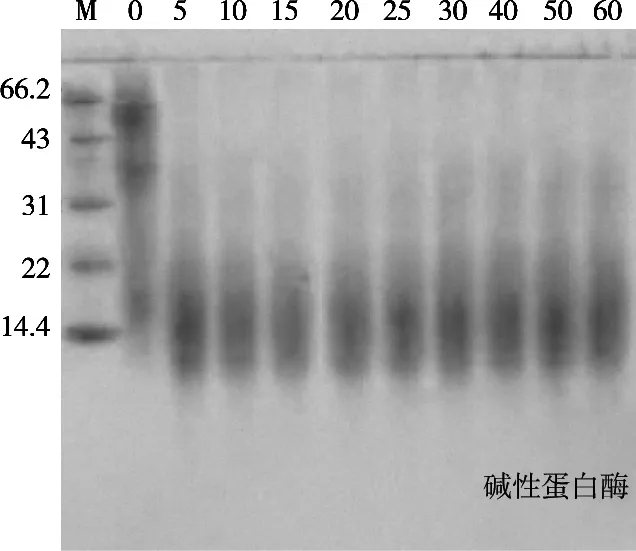
图12 1 h内碱性蛋白酶水解小米蛋白电泳图
3 结论
以小米蛋白粉为原料,使用胃蛋白酶和碱性蛋白酶进行水解反应,以邻苯二甲醛法(OPA法)测定水解度,得到小米蛋白水解最佳时间为1 h,在此时间范围内进行单因素试验优化小米蛋白粉在不同底物浓度、温度和pH下胃蛋白酶和碱性蛋白酶的水解条件,通过聚丙烯酰胺凝胶电泳法观察水解过程中肽段的变化,以制备出高水解度的小米蛋白。结果表明,采用胃蛋白酶水解浓度1%蛋白时,底物浓度[E]/[S]=10%,pH 2,温度35 ℃水解1 h水解度最大;采用碱性蛋白酶水解浓度1%蛋白时,底物浓度[E]/[S]=10%,pH 9,温度45 ℃水解1 h水解度最大;由聚丙烯酰胺凝胶电泳图谱可以看出肽段逐渐水解的过程,1 h内小米蛋白用胃蛋白酶水解,在pH 2,温度35 ℃,底物浓度[E]/[S]=10%时可以看到清晰的分子肽逐步消失,最上端亚基先被水解掉,分子量较大的肽段逐步消失,剩下较小的分子量的肽段;1 h内小米蛋白用碱性蛋白酶水解,在pH 9,温度45 ℃,底物浓度[E]/[S]=10%时可以看到肽段逐步消失,大分子量肽段在该酶作用下极容易被水解。

