硝酸镧浸种对藜麦种子萌发及盐胁迫下幼苗生长的影响
庞春花,张媛,李亚妮
硝酸镧浸种对藜麦种子萌发及盐胁迫下幼苗生长的影响
庞春花1,2,张媛1,李亚妮1
(1山西师范大学生命科学学院,山西临汾 041004;2山西先进永磁材料与技术协同创新中心,山西临汾 041004)
【目的】盐碱地的形成,不仅造成了资源浪费,也严重制约着农业生产。藜麦具有耐盐的特性,能够缓解部分盐胁迫。中国是稀土含量最多的国家,有研究表明,稀土元素镧可能对盐分胁迫有缓解作用。本试验通过硝酸镧浸种后对藜麦幼苗进行盐胁迫处理,探讨该浸种方法对藜麦种子萌发以及盐胁迫下幼苗生长的影响,为缓解盐害、提高藜麦抗盐性研究提理论依据。【方法】本研究以藜麦为研究材料,采用温室盆栽法,研究不同硝酸镧浓度浸种(25、50 和100 mg·L-1)对藜麦种子萌发及不同浓度盐胁迫下(100、200和300 mmol·L-1NaCl溶液)对幼苗生长的影响。【结果】(1)50 mg·L-1La(NO3)3浸种时,藜麦种子的萌发效果最好,发芽率、发芽势和发芽指数均达到最高,并与其他浓度处理具有显著差异;(2)相同La(NO3)3浓度浸种时,300 mmol·L-1NaCl以内藜麦幼苗的株高、根长随着盐胁迫浓度的增加逐渐降低,POD、SOD、MDA、可溶性糖、脯氨酸都随着盐胁迫浓度的增加而升高;(3)在相同浓度盐胁迫下,藜麦幼苗的株高、根长,POD、SOD、可溶性糖、可溶性蛋白、脯氨酸均随硝酸镧浸种浓度的增加呈先升后降的变化趋势,MDA随浸种浓度的增加呈先降后升的变化趋势;(4)藜麦在300 mmol·L-1NaCl范围下均能生长,在300 mmol·L-1NaCl时,幼苗各项指标基本最好,其中50 mg·L-1硝酸镧浸种处理下各项生长指标均达到最佳。【结论】低浓度50 mg·L-1硝酸镧能够促进藜麦种子的萌发以及盐胁迫下藜麦幼苗地上部分生长,加强藜麦幼苗的抗氧化酶活性,增加渗透调节物质含量,对盐胁迫起到缓解作用;高浓度则抑制生长。本文结果表明硝酸镧浸种可提高藜麦对盐分胁迫的抗性。
藜麦;种子萌发;幼苗;硝酸镧;盐胁迫
0 引言
【研究意义】土壤盐碱化是影响区域农业生产、制约土地开发利用的重要原因,它会通过破坏植物体内离子平衡从而引起离子毒性、高渗、氧化胁迫等,影响种子萌发和幼苗生长,致使作物产量及品质降低[1]。藜麦是一种营养价值很高的作物,近年来越来越受人们的欢迎,它具有耐盐碱的作用,但高盐胁迫仍会对其造成伤害。中国作为世界上稀土储量最多的国家,拥有80%的稀土资源,稀土农用是国内科学家的重要创新之一[2]。镧作为稀土元素中的一种,有着水合离子半径小、化学性质活泼且副作用小的特点,因而经常被运用于生产实践[3]。有研究表明,适当浓度的硝酸镧溶液能够促进盐胁迫下植株幼苗的生长,增强酶的活性,降低膜脂过氧化过程中产生的有害物质,降低细胞膜的透性,缓解盐胁迫造成的损害,提高作物对逆境的抵抗能力[4-5]。因此,研究硝酸镧浸种是否能够缓解藜麦盐害变得十分重要。【前人研究进展】高永生等[6]研究发现,适当浓度的La3+有利于增强小麦的抗盐能力,可通过增强盐胁迫下小麦幼苗体内的一些酶活性来提高清除活性氧自由基的能力,降低膜脂过氧化水平,从而缓解盐害损伤;张杰等[7]研究发现,适当La3+浓度浸种,可以提高水稻种子的活力,促进水稻幼苗生长,增加幼苗干重;但La3+浸种浓度过高时,其蛋白酶、淀粉酶和脂肪酶活性均受到抑制,致使根茎叶生长受到抑制,干物质积累量减少,叶绿素含量显著下降。刘凤兰等[8]发现,低浓度La(NO3)3浸种可以增强红小豆的耐盐性,修复盐损伤,而高浓度却会加重盐害。袁俊杰等[9]、张紫薇等[10]、刘文瑜等[11]研究了以NaCl为主的盐胁迫对藜麦的作用,发现低浓度NaCl促进藜麦的发芽和生长,高浓度会抑制其生长发育,此外还有学者对柳枝稷[12-13]、黑麦草[14]等进行了研究,均发现低浓度盐胁迫有益于植物的生长。【本研究切入点】藜麦原产于南美洲安第斯山区,又被称作“粮食之母”,具有抗逆性强、耐盐碱性等特性[15-16]。目前的研究多是以NaCl为主的盐胁迫对藜麦的伤害作用,但如何缓解盐胁迫对藜麦造成的损伤及其生理机制却鲜有报道。【拟解决的关键问题】本试验通过研究硝酸镧浸种对藜麦种子萌发以及盐胁迫下对幼苗各项指标的影响,分析硝酸镧浸种对植物是否起到有益作用,能否缓解盐胁迫对藜麦的损伤,以期为藜麦的抗逆性研究提供切实可行的技术措施。
1 材料与方法
1.1 供试材料
本试验所用材料为山西亿隆有限公司生产的亿隆1号种子,用分样筛(孔径为1.5—2.0mm)选取发育良好、形态完整、大小匀称的藜麦种子2 000粒,用3%的H2O2消毒50 s,双蒸水冲洗3次,置于干燥室温(20—25℃)下通风保存。试验于2018年4—8月在山西师范大学生命科学院植物生理学实验室中进行。
1.2 试验设计
1.2.1 试验处理 硝酸镧浸种溶液为25 mg·L-1(T1)、50 mg·L-1(T2)、100 mg·L-1(T3),氯化钠溶液浓度为100 mmol·L-1(N1)、200 mmol·L-1(N2)、300 mmol·L-1(N3),分别代表藜麦可承受耐盐范围内的轻度、中度、重度盐胁迫,浸种和盐胁迫处理均以蒸馏水作为对照。
1.2.2 种子萌发试验 所有处理浸种时间均为24 h,以蒸馏水处理作为对照(CK)。将大小一致、饱满均匀的种子放置在铺有双层滤纸、直径为9 cm的培养皿中,分别加入8 ml不同浓度的硝酸镧溶液,在25±1℃,全黑暗的光照培养箱中培养。每隔4 h观察,并记录各处理组种子萌发的数量,萌发标准为胚根长度大于等于2 mm,及时取出萌发种子,直至剩余种子不再萌发,连续观察5 d,记录相关数据。设置3次重复,每个重复50粒种子。
1.2.3 幼苗生长试验 选取籽粒饱满、均匀一致的藜麦种子,将其放置在不同浓度的硝酸镧处理溶液黑暗下浸种24 h后,播种于装有1 kg蛭石的花盆中(规格26 cm×12cm×8 cm),每盆播种25粒。之后置于25±1℃,12/12h光/暗交替,光照强度6 k lxD的光照培养箱中进行培养,期间正常浇水。四叶一心时期定苗,每盆留苗10株,用不同盐溶液浇灌,蒸馏水对照,每个处理重复5次。每个花盆浇3L不同浓度盐溶液,在处理后的第18天取全株测定藜麦幼苗相关生理生化指标。
1.3 测定指标
1.3.1 发芽指标的测定 根据如下公式计算发芽相关的指标:
发芽势=前7 d发芽种子数/供试种子数×100%
发芽率=发芽种子数/供试种子数×100%
发芽指数=∑Gt/Dt(Gt表示t日内的发芽数,Dt表示相应的发芽天数)[17-18]
1.3.2 幼苗生长指标的测定 生长至18 d,将幼苗冲洗干净,用滤纸擦干其表面水分,称量其株高、根长、苗长。每个处理5次重复。
1.3.3 幼苗生理指标的测定 NBT法测定超氧化物歧化酶活性(SOD);愈创木酚法测定过氧化物酶活性(POD);氮蓝四唑法测定过氧化氢酶活性(CAT);硫代巴比妥酸法测定丙二醛含量(MDA);蒽酮比色法测定可溶性糖含量;水合茚三酮法测定脯氨酸含量(Pro)[19];考马斯亮蓝法测定可溶性蛋白含量[20]。每个处理3次重复。
1.4 数据处理
运用Office、OriginPro 2016软件对测定数据进行处理与绘图,运用SPSS17.0软件进行统计分析,采用单因素方差分析,用Duncan法进行多重比较,试验结果用平均值±标准差来表示。
2 结果
2.1 硝酸镧浸种对藜麦种子萌发的影响
由表1可知,硝酸镧浸种有利于藜麦种子萌发生长,与对照组T0相比,经硝酸镧处理后的种子发芽率、发芽势和发芽指数均有所升高;且T1、T2处理的发芽率、发芽势和发芽指数显著高于T0(<0.05),而T3与T0处理间无显著差异。从整体上来看,藜麦种子发芽率、发芽势、发芽指数随硝酸镧浸种浓度的升高呈先升后降的变化趋势,发芽率、发芽势在T2处理时达最大,较T0分别提高8.1%和7.6%,而发芽指数在T1处理下达最大,较T0增幅为15.2%。由此表明,低浓度La(NO3)3溶液浸种可以促进藜麦种子萌发,浓度过高则会产生抑制作用。
2.2 硝酸镧浸种对盐胁迫下藜麦幼苗生长的影响
由表2可以看出,不同浓度La(NO3)3浸种和NaCl胁迫处理对藜麦幼苗的株高、根长和苗长均具有显著的调控效应。相同浓度La(NO3)3浸种处理下,盐浓度对藜麦的株高和根长有明显影响,株高和苗长均与盐胁迫浓度的升高呈负相关,根长变化与株高、苗长不尽一致,其变化趋势为相同浓度La(NO3)3浸种处理下,在N2处理达到最大,基本上在N3处理达最小,前者较后者增幅分别为66%(T0)、62%(T1)、58%(T2)、65%(T3)。由此表明,中度盐胁迫可以促进藜麦幼苗地下部分的生长。相同盐胁迫处理下,株高和苗长均随La(NO3)3浸种浓度的升高呈先升后降的变化趋势,且在T2处理时最大,T3处理下最小,前者较后者的增幅分别为22%、44%、69%、66%(株高)和29%、42%、59%、61%(苗长)。由此表明,低浓度硝酸镧浸种(50 mg·L-1)对藜麦幼苗地上部分生长具有促进作用,浓度过高时(超过50 mg·L-1),不仅不能缓解盐胁迫的伤害,还会产生抑制作用。
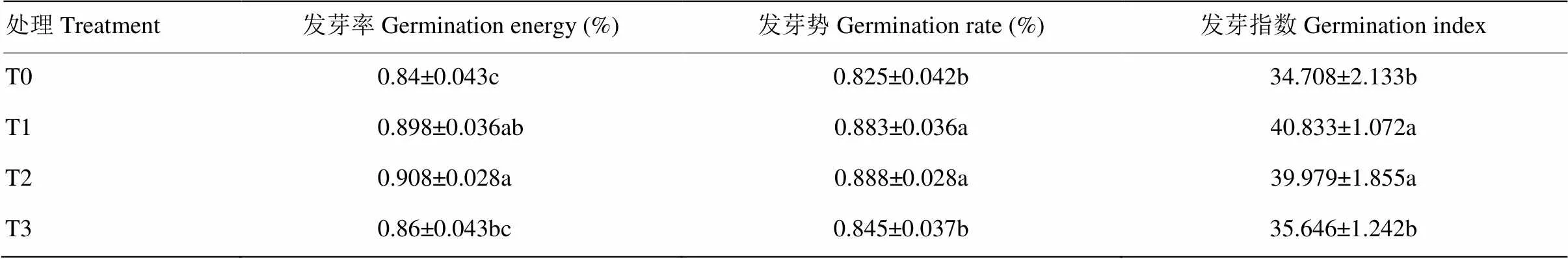
表1 硝酸镧浸种对藜麦种子萌发的影响
同列不同小写字母表示处理间在0.05水平差异显著。下同
Different small letters in the same column indicate significant differences among treatments at 0.05 level. The same as below
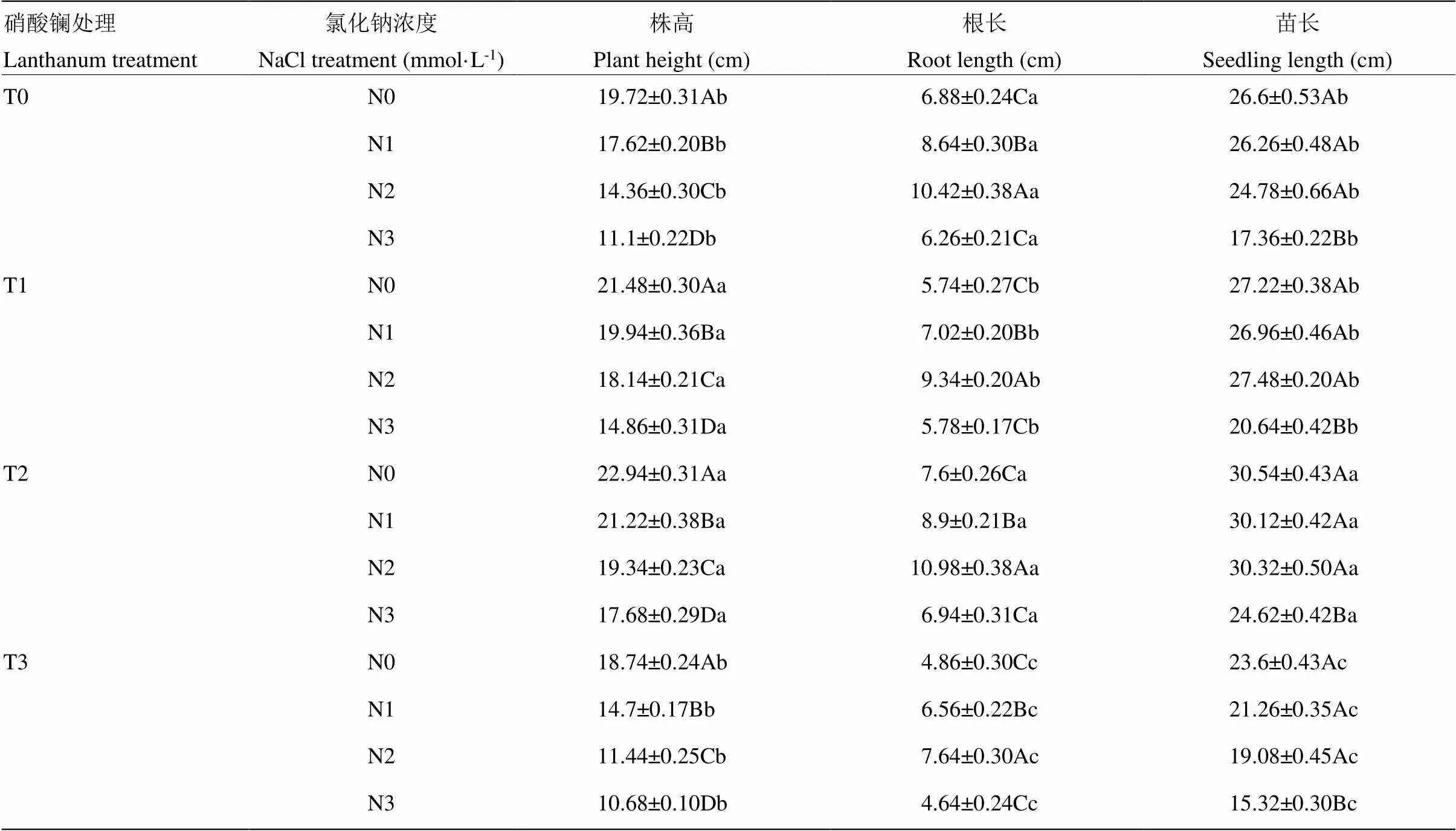
表2 硝酸镧浸种对盐胁迫下藜麦幼苗生长的影响
2.3 硝酸镧浸种对盐胁迫下藜麦幼苗抗氧化酶活性的影响
由图1可知,相同La(NO3)3浸种处理下,藜麦幼苗POD、SOD活性与盐胁迫强度呈正相关,在N3处理时最大,分别比N0增加50%、10%、42%、27%(POD),77%、45%、31%、48%(SOD)。相同盐胁迫处理下,藜麦幼苗POD、SOD酶活性随La(NO3)3浓度的增加呈先升后降的变化趋势,均在T2处理下达最大,分别比对照组增加47%、65%、50%、40%(POD),74%、38%、27%、29%(SOD)。由此表明,同一盐胁迫下,低浓度La(NO3)3可以加强藜麦的抗氧化酶活性,缓解盐害对其生长发育造成的影响,增强植物抗逆性,且以50 mg·L-1浓度的La(NO3)3浸种处理最好;同一浸种浓度下,在藜麦耐盐浓度范围内,藜麦幼苗的抗氧化酶活性随盐浓度的升高而升高,增强了藜麦的抗逆性。
2.4 硝酸镧浸种对盐胁迫下藜麦幼苗丙二醛的影响
由图 2可知,相同La(NO3)3浸种处理下,藜麦幼苗的丙二醛(MDA)含量与盐胁迫程度呈正相关,在重度胁迫N3处理时最大,与N0相比增幅分别为62%、25%、18%、9%。相同盐胁迫处理条件下,藜麦幼苗丙二醛含量随La(NO3)3浸种浓度的升高呈先降后升的变化趋势,T3处理下MDA含量达到最大值,与T0相比均有所增加,增幅分别为78%、68%、78%、61%。相同盐胁迫下,La(NO3)3浓度为25 mg·L-1、50 mg·L-1的浸种处理可降低MDA含量,当La(NO3)3浓度相同时,藜麦幼苗MDA含量会随盐胁迫强度的加重而升高。由此说明,低浓度硝酸镧浸种能够缓解盐胁迫对藜麦幼苗的伤害。
2.5 硝酸镧浸种对盐胁迫下藜麦幼苗渗透调节物质的影响
由图3可知,相同La(NO3)3浸种处理下,藜麦幼苗的脯氨酸、可溶性蛋白和可溶性糖含量与盐胁迫强度呈正相关关系,均在重度盐胁迫N3处理时达最大,较同一浸种浓度的N0、N1、N2分别提高22%、18%、11%(脯氨酸),31%、17%、5%(可溶性蛋白)和31%、22%、6%(可溶性糖)。相同盐胁迫处理下,藜麦幼苗的脯氨酸、可溶性蛋白和可溶性糖含量均随La(NO3)3浸种浓度的增加呈现先升后降的趋势,均在T2处理下达最大,较同一盐胁迫的T0、T1、T2分别提高40%、20%、37%(脯氨酸),44%、19%、50%(可溶性蛋白)和45%、23%、31%(可溶性糖)。结果表明,同一盐胁迫处理下,低浓度La(NO3)3浸种可使渗透调节物质增加,浓度50 mg·L-1时最好;同一La(NO3)3浸种处理时,藜麦幼苗的渗透调节物质含量会随盐胁迫程度的加重而增加,在浓度300 mmol·L-1时最高。
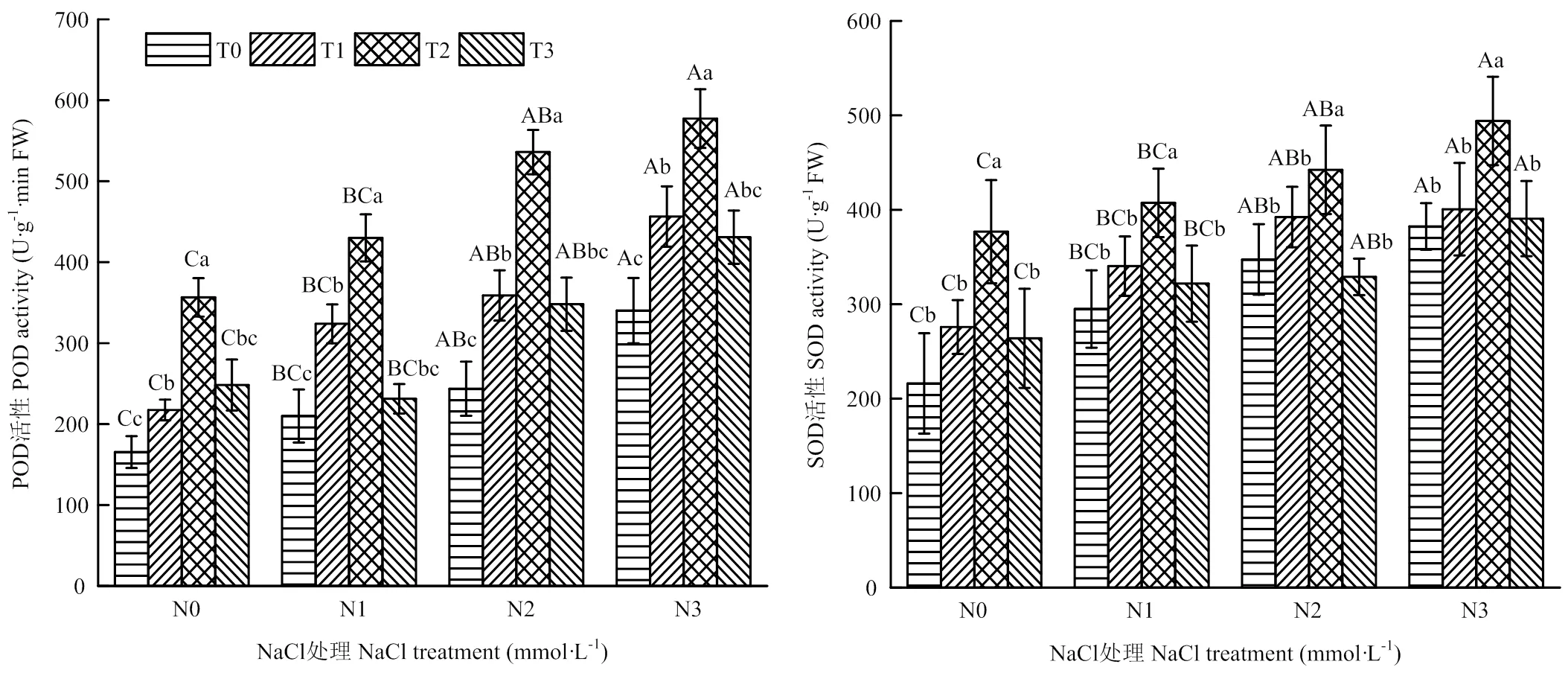
图1 硝酸镧浸种对NaCl胁迫下藜麦幼苗抗氧化酶的影响
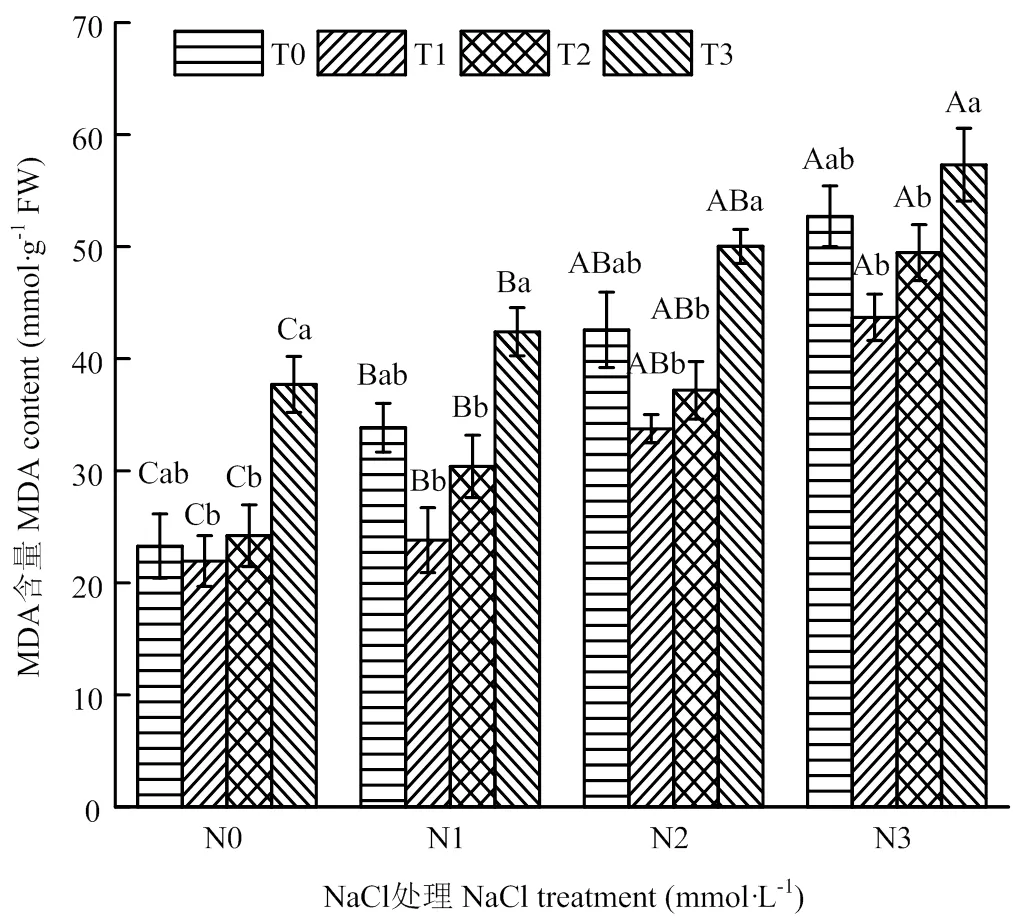
图2 硝酸镧浸种对NaCl胁迫下藜麦幼苗MDA的影响
3 讨论
3.1 硝酸镧浸种与藜麦种子萌发
种子萌发与其生活的复杂环境息息相关[21]。洪法水等[22]研究表明,适当浓度的硝酸镧对种子有益。高浓度硝酸镧会降低水的渗透式以此来减少植物的吸水速率,从而导致植物生长速度减慢[23]。本文研究表明,硝酸镧浸种对藜麦种子的萌发具有显著影响,低浓度促进萌发,高浓度抑制萌发,50 mg·L-1硝酸镧浸种对藜麦种子萌发最好。说明硝酸镧浸种对藜麦种子的吸水速率、细胞膜透性、呼吸代谢产生了一定作用。
3.2 硝酸镧浸种对NaCl胁迫下藜麦幼苗的生长
逆境对植物的生长发育和形态结构具有重要影响,植物能否在逆境下生存取决于幼苗生长情况[24]。本研究结果表明,相同浸种处理下,在藜麦耐盐范围内,随着盐胁迫强度的加剧,藜麦幼苗的株高、根长、苗长呈现出先升后降的变化趋势,其中,0—200 mmol·L-1具有促进的作用,超过200 mmol·L-1开始抑制。说明盐胁迫对藜麦生长有显著影响,对藜麦地上部分的生长有明显的抑制作用,轻度盐胁迫可以促进地下部生长,重度盐胁迫会抑制地下部生长。相同盐胁迫下,随La(NO3)3浸种浓度的增加,藜麦幼苗的株高、根长、苗长的变化为先升后降,0—50 mg·L-1升高,超过50 mg·L-1开始下降。说明低浓度硝酸镧浸种能够缓解盐胁迫对藜麦幼苗造成的伤害,浓度过高时,不仅不能缓解盐胁迫对藜麦幼苗的伤害,还会加重对藜麦伤害,起到抑制作用。

图3 硝酸镧浸种对NaCl胁迫下藜麦幼苗渗透调节物质的影响
Fig. 3 effect of lanthanum nitrate soaking on osmotic regulation in quinoa seedlings under salt stress
3.3 硝酸镧浸种对NaCl胁迫下藜麦幼苗的抗氧化酶系统的影响
SOD、POD是重要的抗氧化酶,能够消除非生物逆境胁迫下产生的氧化物,使活性氧代谢保持平衡,保护膜系统,加强植物抗逆性[25-26]。本研究结果表明,相同浸种处理下,藜麦幼苗的抗氧化酶活性与盐胁迫强度呈正比。说明在盐胁迫下,抗氧化酶能够清除细胞内产生的有害物质,使膜保持完整,这与刘文瑜研究结果一致[16]。相同盐胁迫下,随着浸种浓度的增加,藜麦幼苗的酶活性均呈现出先升后降的趋势,0—50 mg·L-1升高,超过50 mg·L-1开始下降。说明低浓度硝酸镧浸种,能提高抗氧化酶活性来消除细胞内产生的活性氧代谢物质,保护细胞,缓解藜麦盐害损伤;高浓度硝酸镧浸种,植株内活性氧产物急剧增多,细胞膜遭到破坏,导致抗氧化酶活性降低清除能力下降,不仅不能缓解藜麦盐害,还会起到反作用。表明适当硝浓度的酸镧浸种,能够促进环境胁迫下的抗氧化酶系统,这与Wang等[27]的研究结果一致。
3.4 硝酸镧浸种对NaCl胁迫下藜麦幼苗的丙二醛的影响
丙二醛是在逆境生成的膜脂过氧化物,它能够快速消除不利环境产生的有害离子,其含量与植物受伤害程度呈正比[28-29]。近年来的研究表明,镧元素能够增强植物的抗逆能力,提高植物抗氧化酶活性,减少过氧化产物的产生,以此来维持细胞膜的稳定[30-31]。本结果显示,相同浸种处理下,藜麦幼苗的MDA含量与盐胁迫强度呈正比。说明随盐胁迫的程度加剧,藜麦受到逆境对其产生的伤害,产生了较多的膜质过氧化物产物,严重影响了藜麦的生长和发育。相同盐胁迫下,随浸种浓度的增加,藜麦幼苗的MDA在T1浸种处理时最低。说明低浓度硝酸镧浸种,可以保护膜系统,进一步缓解盐胁迫对藜麦幼苗的损害;高浓度硝酸镧浸种,产生了过多的膜脂过氧化物,从而造成细胞膜损伤,不仅不能缓解盐胁迫带来的损伤,还会加重对藜麦的伤害作用。
3.5 硝酸镧浸种对NaCl胁迫下藜麦的渗透调节系统的影响
渗透调节是植物细胞中溶质颗粒数目净增的过程,是植物适应逆境的重要生理机制[32-33]。本研究结果显示,相同盐胁迫下,硝酸镧浸种使藜麦幼苗的渗透调节物质发生显著变化,整体变化为先升后降,50 mg·L-1最高。这可能是由于低浓度硝酸镧可以改变膜透性,使细胞内溶物外渗,最终导致渗透调节物质的增加。相同浸种处理下,随着盐胁迫强度的加剧,藜麦幼苗的渗透调节物质逐渐升高,这可能是由于植物细胞内水势、内容物质发生变化导致,这与杜锦等[34]的研究结果一致,表明了可溶性糖、可溶性蛋白、脯氨酸对细胞膜渗透、物质调节起到至关重要的作用。
4 结论
低浓度硝酸镧能够促进藜麦种子的萌发;相同盐胁迫下,低浓度硝酸镧对藜麦幼苗地上部分生长有益,能加强藜麦的抗氧化酶活性,消除盐胁迫下产生的有害物质,提高渗透调节物质,有效缓解盐害。相同硝酸镧浸种下,低盐胁迫能够促进藜麦幼苗的生长,加强其抗氧化活性,增加可溶性糖、可溶性蛋白、脯氨酸含量,影响渗透调节系统。总体来说,50 mg·L-1硝酸镧浸种藜麦生长最好,且藜麦在300 mmol·L-1NaCl范围内均能生长,验证了藜麦的耐受NaCl范围在300 mmol·L-1以内,表明硝酸镧浸种可提高藜麦对盐分胁迫的抗性。
[1] 张蕊, 邓文亚, 杨柳, 王亚萍, 肖芳枝, 禾健, 卢坤. 盐胁迫下甘蓝型油菜发芽期下胚轴和根长的全基因组关联分析. 中国农业科学, 2017, 50(1): 15-35.
ZHANG R, DENG W Y, YANG L, WANG Y P, XIAO F Z, HE J, LU K. Genome-wide association study of root length and hypocotyl length at germination stage under saline conditions in., 2017, 50(1): 15-35. (in Chinese)
[2] 李永裕, 潘腾飞, 邱栋梁. 稀土元素对植物生物学作用机制的研究进展. 中国农学通报, 2005, 21(12): 217-221.
Li Y Y, Pan T F, Qiu D L. Advances of studies on the biological mechanism of rare earth elements in plants., 2005, 21(12): 217-221. (in Chinese)
[3] 邱琳, 周青. 稀土对种子萌发影响的研究进展. 中国生态农业学报, 2008, 16(2): 529-533.
Qiu L, Zhou Q. Review on the effects of rare earth elements on seed germination., 2008, 16(2): 529-533. (in Chinese)
[4] 郜红建, 常江, 张自立, 丁士明, 魏俊岭. 稀土在植物抗逆中的生理作用. 中国稀土学报, 2003, 21(5): 487-490.
Gao H J, Chang J, Zhang Z L, Ding S M, Wei J L. Physiological effects of rare earth elements on stress resistance in plant., 2003, 21(5): 487-490. (in Chinese)
[5] Knight M R. Oxidative stress-induced calcium signaling in arabidopsis., 2004, 135(3): 1471-1479.
[6] 高永生, 陈集双. 盐胁迫下镧对小麦幼苗叶片抗氧化系统活性的影响. 中国稀土学报, 2005, 23(4): 490-495.
Gao Y S, Chen J S. Effects of la3+on antioxidant system in wheat seedling leaves under salt stress., 2005, 23(4): 490-495. (in Chinese)
[7] 张杰, 刘登义, 黄永杰, 刘雪云. 镧浸种对水稻种子萌发及幼苗生长的影响. 生态学杂志, 2005, 24(8): 893-896.
Zhang J, Liu D Y, Huang Y J, Liu X Y. Effects of seed soaking with La3+on seed germination and seedling growth of rice., 2005, 24(8): 893-896. (in Chinese)
[8] 刘凤兰, 张永清, 贾蕊, 任晓丽. La(NO3)3浸种对NaCl胁迫下红小豆幼苗生长的影响. 武汉植物学研究, 2009, 27(4): 397-402.
Liu F L, Zhang Y Q, Jia R, Ren X L. Effect of seed soaking with La(NO3)3on root and seedling growth of adzuki bean under different concentrations NaCl stresses., 2009, 27(4): 397-402. (in Chinese)
[9] 袁俊杰, 蒋玉蓉, 吕柯兰, 陆国权, 毛前. 不同盐胁迫对藜麦种子发芽和幼苗生长的影响. 种子, 2015, 34(8): 9-13.
Yuan J J, Jiang Y R, LÜ K L, Lu G Q, MAO Q. Effects of different salt stress on quinoa seed vigor and seedling physiological., 2015, 34(8): 9-13. (in Chinese)
[10] 张紫薇, 庞春花, 张永清, 倪瑞军, 杨世芳, 王璐瑗, 刘丽琴. 等渗NaCl和PEG胁迫及复水处理对藜麦种子萌发及幼苗生长的影响. 作物杂志, 2017(1): 119-126.
Zhang Z W, Pang C H, Zhang Y Q, Ni R J, Yang S F, Wang L Y, Liu L Q. Effects of iso-osmotic NaCl and PEG stress and rewatering on seed germination and seedling growth of quinoa., 2017(1): 119-126. (in Chinese)
[11] 刘文瑜, 杨发荣, 黄杰, 魏玉明, 金茜. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响. 西北植物学报, 2017, 37(9): 1797-1804.
Liu W Y, Yang F R, Huang J, Wei Y M, Jin Q. Response of seedling growth and the activities of antioxidant enzymes ofsalt stress., 2017, 37(9): 1797-1804. (in Chinese)
[12] 常乐钦, 梁卫卫, 杨培志. 硝酸镧对柳枝稷种子萌发及幼苗生长的影响. 种子, 2014, 33(11): 22-26.
Chang L Q, Liang W W, Yang P Z. Effects of La(NO3)3on seed germination and seedlings physiological characteristics of switchgrass., 2014, 33(11): 22-26. (in Chinese)
[13] 何学青, 梁卫卫, 常乐钦, 何树斌, 呼天明. 硝酸镧浸种对NaCl胁迫下柳枝稷种子萌发及幼苗生理特性的影响. 西北植物学报, 2014, 34(3): 543-549.
He X Q, Liang W W, Chang L Q, He S B, Hu T M. Effect of lanthanum nitrate on seed germination and seedling growth characteristics of switchgrass under NaCl stress., 2014, 34(3): 543-549. (in Chinese)
[14] 刘建新, 王瑞娟, 王鑫. 镧对NaCl胁迫下黑麦草幼苗根系生理特性的影响. 中国草地学报, 2010, 32(6): 46-51.
Liu J X, Wang R J, Wang X. Effects of lanthanum on physiological characteristics in ryegrass seedlings roots under NaCl stress., 2010, 32(6): 46-51. (in Chinese)
[15] 任贵兴, 杨修仕, 么杨. 中国藜麦产业现状. 作物杂志, 2015(5): 1-5.
Ren G X, Yang X S, Me Y. Current situation of quinoa industry in China., 2015(5): 1-5. (in Chinese)
[16] Antonio V G, Margarita M, Judith V, Elsa U, Luis P, Enrique A M. Nutrition facts and functional potential of quinoa (willd.), an ancient Andean grain: a review., 2010, 90(15): 2541-2547.
[17] 古丽内尔·亚森, 杨瑞瑞, 曾幼玲. 混合盐碱胁迫对灰绿藜(L.)种子萌发的影响. 生态学杂志, 2014, 33(1): 76-82.
Gulineier Y S, Yang R R, Zeng Y L. Effects of salt-alkali mixed stresses on seed germination of the halophyteL., 2014, 33(1): 76-82. (in Chinese)
[18] 杨宏伟, 刘文瑜, 沈宝云, 李朝周. NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响. 草业学报, 2017, 26(8): 146-153.
Yang H W, Liu W Y, Shen B Y, Li Z Z. Seed germination and physiological characteristics ofunder salt stress., 2017, 26(8): 146- 153. (in Chinese)
[19] 张志良, 翟伟菁, 李小芳. 植物生理学实验指导(第4版). 北京: 高等教育出版社, 2009: 30-227.
Zhang Z L, Zhai W J, Li X F.. Beijing: Higher Education Press, 2009: 30-227. (in Chinese)
[20] Shen J B, Yuan L X, Zhang J L, Li H G, Bai Z H, Chen X P, Zhang W F, Zhang F S. Phosphorus dynamics: from soil to plant., 2011, 156(3): 997-1005.
[21] HE Y Q, YANG B, HE Y, Zhan C F, Cheng Y H, Zhang J H, Zhang H S, Cheng J P, Wang Z F. A quantitative trait locus, qSE 3, promotes seed germination and seedling establishment under salinity stress in rice., 2019, 97(6): 1089-1104.
[22] 洪法水, 魏正贵, 赵贵文. 硝酸镧对水稻老化种子活力影响的作用机制. 中国稀土学报, 2001, 19(1): 75-79.
Hong F S, Wei Z G, Zhao G W. Mechanism of lanthanum nitrate on aged seed vigor of rice., 2001, 19(1): 75-79. (in Chinese)
[23] Razzaghi F, Ahmadi S H, Jacobsen S E, Jensen C R, Andersen M N. Effects of salinity and soil–drying on radiation use efficiency, water productivity and yield of quinoa (willd.)., 2012, 198(3): 173-184.
[24] 彭云玲, 保杰, 叶龙山, 王永健, 燕利斌. NaCl胁迫对不同耐盐性玉米自交系萌动种子和幼苗离子稳态的影响. 生态学报, 2014, 34(24): 7320-7328.
Peng Y L, Bao J, Ye L S, Wang Y J, Yan L B. Ion homeostasis in germinating seeds and seedlings of three maize inbred lines under salt stress., 2014, 34(24): 7320-7328. (in Chinese)
[25] 常青山, 张利霞, 杨伟, 周姗姗, 黄青哲, 吕凤娟, 黄玥, 葛淑慧, 张天蒙. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响. 草业学报, 2016, 25(7): 121-130.
Chang Q S, Zhang L X, Yang W, Zhou S S, Huang Q Z, LÜ F J, Huang Y, Ge S H, Zhang T M. Effects of exogenous nitric oxide on antioxidant activity and photosynthetic characteristics ofseedlings under NaCl stress., 2016, 25(7): 121-130. (in Chinese)
[26] 范鑫, 赵雷霖, 翟红红, 王远, 孟志刚, 梁成真, 张锐, 郭三堆, 孙国清. AtNEK6在棉花旱盐胁迫响应中的功能分析. 中国农业科学, 2018, 51(22): 4230-4240.
Fan X, Zhao L L, Zhai H H, Wang Y, Meng Z G, Liang C Z, Zhang R, Guo S D, Sun G Q. Functional characterization ofoverexpression in cotton under drought and salt stress., 2018, 51(22): 4230-4240. (in Chinese)
[27] Wang C R, Wang Q Y, Tian Y, Zhang J F, Li Z X, Cao P, Zhu M, Li T T. Lanthanum ions intervened in enzymatic production and elimination of reactive oxygen species in leaves of rice seedlings under cadmium stress., 2014, 33(7): 1656-1664.
[28] 刘庆, 董元杰, 刘双, 张东. 外源水杨酸(SA)对NaCl胁迫下棉花幼苗生理生化特性的影响. 水土保持学报, 2014, 28(2): 165-168, 174.
Liu Q, Dong Y J, Liu S, Zhang D. Effects of exogenous salicylic acid on the physiological and biochemical characteristics of cotton seedlings under salt stress., 2014, 28(2): 165-168, 174. (in Chinese)
[29] 熊雪, 罗建川, 魏雨其, 周冀琼, 张英俊. 不均匀盐胁迫对紫花苜蓿生长特性的影响. 中国农业科学, 2018, 51(11): 2072-2083.
Xiong X, Luo J C, Wei Y Q, Zhou J Q, Zhang Y J. Effects of non-uniform salt stress on growth characteristics of alfalfa., 2018, 51(11): 2072-2083. (in Chinese)
[30] 陈海燕, 崔香菊, 陈熙, 李建友, 张炜. 盐胁迫及La3+对不同耐盐性水稻根中抗氧化酶及质膜H+-ATPase的影响. 作物学报, 2007, 33(7): 1086-1093.
Chen H Y, Cui X J, Chen X, Li J Y, Zhang W. Effects of salt stress and La3+on antioxidative enzymes and plasma membrane H+-ATPase in roots of two rice cultivars with different salt tolerance., 2007, 33(7): 1086-1093. (in Chinese)
[31] 魏国平, 朱月林, 刘正鲁, 杨立飞, 张古文. NaCl胁迫对茄子嫁接苗生长和离子分布的影响. 西北植物学报, 2007, 27(6): 1172-1178.
Wei G P, Zhu Y L, Liu Z L, Yang L F, Zhang G W. Growth and ionic distribution of grafted eggplant seedlings with NaCl stress., 2007, 27(6): 1172-1178. (in Chinese)
[32] 薛炎, 王迎春, 王同智. 濒危植物长叶红砂适应盐胁迫的生理生化机制研究. 西北植物学报, 2012, 32(1): 136-142.
Xue Y, Wang Y C, Wang T Z. Physiological and biochemical mechanisms of an endemic halophytemaxim. under salt stress., 2012, 32(1): 136-142. (in Chinese)
[33] 杜欢, 马彤彤, 郭帅, 张颖, 白志英, 李存东. 大麦近等基因系苗期根系形态及叶片渗透调节物质对PEG胁迫的响应. 中国农业科学, 2017, 50(13): 2423-2432.
Du H, Ma T T, Guo S, Zhang Y, Bai Z Y, LI C D. Response of root morphology and leaf osmoregulation substances of seedling in barley genotypes with different heights to PEG stress., 2017, 50(13): 2423-2432. (in Chinese)
[34] 杜锦, 向春阳, 张红颖, 罗锋. NaCl胁迫对玉米幼苗渗透调节物质及Na+、K+、Ca2+含量的影响. 种子, 2014, 33(7): 19-23.
Du J , Xiang C Y, Zhang H Y, Luo F. Effects of NaCl stress on osmosis-regulating substance and Na+、K+、Ca2+contents of maize seedling., 2014, 33(7): 19-23. (in Chinese)
Effects of Soaking Seeds with Lanthanum Nitrate on Seed Germination and Seedling Growth of Quinoa Under Salt Stress
Pang ChunHua1, 2, Zhang Yuan1, Li YaNi1
(1Shool of Life Science, Shanxi Normal University, linfen 041004, shanxi;2Collaborative Innovation Center for Shanxi Advanced Permanent Magnetic Materials and Technology, Linfen 041004, Shanxi)
【Objective】With the formation of soil salinization, not only causes the resource-wasting, but also restricts the agricultural production. Quinoa has salt-tolerant properties, It can alleviate salt stress. China is the country with the most rare earth content. There is a study that lanthanum may alleviate the effects of salt stress on plants. In this study, quinoa was treated with salt stress, which seed had been soaked with lanthanum nitrate before. The effects of soaking seeds with lanthanum nitrate on seed germination and seedling growth of quinoa under salt stress were examined to find a way to improve salt resistance of the species. 【Method】In this study, quinoa was used as the research material and greenhouse potted planting method was adopted in order to study the effects of different lanthanum nitrate leaching species (25, 50, 100 mg·L-1) on seed germination and seedling growth under different salt stresses (100, 200, 300 mmol·L-1sodium chloride solution). 【Result】(1) When lanthanum nitrate was 50 mg·L-1, the effect of quinoa seeds were the optimal, the germination percentage, germination potential, and germination index of quinoa seeds were the highest, and there were significant differences compared with other concentrations. (2) At the same socking concentration, plant height and root length of seedlings decreased with the increase of salt concentrations within 300 mmol·L-1NaCl, while peroxidase (POD), superoxide dismutase (SOD), malondialdehyde (MDA), soluble sugar, proline and other physiological and biochemical indexes increased with the increase of salt concentrations. (3) At the same salt concentration, plant height, root length and other growth indicators of quinoa seedlings showed the tendency of first increasing and then decreasing with the increase of soaking concentrations, as well as POD, SOD, soluble sugar, soluble protein, proline and other physiological and biochemical indexes. For MDA, the trends were reversed. (4) quinoa seedlings survived and grown in the NaCl solutions less than 300 mmol·L-1, but optimal concentration was 300 mmol·L-1. At the same time 300 mmol·L-1salt concentration, the growth index were the best when lanthanum nitrate was 50 mg·L-1.【Conclusion】Under salt stress, quinoa seeds socked in low concentration solution of lanthanum nitrate could promote the seed germination and the shoot growth, strengthen the antioxidant enzyme activities of seedlings, and improve the content of the osmotic adjustment material, resulting in increasing resistance to salt stress. However, seedling growth was inhabited by high concentration solution of lanthanum nitrate. This study suggested that the resistance of quinoa to salt stress was enhanced by adding adequate lanthanum nitrate.
quinoa; seed germination; seedling; lanthanum nitrate; salt stress
2019-04-09;
接受日期:2019-06-24
国家自然科学基金(31571604)、山西省先进永磁材料与技术协同创新项目(030100030022)
庞春花,E-mail:pangch6269@162.com
(责任编辑 杨鑫浩)

