黄酮类化合物防治阿尔茨海默病的研究进展
邵骏菁 张晓平 杨颖 温柔 李忠原 马大龙 于俊杰 田景振
摘 要 目的:了解黄酮类化合物治疗阿尔茨海默病(AD)的作用机制,为其临床应用提供参考。方法:以“黄酮类化合物”“阿尔茨海默病”“发病机制”“作用机制”“Flavonoids”“AD”“Pathogenesis”“Action mechanism”等为关键词,在中国知网、万方数据、PubMed、Web of Science等数据库中组合查询2005年1月-2020年4月发表的相关文献,基于现代AD学说和相关通路对黄酮类化合物防治AD的研究进展以及新型给药系统在增强该类化合物神经保护作用中的应用进行综述。结果与结论:共检索到相关文献176篇,其中有效文献66篇。AD是一种多见于老年人的神经退行性疾病。基于Aβ学说,黄酮类化合物可通过激活非淀粉样途径、抑制淀粉样途径,从而抑制β淀粉样蛋白裂解酶的活性、减少Aβ的形成来发挥神经保护作用。基于Tau蛋白学说,黄酮类化合物可通过增强内源性磷酸脂酶的活性,促进Tau蛋白脱去磷酸基,抑制Tau蛋白磷酸化,从而达到保护神经系统的目的。基于胆碱能学说,不少黄酮类化合物具有胆碱酯酶抑制作用,可通过抑制乙酰胆碱的分解从而使其在突触间隙中维持较高的浓度以治疗AD。基于氧化应激学说,则黄酮类化合物可通过多种途径发挥抗氧化的作用,以减少神经细胞凋亡。同时,炎症学说和突触学说也从不同角度解释了黄酮类化合物治疗AD的潜在作用机制。基于信号通路的相关研究表明,黄酮类化合物可通过作用于磷脂酰肌醇-3-激酶/蛋白激酶B、核因子κB、丝裂原激活蛋白激酶、糖原合成酶激酶3β等通路来治疗AD,且具有毒性低、不良反应小等优点。此外,纳米技术可增强黄酮类化合物的生物利用度以更好地发挥抗AD作用。
关键词 黄酮类化合物;阿尔茨海默病;发病机制;作用机制;纳米给药
阿尔茨海默病(Alzheimers disease,AD)是一种常见于老年人的由多种因素引起的中枢神经退行性疾病,约占痴呆患者总数的50~75%,严重威胁老年人的身心健康[1]。近年来,随着全球老龄化的日趋严重,AD患病率逐年升高;据世界阿尔茨海默组织2015年的报道,预计2050年全球AD患者将超过一亿三千万[2-3]。AD的临床症状主要表现为患者记忆力丧失、认知功能障碍等[4]。该病尚无法根治,目前临床治疗主要以缓解症状为主,但在减轻或阻止疾病进展方面的效果并不显著[5]。因此,寻找更为有效的AD治疗药物具有重大的现实意义和社会意义。
黄酮类化合物是经苯丙氨酸途径合成的一类天然化合物,普遍存在于中草药之中。现代药理研究表明,黄酮类化合物可以用于治疗糖尿病、癌症、心血管疾病、AD、神经紊乱等[6],其可以从多靶点改善AD模型动物的认知功能障碍,减轻AD样病理症状,抑制AD的病理进展[7]。基于此,本研究以“黄酮类化合物”“阿尔茨海默病”“发病机制”“作用机制”“Flavonoids”“AD”“Pathogenesis”“Action mechanism”等为关键词,在中国知网、万方数据、PubMed、Web of Science等数据库中组合查询2005年1月-2020年4月发表的相关文献。结果,共检索到相关文献176篇,其中有效文献66篇。现结合现代AD学说及相关信号通路对黄酮类化合物抗AD的作用及其机制进行综述,并汇总新型给药系统在增强其神经保护作用中的应用,以期为AD的临床治疗提供参考。
1 基于现代AD学说分析黄酮类化合物的抗AD作用
现代医学对AD的研究已有近百年的历史,但AD发病机制至今仍不完全明确。解剖学研究发现,AD的发病机制可能与β淀粉样蛋白(Aβ)异常、Tau蛋白磷酸化、胆碱能系统异常、氧化应激反应、炎症反应等有关[8]。黄酮类化合物具有广泛的生物活性,其多途径协同作用能有效阻断与AD等神经性疾病发展的相关途径[9]。
1.1 Aβ学说
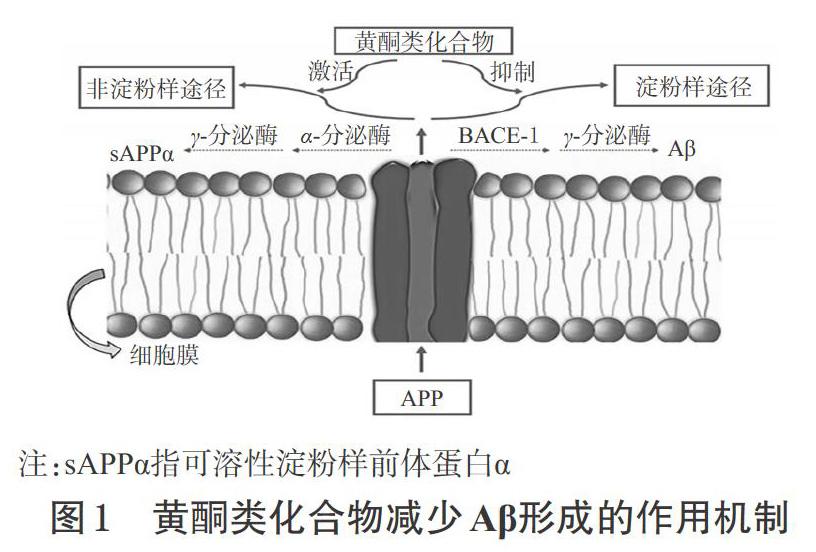
淀粉樣前体蛋白(APP)是一类具有较大胞外结构域的跨膜蛋白[10]。Aβ是AD患者脑内老年斑的主要成分,由APP经淀粉样途径通过β-淀粉样蛋白裂解酶1(BACE-1)和γ-分泌酶剪切作用而产生,其长度可能为38、40或42个氨基酸,其中由Aβ1-42比Aβ1-38或Aβ1-40更有黏性,从而更容易导致斑块形成[11]。
黄酮类化合物可通过激活非淀粉样途径、抑制淀粉样途径,从而抑制BACE-1活性、减少Aβ的形成来发挥神经保护作用[12],作用机制详见图1。Wei D等[13]的研究表明,黄芩素可以抑制AD模型大鼠脑内Aβ1-42斑块的形成及聚集,且对已经成形的Aβ1-42斑块具有解聚作用,还可显著降低Aβ1-42对细胞的毒害作用。刘俊岑等[14]通过研究补骨脂异黄酮对Aβ损伤大鼠PC12细胞的影响发现,该化合物可通过降低APP和BACE-1蛋白的表达,从而抑制Aβ的形成,最终达到缓解AD的作用。Okumura N等[15]对人淋巴瘤细胞(Daudi)、人外周血白血病T细胞(Jurkat)、组织细胞淋巴瘤细胞(U937)进行的研究表明,染料木素可通过下调早老素1(PS-1)蛋白和mRNA的表达而抑制Aβ形成。梅峥嵘等[16]在过表达APPβ的人神经母细胞瘤SH-SY5Y细胞上观察葛根素对Aβ形成的影响,发现该化合物可通过下调BACE-1的表达而减少Aβ的形成。
1.2 Tau蛋白学说
Tau蛋白异常磷酸化是AD的病理标志之一。微管系统是神经细胞骨架的主要成分,Tau蛋白是维持微管系统稳定的微管相关蛋白[17]。在正常状态下,条状单体Tau蛋白通常结合在微管上;而过度磷酸化的Tau蛋白会从微管上脱落,聚集形成神经纤维缠结(NFTs)[18]。这一过程阻碍了Tau蛋白正常生理功能的发挥,致使其稳定微管系统的功能丧失,从而扰乱神经递质的合成、释放,诱导神经细胞发生退行性改变,最终损害大脑认知和学习记忆的能力[19]。相关研究表明,黄酮类化合物可通过增强内源性磷酸酯酶的活性,促进Tau蛋白脱去磷酸基,抑制Tau蛋白磷酸化,从而达到保护神经系统的目的[20]。Chesser AS等[21]等研究了表没食子儿茶素没食子酸酯(EGCG)对原代大鼠皮质神经细胞Tau蛋白的影响,发现其可通过增加衔接蛋白的表达来抑制肝素介导的Tau蛋白磷酸化,从而保护大鼠的神经系统。
1.3 胆碱能学说
乙酰胆碱(ACh)水平下降被认为是导致认知功能障碍的主要原因之一。参与ACh分解的胆碱酯酶主要为乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)。其中,AChE可以水解大脑中80%的ACh。Blander JM等[22]研究发现,AD患者的海马、前脑 Meynert 基底核和皮质部位的胆碱能神经细胞受损明显,ACh水平下降,胆碱能系统活性减弱。可见,使用胆碱酯酶抑制剂抑制ACh的分解从而使ACh在突触间隙中维持相对较高的浓度是AD治疗有效的方式之一。
目前,对胆碱酯酶(AChE、BChE)抑制作用研究较多的黄酮类化合物有染料木素、山柰酚、芹菜素、柚皮苷、槲皮素、薯蓣皂苷、水飞蓟素和水飞蓟宾等[23]。其中,槲皮素活性最强,对AChE的抑制率为76.2%,染料木素、木犀草素、水飞蓟宾对BChE的抑制率分别为65.7%、54.9%、51.4%[24]。Abdalla FH等[25]通过对镉暴露大鼠大脑皮质突触体的AChE活性进行研究发现,槲皮素可抑制AChE的疏水作用和强氢键作用,从而减少ACh的水解,增加突触间隙中ACh的水平。张永亮等[26]研究发现,经木犀草素处理后的AD模型大鼠海马组织中的超氧化物歧化酶(SOD)活性和AChE活性明显降低,表明木犀草素可通过抑制海马区的氧化损伤和提高ACh水平来改善大鼠的学习功能障碍,缩短大鼠在Morris水迷宫实验中的逃避潜伏期。
1.4 氧化应激学说
大脑退化过程中,神经细胞细胞膜上不饱和脂肪酸不断被氧化,产生大量的活性氧自由基(ROS);当ROS产生过多时,会导致细胞膜发生氧化应激反应,从而扰乱神经细胞的正常功能或诱导神经细胞凋亡[27]。黄酮类化合物大多具有还原性,能够清除ROS,可通过减少神经细胞细胞膜的氧化应激反应而减少神经细胞凋亡。因此,具有自由基清除活性的化合物可以通过抗氧化作用来阻止神经细胞凋亡[28]。
黄酮类化合物可通过多种途径发挥抗氧化的作用,以达到缓解氧化应激状态的目的,如螯合金属离子、清除自由基、增加抗氧化酶活性等[29]。Choi SM等[30]通过1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除试验,比较了10种黄酮类化合物的自由基清除活性,从高到低依次为:EGCG>杨梅素>槲皮素=木犀草素=表没食子儿茶素>芦丁>表儿茶素>黄芩素>山柰酚=芹菜素。He L等[31]研究表明,杨梅素可通过抑制转铁蛋白受体1(TrR1)的表达、螯合二价铁离子(Fe2+)、降低铁含量来有效减少Fe2+诱导的人神经母细胞瘤SH-SY5Y细胞的凋亡;其体内实验同样表明,杨梅素可通过降低铁引起的氧化损伤来改善AD模型小鼠的学习记忆能力。
1.5 炎症学说
Bhat SA等[32]研究表明,神经胶质细胞被激活是AD等神经退行性疾病进展过程中的重要标志之一,神经胶质细胞激活后会导致脑内慢性炎症的发生,其在AD的发生过程中起着关键作用。AD患者脑中激活的小胶质细胞可产生不同类型的炎症因子[如白细胞介素6(IL-6)、IL-1β、肿瘤坏死因子α(TNF-α)等],这些炎症因子可能与神经细胞的凋亡有关。黄酮类化合物可通过拮抗相关信号通路[如核因子κB(NF-κB)、丝裂原激活蛋白激酶(MAPK)、核因子E2相关因子2(Nrf2)等],抑制炎症因子的表达来发挥抗炎作用,进而起到治疗AD的作用[33]。Vargas-Restrepo F等[34]研究表明,槲皮素能通过减少IL-1β、环氧化酶2(COX-2)、诱导型一氧化氮合酶(iNOS)等促炎因子的表达来降低Aβ水平和小胶质细胞活性,进而在AD模型小鼠的海马CA1区发挥抗炎作用。
1.6 突触学说
突触学说认为,神经突触可塑性的丧失是導致AD的可能原因之一。突触可塑性是指神经细胞之间联系强度的变化,体现为突触之间信号传递效率的变化或单个突触的大小变化等,是一种与学习记忆相关的细胞机制[35]。神经突触可塑性的丧失在包括AD的神经退行性疾病的大脑病理学研究中都可以观察得到。Li Q等[36]研究表明,长期给予儿茶素可降低快速老化痴呆模型SAMP8小鼠海马区中Aβ1-42寡聚体的水平,上调蛋白激酶A/环磷腺苷效应元件结合蛋白(PKA/CREB)以及突触可塑性相关蛋白[生长相关蛋白43(GAP-43)、突触素(Syn)、突触后致密物质(PSD)]的活性。
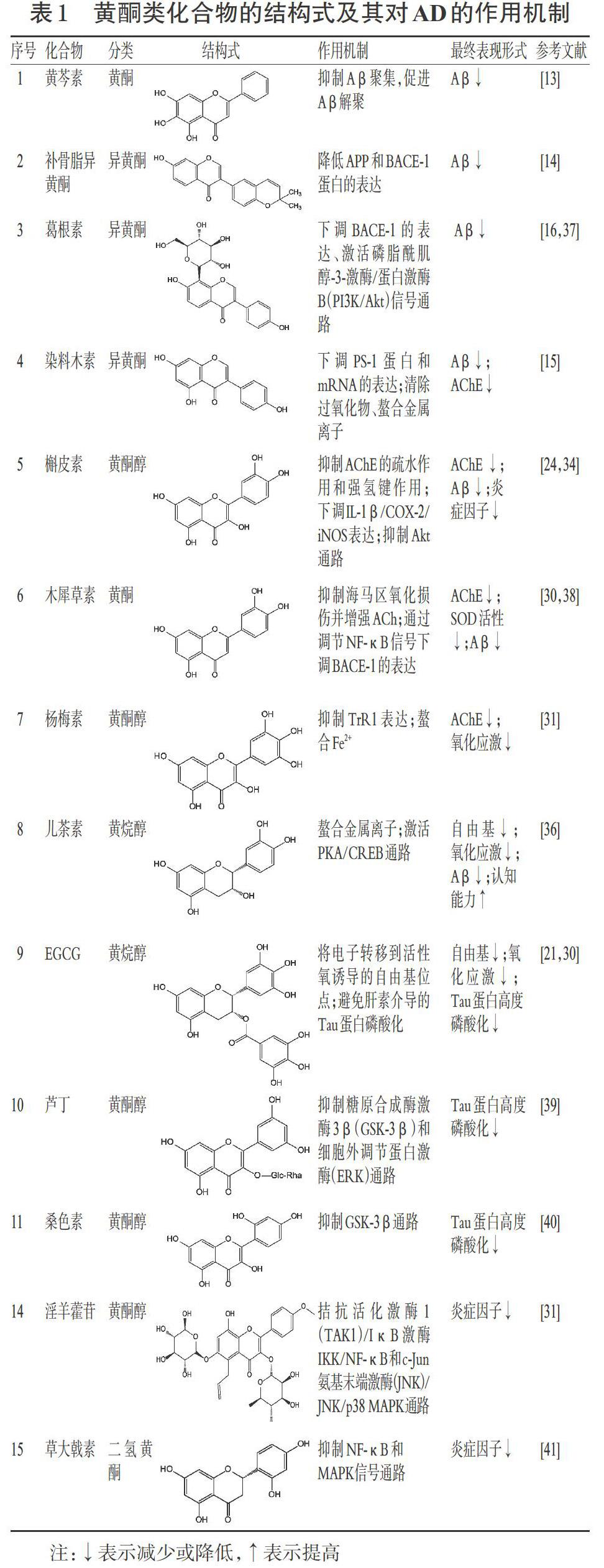
黄酮类化合物的结构式及其基于AD学说的抗AD作用机制详见表1。
2 基于信号通路分析黄酮类化合物的抗AD作用
AD的疾病进展是一个动态的变化过程,由于目前对AD的认识尚且不足,加之有效成分抗AD的作用机制也较为复杂,为了更好地了解黄酮类化合物抗AD的机制,下文从相关信号通路的角度出发,对黄酮类化合物治疗AD的作用机制进行汇总分析。
2.1 PI3K/Akt信号通路
PI3K/Akt通路是调节细胞周期的重要细胞内信号通路,该通路通过下游信号分子GSK-3β发挥作用,GSK-3β激活后会促进 Tau 蛋白的磷酸化[42]。黄酮类化合物是一种有效的抗氧化、抗炎和信号通路调节剂,可以通过调节PI3K/Akt通路减少GSK-3β诱导的Tau蛋白磷酸化来发挥作用[43]。Spencer JP[37]研究表明,槲皮素能通过上调PI3K/Akt通路活性、抑制Tau蛋白磷酸化而促进抗氧化和抗凋亡信号通路,最终改善神经功能障碍。也有研究表明,花青素能通过调节PI3K/Akt/GSK-3β通路磷酸化途径,刺激Nrf2和血红素加氧酶1(HO-1)途径的内源性抗氧化系统,以减弱羟基氧化物诱导的ROS水平升高和氧化应激,减少神经细胞凋亡;此外,花青素还可以通过抑制凋亡和神经退行性标志物,如胱天蛋白酶3(Caspase-3)和多聚二磷酸腺苷核糖转移酶1(PARP-1)的激活,阻止神经细胞凋亡和神经变性[43]。Xing G等[44]研究表明,葛根素对Aβ诱导的大鼠肾上腺髓质嗜铬瘤细胞PC12具有神经保护作用,可能的机制是该化合物可通过激活PI3K/Akt信号通路,阻止Aβ诱导的神经毒性,进而抑制神经细胞凋亡。
2.2 NF-κB信号通路
AD患者脑神经细胞变性与NF-κB信号通路的活化有关。NF-κB是炎症细胞因子生成的主要调节剂,是由p50和p65亚基组成的异二聚体,可介导先天免疫细胞和淋巴T细胞的增殖分化[45]。NF-κB信号通路可激活淀粉样蛋白通路以促进Aβ的形成,同时也是炎症和氧化应激反应的主要调节方式[46];此外,NF-κB会介导促氧化剂还原型辅酶Ⅱ(NADPH)、COX-2、IL、SOD的表达[47],可见抑制该通路可能是治疗AD的有效途径之一。Zhou X等[48]对小鼠小胶质细胞BV-2进行的研究表明,染料木素可通过逆转Aβ25-35诱导的Toll样受体4(TLR4)和NF-κB表达上调以及抑制NF-κB的DNA结合和转录活性,减轻Aβ25-35引起的细胞毒性和炎性损伤。Kim DC等[41]的研究表明,在脂多糖(LPS)诱导的BV-2细胞和大鼠原代小胶质细胞中,草大戟素可通过抑制NF-κB和MAPK信号通路的激活,抑制促炎介质和细胞因子的产生而发挥抗炎作用。He P等[49]对C57BL/6J小鼠和BV-2细胞进行的研究结果表明,圣草酚可通过抑制胶质细胞和NF-κB活化,减轻LPS刺激的淀粉样蛋白生成、胶质细胞活化和细胞因子释放,减轻神经细胞损伤,维持体内胆碱能系统平衡等途径来改善模型小鼠的认知功能。Zheng N等[50]对人胚肾293(HEK293)和人神经母细胞瘤SH-SY5Y细胞进行的研究结果表明,木犀草素可有效抑制BACE-1,诱导CREB及c-Jun磷酸化,以发挥竞争性抑制p65与CREB结合酶(CBP)结合的作用,间接抑制NF-κB活化,通过调节NF-κB信号、下调BACE-1的表达进而减少Aβ的产生。
2.3 MAPK信号通路
MAPK信号通路中包括关键因子JNK、细胞外信号调节激酶1/2(ERK1/2)或p38 MAPK,激活的MAPK可通过活化NF-κB并使其转移入核,进而加剧炎症反应[51]。已有研究表明,MAPK信号通路参与了神经细胞凋亡的转录调控,在AD发生发展中具有关键作用,类黄酮及其代谢产物可通过与MAPKs信号通路(包括Mek1和Mek2受体)相互作用而使下游CREB激活,从而使突触可塑性发生显著变化[52]。淫羊藿苷对MAPK(p38、ERK1/2和JNK)信号通路介导的Tau蛋白磷酸化有抑制作用,并能通过抑制Bax/Bcl-2比值的升高和Caspase-3的活化来保护海马神经细胞免受神经毒性的损伤[31]。Lee M等[53] 的研究表明,槲皮素可以减弱MAPK和NF-κB信号通路的活性,减少激活的小胶质细胞和星形胶质细胞释放TNF-α和IL-6。
2.4 GSK-3β信号通路
GSK-3β是一种丝氨酸/苏氨酸蛋白激酶,可通过增强Caspase-3活性而引起细胞损伤。GSK-3β参与了Tau蛋白的磷酸化,被证实与AD的发生有关[54]。研究人员在轻度认知障碍患者的大脑中发现了较高水平和较高活性的GSK-3β,并证明了其表达水平和活性呈年龄依赖性[55]。Fujiwara H等[56]采用激酶法和Western blotting法对从AD模型小鼠大脑中提取的生物样本进行分析,发现三黄泻心汤和黄连解毒汤中的黄酮类化合物如黄芩素、黄芩苷、汉黄芩素等对上述生物样本中的GSK-3β的活性有抑制作用。Wang D等[57]探讨了橙皮苷对Aβ诱导的小鼠认知功能障碍、神经细胞氧化损伤和线粒体功能障碍的影响,发现该化合物可通过抑制GSK-3β活性来缓解线粒体功能障碍,同时亦可增强神经细胞抗氧化的能力。唐文强等[37]研究表明,芦丁可通过抑制GSK-3β信号通路阻止过氧化氢(H2O2)诱导的人神经母细胞瘤SH-SY5Y细胞和小鼠小脑颗粒神经细胞的凋亡。Gong EJ等[40]利用AD模型小鼠离体脑组织检测桑色素对GSK-3β的抑制作用,结果表明桑色素作为一种GSK-3β的化学抑制剂,可以阻止该因子介导的Tau过度磷酸化,并减少Aβ诱导的人神经母细胞的凋亡。
黄酮类化合物基于信号通路的抗AD作用的机制见表1。
3 新型给药系统在增强黄酮类化合物神经保护作用中的应用
研究表明,虽然大多数黄酮类化合物可作为替代药物治疗AD,但有些药物不能或仅能少量透过血脑屏障(BBB),在肝脏中部分甚至全部被代谢,加之部分黄酮类化合物具有疏水性,难溶或不溶于水,生物利用度低,使其临床应用受到了限制[58]。因此,开发黄酮类化合物新的给药系统是非常有必要的。
纳米粒子因其独特的结构优势、高稳定性、易于表面功能化和修饰以及易于透过BBB而在AD相关制剂的研发中引起了极大的关注[59]。例如,Sun D等[60]通过对小鼠行为学进行的研究结果表明,槲皮素纳米给药系统能明显改善小鼠的认知和记忆障碍,提高其神经细胞活力。Wu TH等[61]通过纳米沉淀法制备槲皮素纳米颗粒体系,可减小槲皮素药物粒径,改善药物溶解度。Tahir A等[62]的研究表明,包载花青素的聚乙二醇金纳米粒(PEG-AuNPs)对AD模型小鼠有较强的神经保护作用,效果优于游离花青素,其对Aβ1-42诱导的AD模型小鼠突触前、后蛋白具有改善作用,且能通过调节PI3K/Akt/GSK-3β磷酸化途径,阻止Tau蛋白磷酸化。可见,将黄酮类化合物包埋到纳米粒中,可以克服药物理化特征的局限性,增强药物的神经保护作用。
4 结语
AD的发病机制极其复杂,致病原因多种多样,单用一种针对某个特定靶点的药物难以有效控制疾病的进展[63]。黄酮类成分是在自然界大量存在的一类具有广泛活性的中药化合物,在AD的治疗中具有多靶点、多途径、多系统的特点,可以通过抑制胆碱酯酶活性、抑制氧化应激及清除自由基、修饰Tau蛋白、减少Aβ形成、抑制炎症因子表达而有效阻断AD的疾病进展[64]。使用富含黄酮类的药物可减轻与年龄相关的认知能力的下降,有助于恢复记忆功能,并减缓与AD相关疾病的发展[65]。但是部分黄酮类化合物具有水溶性差的缺点,将其负载于纳米微粒,能增加黄酮类化合物的生物利用度、降低毒副作用[66]。因此,在以后的研究中,可以进一步探讨黄酮类化合物的药理活性机制和构效关系,并着力研发新型给药系统以期能发现新的特效药物及制剂。黃酮类化合物是中药有效成分中最重要的组成部分,对黄酮类化合物抗AD作用的深入研究将有助于运用现代医学解释中医理论治疗AD的机制。
參考文献
[ 1 ] DIGHE SN,DEORA GS,DE LA MORA E,et al. Discovery and structure-activity relationships of a highly selective butyrylcholinesterase inhibitor by structure-based virtual screening[J]. J Med Chem,2016,59(16):7683-7689.
[ 2 ] GLENN R,STUART F. World Alzheimer report:2015[R].Lodon:the global impact of dementia:Alzheimers Disease International,2015.
[ 3 ] SAWATZKY E,WEHLE S,KLING B,et al. Discovery of highly selective and nanomolar carbamate-based butyrylcholinesterase inhibitors by rational investigation into their inhibition mode[J]. J Med Chem,2016,59(5):2067- 2082.
[ 4 ] HANE FT,ROBINSON M,LEE BY,et al. Recent progress in Alzheimers disease research,part 3:diagnosis and treatment[J]. J Alzheimers Dis,2017. DOI:10.3233/JAD160907.
[ 5 ] SCHMIDT R,HOFER E,BOUWMAN FH,et al. EFNS- ENS/EAN guideline on concomitant use of cholinesterase inhibitors and memantine in moderate to severe Alzheimers disease[J]. Eur J Neurol,2015. DOI:10.1111/ene.12707.
[ 6 ] WANG F,SHING M,HUEN Y,et al. Neuroactive flavonoids interacting with GABA receptor complex[J]. Curr Drug Targets,2005,4(5):575-585.
[ 7 ] WILLIAMS RJ. Flavonoids,cognition,and dementia:actions,mechanisms,and potential therapeutic utility for Alzheimers disease[J]. Free Radical Bio Med,2012,52(1):35-45.
[ 8 ] LI Y,HU H,LI Z,et al. Pharmacokinetic characterizations of ginsenoside ocotillol,RT5 and F11,the promising agents for Alzheimers disease from American ginseng,in rats and beagle dogs[J]. Pharmacology,2019,104(1/2):7-20.
[ 9 ] JONES QRD,WARFORD J,RUPASINGHE HPV,et al.Target-based selection of flavonoids for neurodegenerative disorders[J]. Trends Pharmacol Sci,2012,33(11):602-610.
[10] ALI M,MUHAMMAD S,SHAH MR,et al. Neurologically potent molecules from crataegus oxyacantha:isolation,anticholinesterase inhibition,and molecular docking[J]. Front Pharmacol,2017. DOI:10.3389/fphar. 2017.00327.
[11] JOSHI P,KAWADE V,DHULAP S. Unlocking the concealed targets using system biology mapping for Alzheimers disease[J]. Pharmacol Rep,2019,71(6):1104-1107.
[12] JIM?NEZ-ALIAGA K,BERMEJO-BESC?S P,BENED? J. Quercetin and rutin exhibit antiamyloidogenic and fibril-disaggregating effects in vitro and potent antioxidant activity in APPSwe cells[J]. Life Sci,2011,89(25/26):939-945.
[13] WEI D,TANG J,BAI W,et al. Ameliorative effects of baicalein on an amyloid-β induced Alzheimers disease rat model:a proteomics study[J]. Curr Alzheimer Res,2014,11(9):869-881.
[14] 刘俊岑,张智博,刘海洋,等.补骨脂异黄酮对β淀粉样蛋白损伤PC12细胞的影响[J].国际中医中药杂志,2018,40(2):148-152.
[15] OKUMURA N,YOSHIDA H,NISHIMURA Y,et al. Genistein downregulates presenilin 1 and ubiquilin 1 expression[J]. Mol Med Rep,2012,5(2):559-561.
[16] 梅峥嵘,谭湘萍,黄汉辉,等.葛根素对阿尔茨海默病细胞模型Aβ蛋白的抑制作用[J].中国现代应用药学,2015,32(1):5-9.
[17] 宋明洁,戴雪伶,姜招峰. Tau蛋白过磷酸化与阿尔茨海默病[J].生命科学,2013,25(3):315-319.
[18] MCCARTHY AR,SACHWEH MCC,HIGGINS M,et al. Tenovin-D3,a novel small-molecule inhibitor of sirtuin SIRT2,increases p21(CDKN1A)expression in a p53-independent manner[J]. Mol Cancer Ther,2013,12(4):352-360.
[19] YUAN HF,WANG ZQ,LI L,et al. Activation of stress response gene SIRT1 by BCR-ABL promotes leukemogenesis[J]. Blood,2012,119(8):1904-1914.
[20] INCANI A,DEIANA M,CORONA G,et al. Involvement of ERK,Akt and JNK signalling in H2O2-induced cell injury and protection by hydroxytyrosol and its metabolite homovanillic alcohol[J]. Mol Nutr Food Res,2010,54(6):788-796.
[21] CHESSER AS,GANESHAN V,YANG J. Epigallocatechin-3-gallate enhances clearance of phosphorylated tau in primary neurons[J]. Nutr Neurosci,2016,19(1):21- 31.
[22] BLANDER JM,LONGMAN RS,ILIEV ID,et al. Regulation of inflammation by microbiota interactions with the host[J]. Nat Immunol,2017. DOI:10.1038/ni.3780.
[23] ORHAN I,KARTAL M,TOSUN F. Screening of various phenolic acids and flavonoid derivatives for their anticholinesterase potential[J]. Z Naturforsch C,2007,62(11/12):829-832.
[24] KHAN H,MARYA,AMIN S,et al. Flavonoids as acetylcholinesterase inhibitors:Current therapeutic standing and future prospects[J]. Nat Immunol,2018. DOI:10.1016/j.biopha.2018.03.007.
[25] ABDALLA FH,CARDOSO AM,PEREIRA LB,et al.Neuroprotective effect of quercetin in ectoenzymes and acetylcholinesterase activities in cerebral cortex synaptosomes of cadmium-exposed rats[J]. Mol Cell Biochem,2013,381(1/2):1-8.
[26] 張永亮,陈海龙,王婷梅,等.木犀草素对东莨菪碱所致大鼠学习记忆障碍的改善作用[J].化学与生物工程,2017,34(2):33-37、49.
[27] MARKESBERY WR. Damage to lipids, proteins, DNA, and RNA in mild cognitive impairment[J]. Arch Neurol,2007,64(7):954-956.
[28] DI DOMENICO F,BARONE E,PERLUIGI M. Strategy to reduce free radical species in Alzheimers disease:an update of selected antioxidants[J]. Expert Rev Neurother,2015,15(1):19-40.
[29] 刘世贤,毛林飞,于凡,等.阿尔茨海默病的发病机制及天然多酚类化合物的治疗机制研究进展[J].中国新药杂志,2017,26(23):2799-2804.
[30] CHOI SM,KIM BC,CHO YH,et al. Effects of flavonoid compounds on β-amyloid-peptide-induced neuronal death in cultured mouse cortical neurons[J]. Chonnam med J,2014,50(2):45-51.
[31] HE L,DENG Y,GAO J,et al. Icariside Ⅱ ameliorates ibotenic acid-induced cognitive impairment and apoptotic response via modulation of MAPK pathway in rats[J]. Phytomedicine,2018. DOI:10.1016/j.phymed.2018.01.025.
[32] BHAT SA,SOOD A,SHUKLA R. AT2R Activation prevents microglia pro-inflammatory activation in a NOX-dependent manner:inhibition of pkc activation and p47 phosphorylation by PP2A[J]. Mol Neurobiol,2019,56(4):3005-3023.
[33] MACCIONI RB,ROJO LE,FERN?NDEZ JA. The role of neuroimmunomodulation in Alzheimers disease[J]. Ann NY Acad Sci,2009. DOI:10.1111/j.1749-6632.2008. 03972.x.
[34] VARGAS-RESTREPO F,SABOGAL-GU?QUETA AM,CARDONA-G?Mez GP,et al. Quercetin ameliorates inflammation in CA1 hippocampal region in aged triple transgenic Alzheimers disease mice model[J]. Biomedica,2018. DOI:10.7705/biomedica.v38i0.3761.
[35] 呂书仪,胡薇.学习的生物学基础:突触可塑性[J].生物学教学,2020,45(1):77-78.
[36] LI Q,ZHAO HF,ZHANG ZF,et al. Long-term green tea catechin administration prevents spatial learning and memory impairment in senescence-accelerated mouse prone-8 mice by decreasing Aβ1-42 oligomers and upregulating synaptic plasticity-related proteins in the hippocampus[J]. Neuroscience,2009,163(3):741-749.
[37] SPENCER JP. Flavonoids:modulators of brain function[J]. Br J Nutr,2008,99(s1):s60-s77.
[38] ALI T,KIM T,REHMAN SU,et al. Natural dietary supplementation of anthocyanins via PI3K/Akt/Nrf2/HO-1 pathways mitigate oxidative stress,neurodegeneration,and memory impairment in a mouse model of Alzheimers disease[J]. Mol Neurobiol,2018,55(7):6076-6093.
[39] 唐文强,张静晓,张丽雷.基于中草药活性成分的GSK-3β抑制剂的分子模拟[J].天然产物研究与开发,2018,30(12):2070-2076.
[40] GONG EJ,PARK HR,KIM ME,et al. Morin attenuates tau hyperphosphorylation by inhibiting GSK-3β[J]. Neurobiol Dis,2011,44(2):223-230.
[41] KIM DC,QUANG TH,OH H,et al. Steppogenin isolated from cudrania tricuspidata shows antineuroinflammatory effects via NF-κB and MAPK pathways in LPS-stimulated BV2 and primary rat microglial cells[J]. Molecules,2017. DOI:10.3390/molecules22122130.
[42] 齐越,姜鸿,李纪彤,等.益智聪明汤对Aβ25-35致阿尔茨海默病小鼠Tau蛋白磷酸化的影响[J].中成药,2017,39(10):1999-2003.
[43] BAKHTIARI M,PANAHI Y,AMELI J,et al. Protective effects of flavonoids against Alzheimers disease-related neural dysfunctions[J]. Biomed Pharmacother,2017. DOI:10.1016/j.biopha.2017.06.010.
[44] XING G,DONG M,LI X,et al. Neuroprotective effects of puerarin against beta-amyloid-induced neurotoxicity in PC12 cells via a PI3K-dependent signaling pathway[J]. Brain Res Bull,2011,85(3/4):212-218.
[45] LIU T,ZHANG L,JOO D,et al. NF-κB signaling in inflammation[J]. Signal Transduct Target Ther,2017. DOI:10.1038/sigtrans.2017.23.
[46] ZUO L,HEMMELGARN BT,CHUANG CC,et al. The role of oxidative stress-induced epigenetic alterations in amyloid-β production in Alzheimers disease[J]. Oxid Med Cell Longev,2015. DOI:10.1155/2015/604658.
[47] MORGAN MJ,LIU ZG. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Res,2011,21(1):103- 115.
[48] ZHOU X,YUAN L,ZHAO X,et al. Genistein antagonizes inflammatory damage induced by β-amyloid peptide in microglia through TLR4 and NF-κB[J]. Nutrition,2014,30(1):90-95.
[49] HE P,YAN S,ZHENG J,et al. Eriodictyol attenuates LPS- induced neuroinflammation,amyloidogenesis,and cognitive impairments via the inhibition of NF-κB in male C57BL/6J mice and BV2 microglial cells[J]. J Agric Food Chem,2018,66(39):10205-10214.
[50] ZHENG N,YUAN P,LI C,et al. Luteolin reduces BACE1 expression through NF-κB and through estrogen receptor mediated pathways in HEK293 and SH-SY5Y cells[J]. J Alzheimers Dis,2015. DOI:10.3233/JAD- 142517.
[51] 宋來新,张长城,王婷,等.淫羊藿总黄酮通过抑制MAPK/NF-κB信号通路减轻自然衰老大鼠脑组织炎症反应[J].中国药理学通报,2017,33(1):84-90.
[52] FINKBEINER S,TAVAZOIE SF,MALORATSKY A,et al. CREB:a major mediator of neuronal neurotrophin responses[J]. Neuron,1997,19(5):1031-1047.
[53] LEE M,MCGEER EG,MCGEER PL. Quercetin,not caffeine,is a major neuroprotective component in coffee[J]. Neurobiol Aging,2016. DOI:10.1016/j.neurobiolaging. 2016.06.015.
[54] LAURETTI E,DINCER O. Glycogen synthase kinase-3 signaling in Alzheimers disease[J]. Biochem Biophys Acta Mol Cell Res,2020. DOI:10.1016/j.bbamcr.2020.118664.
[55] ORELLANA AM,VASCONCELOS AR,LEITE JA,et al. Age-related neuroinflammation and changes in AKT- GSK-3β and Wnt/β-catenin signaling in rat hippocampus[J]. Aging:Albany NY,2015,7(12):1094-1111.
[56] FUJIWARA H,YOSHIDA J,DIBWE DF,et al. Orengedokuto and sanoshashinto improve memory deficits by inhibiting aging-dependent activation of glycogen synthase kinase-3β[J]. J Tradit Complement Med,2018,9(4):328-335.
[57] WANG D,LIU L,ZHU X,et al. Hesperidin alleviates cognitive impairment,mitochondrial dysfunction and oxidative stress in a mouse model of Alzheimer's disease[J]. Cell Mol Neurobiol,2014,34(8):1209-1221.
[58] SPUCH C,NAVARRO C. Liposomes for targeted delivery of active agents against neurodegenerative diseases:Alzheimers disease and Parkinsons disease[J]. Drug Deliv,2011. DOI:10.1155/2011/469679.
[59] LI M,XU C,WU L,et al. Self-assembled peptide-polyoxometalate hybrid nanospheres:two in one enhances targeted inhibition of amyloid β-peptide aggregation associated with Alzheimers disease[J]. Small,2013,9(20):3455- 3461.
[60] SUN D,LI N,ZHANG W,et al. Design of PLGA-functionalized quercetin nanoparticles for potential use in Alzheimers disease[J]. Colloids Surf B Biointerfaces,2016.DOI:10.1016/j.colsurfb.2016.08.052.
[61] WU TH,YEN FL,LIN LT,et al. Preparation,physicochemical characterization, and antioxidant effects of quercetin nanoparticles[J]. Int J Pharm,2008,346(1/2):160- 168.
[62] TAHIR A,MIN JK,SHAFIQ UR,et al. Anthocyanin-loaded PEG-gold nanoparticles enhanced the neuroprotection of anthocyanins in an Aβ1-42 mouse model of Alzheimers disease[J]. Mol Neurobiol,2017,54(8):6490-6506.
[63] JONES QR,WARFORD J,RUPASINGHE HP. Target- based selection of flavonoids for neurodegenerative disorders[J]. Trends Pharmacol Sci,2012,33(11):602-610.
[64] BOMBARDI DAC,SANTANA MG,DI CAMILO OG,et al. Literature evidence and ARRIVE assessment on neuroprotective effects of flavonols in neurodegenerative diseases models[J]. CNS Neurol Disord Drug Targets,2018,17(1):34- 42.
[65] SPENCER SJ,KOROSI A,LAY? S,et al. Food for thought:how nutrition impacts cognition and emotion[J]. NPJ Sci Food,2017. DOI:10.1038/s41538-017-0008-y.
[66] 王治平,周群,樊化,等.口服葛根總黄酮纳米混悬液冻干粉的制备及其4种有效成分溶出度考察[J].中草药,2014,45(5):635-641.
(收稿日期:2020-06-25 修回日期:2020-11-19)
(编辑:孙 冰)

