储存时间对消毒后软式内镜微生物污染的影响
刘明秀,王 玲,杨 娟,陶 锐
(重庆市璧山区人民医院 1. 内镜中心; 2. 手术室; 3. 肝胆外科,重庆 402760)
内镜对疾病的预防、诊断和治疗起到积极作用,由内镜相关感染所致严重风险是全球领域内一个新的公共健康威胁[1-2]。美国急救研究所发布的《2016年十大医疗技术危害名单》中柔性内镜感染位居首位[3]。软式内镜已成为医院感染的主要媒介,内镜储存则为其中的一个危险因素[4]。而有关内镜储存安全期尚无统一标准。美国胃肠科护士协会(SGNA)支持7 d存储间隔,前提是根据制造商说明和专业指南对内镜再处理、储存[5]。韩国胃肠内镜学会(KSGE)内镜后处理指南未给出储存时间建议[6]。我国《软式内镜清洗消毒技术规范》(WS 507—2016)规定每日诊疗工作前,应对拟使用的消毒内镜进行再次消毒、终末漂洗、干燥后,方可用于患者诊疗[7]。该措施实施背景则是考虑到各诊疗机构储存条件不一,但消毒内镜再处理将增加时间和人力、物力成本,加剧内镜耗损,于是有专家提出在循环洁净空气等储存条件下消毒合格内镜可取消再处理。本研究结合医院工作和节假日特点,将使用中的软式内镜消毒后分别储存24、48、72、168 h,监测内镜管腔与表面菌落数,旨在探索常温环境下不同储存时间对内镜微生物污染的影响,以降低内镜再处理频率,并为规范的修订提供数据支持。
1 对象与方法
1.1 研究对象 采用便利抽样法选取重庆市某三甲医院内镜中心的软式内镜进行前瞻性研究。纳入标准:临床使用中的软式内镜,内镜结构完整,测漏试验无漏水,有管腔。排除标准:内镜储存前高水平消毒失败。筛选出符合试验标准的软式内镜27条,包括11条Olympus胃镜、7条Olympus肠镜、2条Olympus十二指肠镜、2条Olympus喉镜、1条Pentax喉镜、4条Pentax气管镜。2017年10月—2019年2月,根据节假日与医院工作特点,将108条次内镜高水平消毒后常温下储存24、48、72、168 h,监测内镜管腔菌落数与表面菌落数。内镜储存前均高水平消毒合格,因此,最终纳入试验样本为432条次内镜。
1.2 其他材料 内镜储存于柯丽尔内镜双门或单门储存柜,柜壁材质为高分子复合材料,均有消毒与除湿功能。内镜出镜柜后采用紫外线对镜柜进行空气消毒30 min,内镜入镜柜后对镜柜进行环境除湿60 min,每日2次。每周采用75%乙醇擦拭消毒镜柜内表面。
1.3 方法
1.3.1 内镜消毒 消毒剂为利尔康邻苯二甲醛(o-phthaldialdehyde,OPA);消毒时间:气管镜≥10 min,胃肠等其他内镜≥5 min,结核分枝杆菌污染内镜≥15 min。节假日前一日诊疗工作结束,遵循《软式内镜清洗消毒技术规范》(WS 507—2016)对内镜进行清洗-漂洗-消毒-终末漂洗-干燥。
1.3.2 内镜储存前监测 内镜干燥流程结束即刻对试验中的内镜管腔与表面进行采样,两人配合操作,每采样一条内镜后更换无菌手套,方法遵循《医院消毒卫生标准》(GB 15982—2012),采用倾注平板法计数及法国梅里埃VITEK 2 Compact细菌鉴定仪监测,48 h出结果。(1)管腔采样:用无菌注射器抽取50 mL含0.3%甘氨酸中和剂的洗脱液,从活检口注入内镜插入部管腔,再注入空气,全量收集于无菌容器后立即送检,2 h内检测。(2)表面采样:用浸有含0.3%甘氨酸洗脱液的无菌采样棒1支,对内镜插入部自后端至前端进行全面积涂抹,并随之转动采样棒,将采样棒放回无菌干燥管中立即送检,2 h内检测。(3)微生物检测:管腔采样是将洗脱液混匀后取1 mL接种平皿,表面采样是将采样棒用洗脱液浸没并充分震荡后取1 mL接种平皿,将冷至40~45℃的熔化营养琼脂培养基每皿倾注15~20 mL,(36±1)℃恒温箱培养48 h,计算菌落数,合格标准为≤20 CFU/件且无致病菌[8]。
1.3.3 内镜储存 内镜采样后重新终末漂洗-干燥,管腔干燥流程:第一步用高压气枪初步干燥,第二步灌注75%乙醇,第三步用高压气枪彻底干燥。镜体垂直悬挂于镜柜,各类按钮和阀门取下单独储存,开启除湿键。将108条次内镜分别储存24、48、72、168 h,镜柜内放置得力温湿度计(单门1支、双门2支),储存期间柜门常闭,每日下午2:00从玻璃门外观察并记录常温下镜柜的温湿度。
1.3.4 镜柜环境监测 当内镜分别储存24、48、72、168 h时,按I类环境对镜柜进行空气与物体表面采样培养,监测方法和合格标准参照《医院消毒卫生标准》(GB 15982—2012)。
1.3.5 内镜储存后监测 当内镜分别储存24、48、72、168 h时,对内镜管腔与表面进行采样,采样与检测方法、判断标准同内镜储存前监测。
1.3.6 偏椅控制 由专人实施内镜采样和内镜检测,对检验员实行单盲,内镜消毒后储存前不合格标本将被剔除。
1.4 统计学方法 应用Excel表格录入数据,采用描述统计方法描述内镜管腔菌落数与表面菌落数及其合格率、镜柜空气与物体表面菌落数及其合格率。
2 结果
2017年10月—2019年2月内镜储存前均高水平消毒合格,共432条次内镜纳入监测,内镜储存24、48、72、168 h的菌落数监测合格率见表1。其中108条次内镜储存24、48、72、168 h的表面菌落数为0,108条次内镜储存24、48、72 h的管腔菌落数为0,107条次内镜储存168 h的管腔菌落数为0,1条次内镜储存168 h的管腔菌落数为6 CFU/件,但无致病菌。镜柜空气与物体表面共采样288份,菌落数监测合格率均为100%。
表1不同储存时间及温湿度环境下内镜管腔及表面菌落数监测合格情况
Table1Qualified result of bacterial colony monitoring on endoscopic lumen and surface under different sto-rage time, temperature and humidity
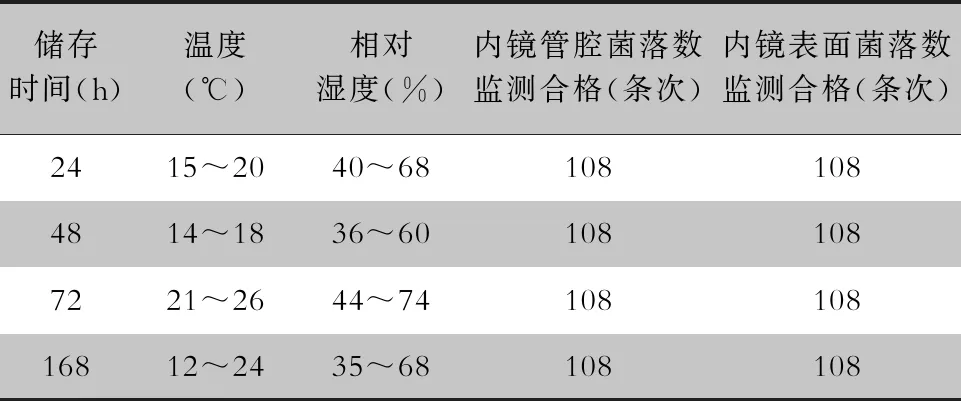
储存时间(h)温度(℃)相对湿度(%)内镜管腔菌落数监测合格(条次) 内镜表面菌落数监测合格(条次)2415~2040~681081084814~1836~601081087221~2644~7410810816812~2435~68108108
3 讨论
国内外对内镜储存环境均有要求,但未明确环境温湿度。SGNA和KSGE指南均建议将内镜存放于清洁无尘、通风良好的镜柜[5-6]。国内规范建议将内镜存放在清洁干燥、通风良好、表面光滑无缝隙的镜(库)柜,灭菌内镜遵循无菌物品储存要求[7]。消毒供应中心管理规范建议无菌物品宜存放于温度<24℃、相对湿度<70%、换气次数4~10次/分的环境[9]。温度和相对湿度是影响微生物生长繁殖的两个最重要的参数,而相对湿度则影响更大,当相对湿度为90%时微生物能够繁殖,当相对湿度为60%时微生物数量维持不变[10]。本研究选择下午2:00(一天中气温最高点)观察常温环境下镜柜的温湿度,监测到柜内最高温度26℃、最高湿度74%。镜柜空气与物体表面共采集288份样本,菌落数监测合格率均为100%。
内源性病原体是引发内镜感染的主要来源,因此明确储存时间与致病菌发生的关系至关重要[11],但有关内镜储存的安全期尚无统一定论。国内外研究[12-13]结果表明,消化内镜消毒合格后在合格的储存环境中7~14 d内不必再处理。宋林等[14]报道内镜再处理后储存14 d内存在较低的致病菌滋生风险。研究[11, 15]显示,消毒合格内镜储存21 d不会发生致病菌污染或病原菌定植风险低。本研究纳入432条次消毒内镜进行监测,储存前内镜均监测合格,在常温环境下放置24、48、72、168 h,以监测消化内镜、呼吸内镜等微生物污染现状,结果显示所有软式内镜储存24、48、72、168 h的菌落数监测合格率均为100%。分析与该内镜中心对内镜管腔充分干燥相关,采用高压气枪-75%乙醇-高压气枪三步流程,削弱了细菌生长的条件。内镜储存前干燥环节尤为重要,内镜通道干燥不足可能是微生物繁殖的原因[16-17]。有关干燥柜的数据表明,内镜管腔彻底干燥降低了储存期细菌增殖的风险[17-19]。本试验结果表明,软式内镜高水平消毒合格后在合格环境下储存168 h是安全的,与王伟民[2]报道的内镜在温度15~25℃、湿度41%~60%环境下的7 d安全储存周期基本一致。与陶西萍等[20]报道的内镜存放时间≥63 h存在细菌数超标有所不同,可能是本研究采用倾注平板法计数,陶西萍等的研究则采用滤膜法计数提高了病原菌检出率。
本研究的不足之处在于最长试验周期仅有7 d,且环境气温并非处于一年中最高,内镜在温湿度异常升高环境下的安全期有待进一步探讨。目前关于软式内镜的最长储存时间仍不明确[21-22],需要进行进一步的研究。
——石家庄市保利启新小学软式棒垒球侧记

