黄海南部海域不同类群微型浮游原生生物生长对亚洲沙尘和磷添加的响应❋
晨 曦, 刘光兴,2, 白晓岩, 史冬婉, 张 潮,2, 赵阳国,2❋❋, 高会旺,2
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100; 2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;3.中国海洋大学海洋生命学院,山东 青岛 266003)
海洋微型浮游原生生物的粒径一般为2~20 μm,是微型食物环的重要组成,对有机质分解和营养盐再生有着重要贡献,在海区营养盐的补充和初级生产力的维持方面均发挥着不可替代的作用[1-5]。原生生物种类庞杂,准确分类鉴定十分困难,使对其生态特征和功能的深入研究受到极大限制,而且,原生生物的营养代谢涵盖自养、异养和兼养等多种营养类型[4-8],使其生态功能更加复杂,如果通过粒径和营养方式划分功能类群,可以更清晰地表明其在不同生态系统中的生态作用,这种概念目前已逐渐被广泛接受[6,9-12]。
黄海是中国四大边缘海之一,自然资源十分丰富、沿岸经济发达,也是陆地、海洋和大气等各种过程相互作用较为激烈的海区,一直备受海洋学者的关注[13]。沙尘沉降是陆源营养物质和污染物向海洋输送的重要途径,是海洋中限制性营养元素的重要来源[14-17]。亚洲沙尘指源于中亚和东亚地区的沙尘,是全球沙尘的重要组成部分[14]。亚洲沙尘天气中大量沙尘颗粒从中国西北部长距离输运后沉降入黄海[14,17],对近海和大洋营养盐的贡献(如铁、氮、磷等)是沙尘影响海洋生态系统的主要方面[14]。黄海又是主要受P潜在限制的海区,在南黄海以秋季最为突出[18],营养盐的变化会导致海洋生态系统发生诸如原生生物的营养习性、群落结构改变等问题,使其对营养物质的利用与转化能力发生变化,并进一步影响其生态功能的发挥[1,19]。
为探讨沙尘沉降和P添加对南黄海微型浮游原生生物的影响及沙沉降作用与P溶出之间的关系,本研究于2014年11月在南黄海海域进行了现场模拟培养实验,通过分析不同粒径级和营养类型浮游原生生物生长速率的变化,研究不同类群原生生物生长对沙尘和P添加的响应,以期为深入探讨沙尘沉降对海洋微型生物种群结构和生态功能的影响及作用机制提供科学参考。
1 材料与方法
1.1 沙尘采集与处理
内蒙古浑善达克沙地是我国北方起尘总量较高的沙地[20],在内蒙古沙地产生的沙尘所影响的中国近海海区中,黄海是影响可能性最大的海区[17],因此本研究采用来自内蒙古浑善达克沙地(42°22′28″N,112°58′34″E)的沙尘。沙尘于2011年5月采集表层土壤,-20 ℃冷冻保存。在实验室经20 μm筛网过筛后,再进行人工老化处理[21]。用ICS-1100离子色谱仪(美国安捷伦公司)分析其中营养盐与重金属含量,总有机碳采用高温燃烧氧化法由岛津 TOC-V 型总有机碳测定仪测定[22],结果见表1。

表1 实验用沙尘中营养盐、DOC及溶解性微量元素的浓度Table 1 Concentrations of nutrients, DOC, dissolved trace metals in the dust
1.2 沙尘沉降模拟培养体系的建立与培养
于2014年11月搭载“东方红2号”科考船在黄海南部H03站(36°06′00″N,121°39′00″E)采集现场海水进行沙尘沉降的随船模拟培养实验,采样站位见图1。使用船载CTD采水器(Seabird 911,USA)采集表层海水,将采集到的海水立即用20 μm筛绢过滤以除去大、中、小型浮游生物。将过滤海水分装至1.5 L的无菌PET培养瓶中,将培养瓶置于固定在甲板上周围无遮光影响的水槽中进行船基模拟培养,水槽中通入现场循环海水以维持培养水温。

图1 培养站位Fig.1 Location of incubation stations
培养实验分5组进行,分别为对照组(Control)、低沙尘添加组(LD)、高沙尘添加组(HD)、低磷添加组(LP)和高磷添加组(HP),所添加的沙尘和营养盐量以历年在黄海海域观测所得数据为参考[23],各实验组的添加量见表2。每个船基培养实验均设置3个平行实验组,培养周期为5天,培养期间每天采样1次。沙尘和磷酸二氢钠(P)均在培养体系建立后立即一次性添加。

表2 培养组沙尘和营养盐添加量Table 2 Experimental groups and concentration
1.3 样品采集与测定
微型浮游原生生物样品 于培养期间的每天上午8∶00采集样品,取样前先缓慢将PET培养瓶倒置3次以上,使培养体系中的微型浮游生物均匀分布。无菌取培养瓶中水样各10 mL,分别加入无菌冻存管中,立即加入10%多聚甲醛固定(终浓度为0.5%),轻微颠倒混匀后立即置于液氮瓶中迅速冷冻,再转入-80 ℃超低温冰箱中保存,每次均取3个平行样。
微型浮游原生生物数量的测定采用BD C6 plus流式细胞仪进行。样品经SYBR Green Ⅰ染色,激发光波长为488 nm,绿色荧光(FL1,波长(530±20) nm)为染色荧光,红色荧光(FL3,波长>630 nm)为自发荧光。FL1荧光信号强、FL3荧光信号弱为异养型,FL3荧光信号强为自养型,FL3荧光信号弱于自养型但强于异养型为兼养型。测定样品时加入2、5和10 μm标准微球确定样品在流式细胞仪上的粒径范围,按2~5 μm(小粒径)、5~10 μm(中粒径)和10~20 μm(大粒径)3个粒径级分别计数3种营养型的原生生物数量。
原生生物生长速率计算公式为μ=(lnNt-lnN0)/(t-t0)。式中:μ为比生长速率(d-1);N0、Nt分别为单位水体中原生生物的起始数量和培养t天后的数量(cells·cm-3)[24]。
溶解有机碳 在采集培养体系用海水的同时,另采集CTD采水器的现场水样,用经450 ℃灼烧12 h处理的GF/F 滤膜(Whatman,UK)过滤后装入经同法高温烧灼处理的50 mL玻璃瓶,4 ℃避光保存,带回实验室用高温燃烧氧化法由岛津 TOC-VCPN 型总有机碳测定仪测定[22]。

1.4 数据处理与分析
采用 SPSS 软件(SPSS Inc., Chicago IL)中多因素方差分析法分析培养体系中各分组之间结果的差异显著性。
2 结果与分析
2.1 培养站位H03的环境特征

2.2 10~20 μm微型原生生物生长对沙尘和磷添加对的响应
10~20 μm不同营养型微型原生生物生长对沙尘和磷添加的响应见图2,各组自养、异养和兼养型原生生物生长速率的变化见图2。由图2可见,10~20 μm原生生物在培养期间的生长速率除沙尘组异养和兼养型是先降低后升高外,其他各组均具有先增加后降低的趋势,但不同浓度沙尘和磷添加组与对照组相比生长速率的变化较大。对照组C组在培养第1天,自养、异养和兼养型原生生物的生长速率分别为0.26、0.71和0.90 d-1,培养结束时分别为0.08、-0.71和-0.71 d-1。

(注:“*”代表具有高度显著性差异。“*”Represent highly significant difference.)
图2 10~20 μm各组自养(a)、异养(b)和兼养(c)型原生生物的生长速率
Fig. 2 Growth rate of phototrophic(a), heterotrophic(b) and mixotrophic(c) nanoplanktonic protists 10~20 μm in size
P添加组在培养第1天,自养型HP、LP组的生长速率分别为1.39和0.96 d-1,分别是对照组的5.35和3.69倍(P<0.05);异养型HP组、LP组的生长速率分别为2.12、1.27 d-1,分别是对照组的2.99和1.79倍(P<0.05);兼养型HP组、LP组的生长速率分别为1.84和1.31 d-1,分别为对照组的2.04和1.46倍(P<0.05)。培养结束时,自养型HP、LP组的生长速率分别为-0.41和0.29 d-1,异养型分别为-2.26和-0.2 d-1,兼养型分别为-1.51和0.59 d-1;高P添加组各营养类型的原生生物生长速率均为负增长,显著低于C组(P<0.05),低P组均略高于C组,但差异不显著。
沙尘添加组在培养第1天,10~20 μm不同营养类型原生生物生长速率的变化有所不同。自养型原生生物在HD、LD组的生长速率分别为0.69 和0.47 d-1,明显高于C组(P<0.05),分别为C组的2.65和1.81倍,但均低于P添加的各组,异养型原生生物在HD、LD组的生长速率分别为-0.20和-0.33 d-1,均低于对照组且表现为负增长(P<0.05);兼养型在HD、LD组的生长速率分别为0.12和0.13 d-1,均低于对照组(P<0.05)培养结束时,各沙尘添加组10~20 μm不同营养类型原生生物生长速率差异较大,自养型HD、LD组的生长速率分别为-0.12和0.10 d-1,低沙尘组显著高于对照组(P<0.05),但高沙尘组为负值,显著低于对照组(P<0.05);异养型HD、LD组分别为0.71 和0.17 d-1,兼养型分别为1.11和0.53 d-1,沙尘组均显著高于对照组(P<0.05)。
2.3 5~10 μm微型原生生物生长对沙尘和磷添加的响应
5~10 μm自养型、异养型和兼养型微型原生生物生长对沙尘和磷添加的响应见图3。由图3可见,5~10 μm各组原生生物在培养期间的生长速率的变化趋势与10~20 μm的基本相同,但变化幅度差异很大。特别是C组在培养第1天自养、异养和兼养型原生生物的生长速率分别为-0.35、0.31和-0.04 d-1,在培养结束时分别为-0.49、-1.12和0.29 d-1,培养期间增长率变化不大或以负增长为主,主要与培养期间上一营养级的捕食压力有关[26]。
HP、LP组在培养第1天,自养型的生长速率分别为1.31和0.56 d-1,异养型分别为2.02和1.19 d-1,兼养型分别为1.09和0.53 d-1,P添加组各营养类型的生长速率均明显高于对照组(P<0.05),各HP组的增加幅度显著大于LP组(P<0.05),其中自养型原生生物生长速率的增幅最为明显。培养结束时,自养型HP、LP组的生长速率分别为-0.07和-0.16 d-1,异养型分别为-2.45和-0.15 d-1,兼养型分别为-1.02和0.92 d-1;高P添加组各营养类型的原生生物生长速率均为负增长,显著低于C组(P<0.05);低P组各营养型均高于C组(P<0.05)。
沙尘添加后在培养第1天,5~10 μm不同营养类型原生生物生长速率的变化也不尽相同。HD、LD组自养型原生生物的生长速率分别为0.40和0.20 d-1,异养型分别为-0.86和0.05 d-1,兼养型分别为-0.33和-0.57 d-1。培养结束时,各沙尘添加组5~10 μm原生生物生长速率与对照组相比变化很大,自养型HD、LD组的生长速率分别为0.04和-0.37 d-1,异养型分别为1.63和0.10 d-1,兼养型分别为1.16和0.53 d-1,沙尘添加的各营养类型组原生生物生长速率均高于C组(P<0.05),且高沙尘组显著高于低沙尘组(P<0.05),特别是对异养型和兼养型的促进作用更加显著。

(注:“*”代表具有高度显著性差异。“*”Represent highly significant difference.)
图3 5~10 μm各组自养(a)、异养(b)和兼养(c)型原生生物的生长速率
Fig. 3 Growth rate of phototrophic(a), heterotrophic(b) and mixotrophic(c) nanoplanktonic protists 5~10 μm in size
2.4 2~5 μm微型原生生物生长对沙尘和磷添加的响应
沙尘和磷添加下2~5 μm自养型、异养型和兼养型微型原生生物生长速率的变化见图4。
2~5 μm自养型、异养型和兼养型微型原生生物对沙尘和磷添加的响应见图4。对照组在培养第1天的自养、异养和兼养型原生生物的生长速率分别为0.02、0.27和0.11 d-1,培养结束时分别为0.46、-0.46和0.18 d-1。
在培养第1天,HP、LP组自养型的生长速率分别为0.96和0.56 d-1,异养型分别为1.40和0.85 d-1,兼养型分别为1.12和0.68 d-1,P添加组各营养类型的生长速率均明显高于对照组(P<0.05),且HP组显著大于LP组(P<0.05),其中异养型原生生物生长速率最高,其次为兼养型。培养结束时,自养型HP组、LP组的生长速率分别为-0.72和0.16 d-1,异养型分别为-0.82和0.13 d-1,兼养型分别为-0.21和0.47 d-1,高P添加组各营养类型的原生生物生长速率均为负增长,显著低于C组(P<0.05);低P组除自养型外均高于C组(P<0.05)。
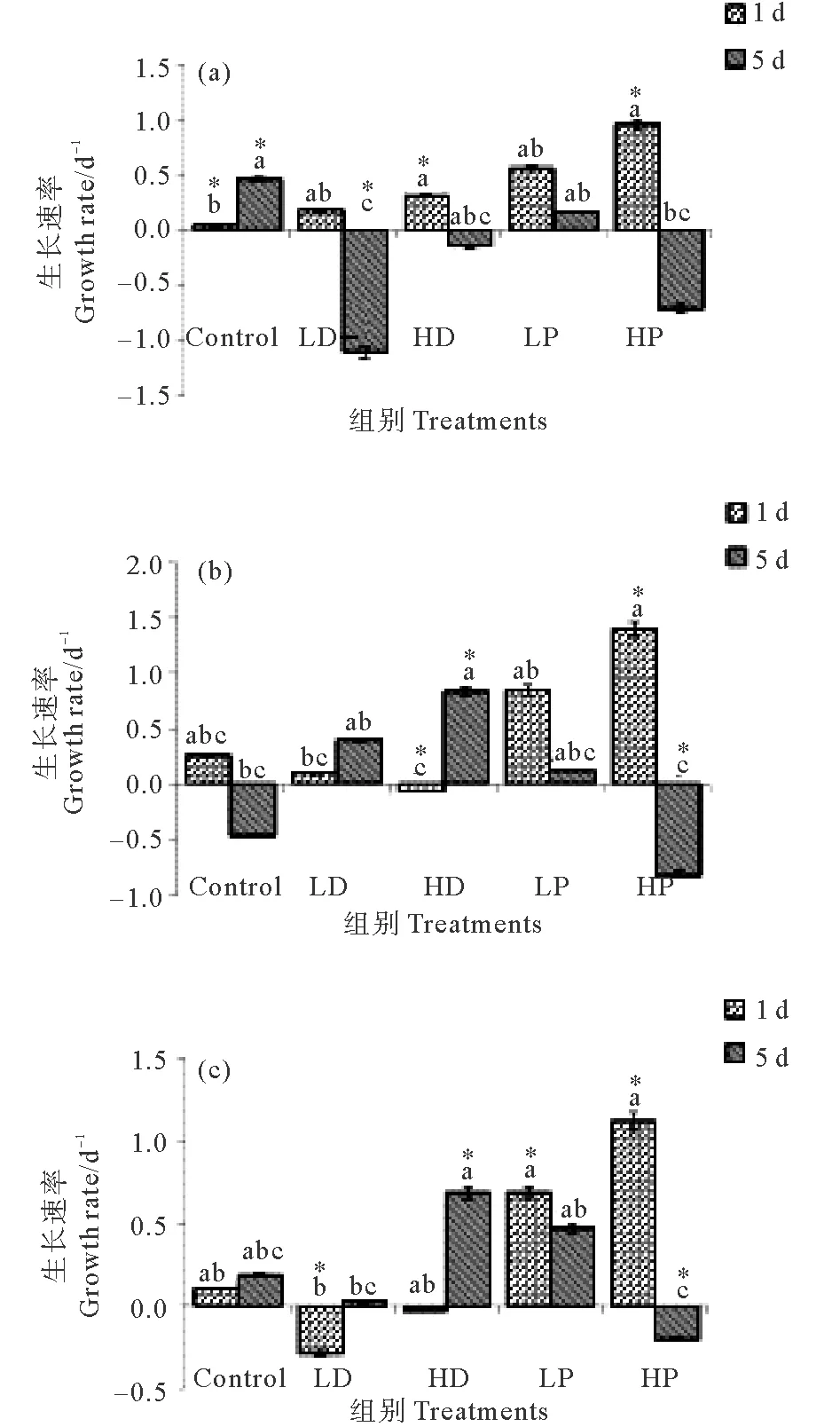
(注:“*”代表具有高度显著性差异。“*”Represent highly significant difference.)
图4 2~5 μm各组自养(a)、异养(b)和兼养(c)型原生生物的生长速率
Fig. 4 Growth rate of phototrophic(a), heterotrophic(b) and mixotrophic(c) nanoplanktonic protists 2~5 μm in size
2~5 μm各营养类型原生生物生长对沙尘添加响应不同。在培养第1天,自养型原生生物在HD、LD组的生长速率分别为0.31和0.17 d-1,明显高于C照组(P<0.05),但均低于P添加的各组。该粒径异养型原生生物在HD、LD组的生长速率分别为-0.06和0.10 d-1,兼养型分别为-0.04和-0.29 d-1,以负增长为主,均显著低于对照组(P<0.05)。培养结束时,2~5 μm沙尘添加组不同营养类型原生生物生长速率变化差异较大,自养型HD、LD组的生长速率分别为-0.15 和-1.10 d-1,异养型分别为0.84和0.40 d-1,兼养型分别为0.68和0.01 d-1。
2.5 沙尘和P添加对不同原生生物类群组成的影响
沙尘和P添加的各实验组和对照组原生生物各粒径级和营养型组成结构变化见图5。由图中结果可以看出,不同类群原生生物的组成构成变化存在明显差异。培养第1天,HD、LD两个沙尘添加组自养型原生生物的增加幅度最为显著,其中5~10 μm所占比例增加幅度最大,分别为对照组的2.00和2.25倍(P<0.05),而2~5 μm自养型原生生物所占比例最大,分别为27.80%和26.50%,但较C组增加的幅度小于5~10 μm组,分别为C组的1.50和1.43倍(P<0.05);P添加的HP、LP组5~10 μm自养型和异养型的增幅较大,自养型分别为C组的1.75、1.25倍(P<0.05),异养型分别为C组的1.86、1.33倍(P<0.05);HP组10~20组异养型也有较C组明显增加,为C组的1.40倍(P<0.05)。
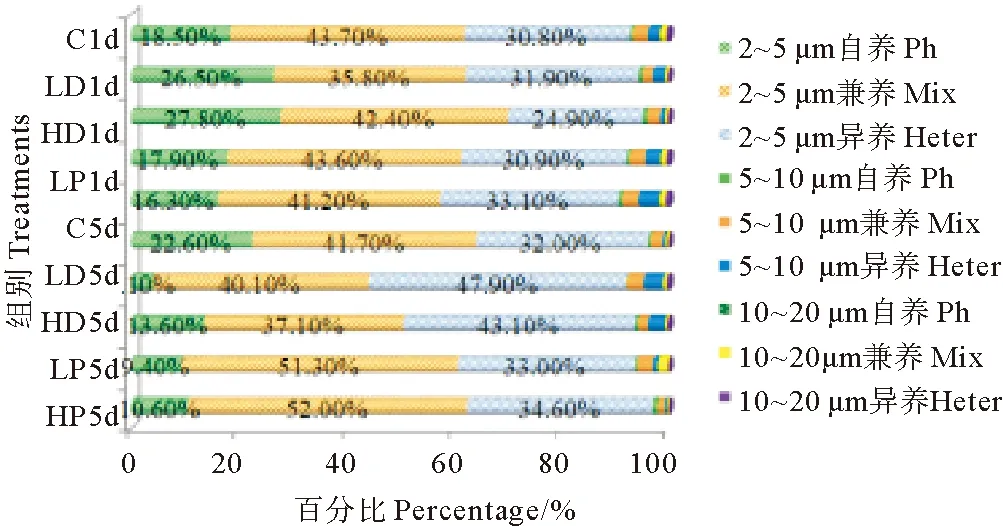
(注:“*”代表具有高度显著性差异。“*”Represent highly significant difference.)
图5 不同粒径级和不同营养型原生生物的构成比变化
Fig.5 Abundance structure of nanoplanktonic protists in different size and trophic types
培养结束时,各实验组异养型所占比例和增幅都较对照组显著增加,HD、LD组5~10 μm异养型分别是对照组的7.20和5.80倍(P<0.05),增幅最大,10~20 μm的增幅次之,分别是对照组的4.0和3.00倍(P<0.05),2~5 μm异养型原生生物所占比例的增幅较小,但其所占比例最大,分别占43.10%和47.90%,是该粒径级的优势类群;在培养结束时各粒径级兼养型原生生物所占比例也有明显变化,特别是HP、LP组2~5 μm兼养型原生生物比例的变化最为显著,分别占52.0%和51.3%,分别为C组的1.25和1.23倍(P<0.05),成为所在组中绝对的优势类群;10~20和5~10 μm兼养型原生生物在LP、LD组的比例也有显著增加,10~20 μm分别为C组的3.80和1.40倍(P<0.05),5~10 μm分别为C组的1.41和1.36倍(P<0.05)。
3 讨论
3.1 南黄海海区不同粒径级和不同营养型原生生物的P限制
3个粒径级的原生生物生长速率在P添加组初期各营养型均明显高于对照组,高磷组增幅大于低磷组,自养型生长速率的增加量显著高于其它营养型,表明该海区各粒径级不同营养类型的浮游原生生物生长均受P 的限制,P的添加会促进各营养类型浮游原生生物的生长,特别是对自养型10~20 μm级和异养型2~5 μm粒径级的原生生物的促进作用最为显著,P添加组自养型生物爆发性生长与体系中缺乏的P得到补充有关,表明大粒径级自养型原生生物受P限制更加明显,而在小粒径级异养型的限制作用更加明显。高P组不同粒径级各营养类型原生生物生长速率在培养后期显著降低,与前期高P添加组原生生物快速生长消耗了其所在环境中的营养物质,导致培养后期营养缺乏使其生长速率下降有关,且前期P添加量越高、原生生物生长率增加幅度越大,后期下降幅度也越大,表明P的一次性添加只能短期内促进原生生物的快速生长,如营养盐得不到及时补充,后期会因营养缺乏而抑制其生长。有研究表明,南黄海秋季大部分海域N/P高达50~100,甚至更高,与高N/P(>100)的长江冲淡水和台湾暖流等共同影响有关[27-28];氮、磷营养元素不仅限制浮游植物的生长,而且还会改变浮游植物的种群结构,使其由小型向微型、微微型转变[29]。本研究结果表明,研究海区不同粒径级各营养型的原生生物均受P 的限制,其中10~20 μm自养型最为明显,其次是2~5 μm粒径级的异养型。对大粒径级自养型原生生物而言,磷的可获得性直接影响海区有机物的净生产量、限制所在海区的食物产出量,也表明上行控制是南黄海大粒径级自养原生生物生长的主要影响因素之一;而小粒径级异养型原生生物的营养限制则会使其在溶解性有机碳的吸收和营养盐再生等物质循环中发挥的作用受到一定影响。
3.2 沙沉降对不同粒径级各营养型原生生物生长速率的影响及与P溶出的关系
沙尘添加对3个粒径级异养和兼养型是抑制作用,特别是对5~10 μm兼养型的抑制作用更强,与沙尘中重金属等有害物质的溶出对原生生物的毒害作用有关[14]。培养后期沙尘添加对异养和兼养型是促进作用,早期沙尘添加量越高、后期对异养和兼养型的增加幅度越大,特别是对中、小粒径级兼养型原生生物在培养后期的促进作用最为显著。表明异养和兼养型原生生物在培养后期对沙尘中溶出的有害物质的影响逐渐耐受,前期因生长被抑制所消耗的营养较少,加之沙尘中包括Fe等微量元素和DOC等有机物溶出[27-30](见表1),补充了培养后期营养物质的需求。沙尘添加对自养型原生生物生长具有显著的促进作用,且变化趋势与P添加组一致,特别是对10~20 μm的最为明显,但最大增长率明显低于P添加组,说明沙尘对原生生物生长的作用机制和P的相同,且可能与沙尘中P 的溶出有关[15],但沙尘溶出的P较添加的P少,对原生生物生长的影响低于P添加组。培养后期沙尘添加对自养型原生生物表现为抑制作用,且前期促进作用越强、后期抑制作用越明显,主要与其早期的过度生长造成后期营养缺乏而生长受到抑制有关。
3.3 不同粒径级各营养型原生生物生长速率对P和沙尘添加的响应
以Kruskal-wallis秩和检验与Nemenyi-Wilcoxon-Wilcox秩和检验综合分析各组中原生生物增长率变化可知,不同浓度沙尘和P对各粒径不同营养型原生生物生长的影响顺序均为HP>LP>C>HD>LD,其中不同浓度沙尘和P添加对各粒径自养型原生生物生长率的影响早期为促进作用,后期为抑制作用。沙尘添加对不同粒径自养原生生物生长速率影响的顺序为10~20 μm>5~10 μm>2~5 μm;P对各粒径异养型和兼养型原生生物生长率的影响为促进作用,沙尘早期为抑制作用,后期为促进作用;沙尘对异养和兼养型促进作用顺序为异养>兼养型;对不同粒径异养原生生物生长速率促进作用的顺序为5~10 μm>2~5 μm>10~20 μm,表现为异养原生生物粒径越小、对沙尘促进作用的响应越快;对不同粒径异养原生生物生长速率抑制作用的顺序为5~10 μm>10~20 μm>2~5 μm,表现为大粒径异养原生生物对沙尘抑制的响应越快;沙尘对不同粒径兼养型原生生物生长速率早期的促进作用和后期抑制作用的顺序一致,均为10~20 μm>5~10 μm>2~5 μm,表明粒径越大的兼养型原生生物对沙尘的影响越敏感。
3.4 沙尘和P添加对原生生物类群组成影响的生态意义
过去几十年的研究已经越来越明显的证明原生生物在海洋生态系统中扮演着极为重要的角色[31]。微型浮游生物在微食物网中占据了一个重要的营养节点[32-33],在某些海区浮游原生生物对原核生物丰度控制和生物多样性保持方面发挥着重要作用[34]。本研究沙尘和P添加早期对10~20 μm粒径级自养原生生物生长速率的促进作用最为显著,但该类群原生生物在所有类群中所占比例的变化与对照组相比没有显著性差异,表明沙尘和P的一次性添加对大粒径自养型原生生物的促进作用持续时间较短,还不足以使其在所占比例上有显著的持续提高,也可能与该粒径级原生生物本身所占比较较少,所占比例增加幅度未能体现出统计学差异有关。自养型微型原生生物是浮游植物的重要组成部分,并贡献了一部分初级生产力[5]。自养型原生生物的生长经常受到营养盐的限制,营养盐或DOC限制会改变原生生物的营养习性,使其对营养盐或有机碳的利用与转化能力发生变化,进而改变其生态功能[4,35]。
本研究在培养结束时2~5 μm异养型原生生物在沙尘组所占比例超过40%,成为所在该粒径级的优势类群,表明沙沉降对异养原生生物,特别是对小型异养原生生物群落的影响更加持久。异养型微型浮游原生生物摄食细菌、蓝藻和更小的自养型原生生物[6~8],通过选择性摄食的调控作用对微型浮游生物的群落结构产生巨大的影响,而它自身也是小型、中型浮游动物的食物来源[36-39],并作为食物网底部微生物往更高营养水平流动的通道[40-41],在决定初级生产的物质能量流动上发挥着巨大作用。
兼养型原生生物是指在一个生物体内同时具有自养和异养能力的原生生物,在浮游原生生物中广泛存在[4-5],本研究在培养结束时10~20和5~10 μm兼养型原生生物分别在LP和LD组的比例有明显增加,2~5 μm兼养型原生生物在P添加组占比超过50%,为所在该粒径级的绝对优势类群,表明P对小型兼养型原生生物群落的影响更加持久。
有研究报道海洋中5~20 μm 的鞭毛虫摄食体型大于1 μm的生物[26],因此本研究如果考虑上两个营养级异养原生生物数量增加导致的捕食压力增大,沙尘和P添加对2~5 μm异养和兼养型原生生物生长的促进作用可能更强。原生生物不同粒径级和营养结构的改变对原生生物的摄食能力、摄食过程中所释放的DOC及其化学组和对营养盐的吸收转化效率都将产生显著影响,最终影响原生生物在该海区物质转化和食物产出中的生态功能,将直接影响海洋碳循环及碳库来源[41]。
4 结论
(1)该海区各营养类型的浮游原生生物生长均受P 的限制,P的添加会促进各营养类型浮游原生生物的生长,特别是培养早期对自养型原生生物的促进作用最为显著。
(2)沙尘在培养早期对自养型为促进作用,对异养和兼养型为抑制作用;沙尘对10~20 μm自养原生生物生长速率促进作用最强,对5~10 μm异养原生生物和10~20 μm兼养型原生生物生长速率抑制作用最强。沙尘对原生生物生长的促进作用可能与沙尘中P 的溶出有关。
(3)沙沉在培养后期对自养型原生生物的生长为抑制作用,对异养和兼养型为促进制作用,其作用强度为异养>兼养型,对小粒径的异养和兼养型原生生物生长速率促进作用最强,影响也更加持久。沙尘对不同粒径级和营养类型浮游原生生物生长速率的影响,会改变黄海南部海区微型食物网的结构,进而对该海区微食物环在物质转化和食物产出中的生态功能产生影响。

