包包曲及制曲环境中可培养霉菌的分离与鉴定
雷学俊,张 霞,刘多涛,李 智,罗青春,施 思,郑 佳
(宜宾五粮液股份有限公司技术研究中心,四川宜宾 644007)
大曲作为一种多酶多菌的微生态制品,在传统固态发酵白酒酿造过程中主要起提供菌源、糖化发酵、投粮作用和生香作用,又可称之为白酒发酵的原动力[1]。大曲的微生物主要包括霉菌、酵母菌、细菌、放线菌等四大类,其中霉菌是很重要的一类,其复杂而丰富的种类和数量赋予了大曲糖化、液化、蛋白分解等各种水解能力及酯化能力[2-3]。
五粮液包包曲是以其独特的外形而命名,这种形状独特的包包曲造型使它接触空气的比表面积比一般大曲大,更有利于生产过程中自然有益微生物的繁殖、代谢,特别是霉菌微生物[4]。包包曲作为五粮液酿造过程中的糖化发酵剂,在不同温度下形成不同的菌系、酶系,有利于酯化、生香和香味物质的积累[5]。
多年来,关于大曲中霉菌的研究主要是利用传统的形态和生理生化等经典微生物学技术结合现代分子生物学技术进行霉菌的分类、优势菌及功能性霉菌的分离鉴定等,有效地诠释了大曲中霉菌的多样性,为白酒的个性化和品质提升提供了理论依据。如张霞等[6]采用18S rRNA序列分析结合传统分离鉴定法从贵州某知名酒厂的大曲中分离出归属于5个属即曲霉属(Aspergillus)、犁头霉属(Absidia)、假埃希氏菌属(Pseudallescheria)、茎点霉属(Phoma)、拟青霉属(Paecilomyces)等104株丝状霉菌,并确定MJ-10为烟曲霉(Aspergillus fumigatus),MJ-11为伞枝犁头霉(Absidia corymbifera)。苏畅等[7]通过ITS4/5 rRNA区序列进行分析比对,分离鉴定出红曲(Aspergillus ruber)、米根霉(Rhizopus oryzae)、微小根毛霉(Rhizomucor pusillus)、烟曲霉(Aspergillus fumigatus)、嗜热子囊菌(Thermomyces lanuginosus)、谢瓦氏曲霉(Aspergillus salwaensis)、米曲霉(Aspergillus oryzae)等13个种属霉菌。方程等[8]通过高通量测序结合纯培养的方法从高温大曲中分离得到50株丝状真菌,分别隶属于Aspergillus、Monascus、Byssochlamys、Lichtheimia、Rhizomucor、Mucor、Arthrinium、Alternaria、Thermomyces和Rasamsonia等10个属,并标明这些丝状真菌具有强大的次级代谢产物合成潜力。
本研究采用传统的形态学和分子生物学的鉴定手段对五粮液包包曲中主要霉菌进行分离和鉴定,以此初步探讨包包曲中霉菌的组成和系统发育情况,为保护包包曲中丰富的霉菌资源打下坚实基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品来源
包包曲取自宜宾五粮液股份有限公司制曲车间,对曲房环境微生物及生产过程中0 d、3 d、5 d、9 d、30 d的包包曲进行采集。
1.1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基、察氏琼脂(CDA)培养基、孟加拉红培养基。
1.1.3 仪器设备
电热压力蒸汽灭菌锅,上海申安医疗器械公司;生化培养箱(LRH),上海一恒科技仪器有限公司;电子天平(AL204),梅特勒-托利多仪器上海有限公司。
1.2 霉菌的分离与鉴定
1.2.1 分离纯化
将包包曲磨碎混匀后取10 g加入到90 mL无菌生理盐水中充分振荡混匀后,取上清菌悬液1 mL到装有9 mL无菌水的试管中,采用10倍梯度稀释涂布法进行分离,选取10-3、10-4、10-5、10-64个梯度涂布平板,28 ℃培养箱中培养3 d,挑取明显特征不同的单菌落进行划线纯化分离,然后将其接种于试管斜面,置于4 ℃保藏备用。
曲房环境微生物的采集方法:将制备好的平板置于房间四个角落位置,每个位置放置3个平板。打开平板盖,放置5 min,利用空气沉降法收集微生物,然后盖上平板盖,置于28 ℃培养箱中培养3 d,挑取明显特征不同的单菌落进行划线纯化分离,然后将其接种于试管斜面,置于4 ℃保藏备用。
1.2.2 菌株鉴定和归类
1.2.2.1 菌株形态学鉴定
按照《微生物学实验手册》[9]和《真菌鉴定手册》[10]等将所有分离到的菌株进行初步分类。然后使用乳酸石碳酸棉兰染色液染色,镜检,记录观察目的菌株的形态特征。
1.2.2.2 菌株分子生物学鉴定
DNA提取:取纯菌的菌体富集液5000 r/min离心10 min,弃上清液,收集菌体,采用SK8259(真菌)试剂盒操作进行霉菌基因组DNA的提取。
PCR扩增:采用真菌通用引物为NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGGTTCACCTACGGA-3'),PCR反应体系包括0.5 μL的 基 因 组DNA、2.5 μL的5×Buffer(含Mg2+)、1 μL的dNTP、0.2 μL的聚合酶、0.5 μL的引物、0.5μL模板,加双蒸水至25 μL,PCR循环条件为95 ℃、3 min预变性、94 ℃、30 s变性、55 ℃、25 s退火、72 ℃、1 min延伸、循环35次,72 ℃、5 min修复延伸,4 ℃终止反应。经PCR反应扩增出18S rRNA产物,用PCR及酶反应产物纯化试剂盒将PCR产物进行纯化,将纯化产物交由上海生工生物工程股份有限公司完成测序的后续工作。
1.3 霉菌的系统发育分析
依据参考文献[11],将测得的18S rRNA序列在NCBI中进行BLAST比对,得到的同源序列和测定序列在Clustal X软件包中进行分析,形成一个多重序列匹配排列阵导入MEGA5.0软件,采用邻位相连(Neighbor-Jioning)法构建系统发育树。
2 结果与分析
2.1 包包曲中可培养霉菌的分离
采用稀释平板法从包包曲培养过程的曲样中分离纯化得到18株霉菌,依据其孢子结构、菌落形态与颜色等将18株菌初步鉴定为A—I9大类群。
霉菌的形态学鉴定包括霉菌的菌落特征和菌体孢子形态结构。初步归类的9大类群的菌体具体菌落特征及孢子形态特征如图1所示。
18株霉菌经初步归类为9大类群的具体形态特征描述如表1所示。
2.2 18S rRNA的PCR产物纯化结果(图2)
由图2可知,已分离霉菌的18S rRNA的分子大小基本上都在1300 bp左右且亮度较高,说明扩增的片段与引物对的理论长度基本一致,且产物浓度适合后续测序。

图1 代表性霉菌的菌落结构图

表1 包包曲中分离到的霉菌
图2 包包曲中部分霉菌18S rRNA的PCR纯化片段电泳图
2.3 包包曲中霉菌物种的18S rRNA分子鉴定
本研究选取不同时期包包曲样本来研究包包曲中可培养霉菌的物种多样性。根据不同类型的霉菌对其生长繁殖时需求的营养物质可能不同,本研究采用3种不同类型的培养基进行筛选和分离,其目的就是尽可能多的获得霉菌物种。在筛选过程中,对于具有相似形态和生长特征的霉菌,仅保留1株。最后共筛选分离得到19株霉菌。进一步根据形态和培养特征,选取A类群菌株4株,B类群菌株3株,C、D、E、G、H类群菌株各1株,F类群菌株2株,I类群菌株4株共计18株。菌株的18S rRNA序列在NCBI中用BLAST进行同源性分析,结果发现用传统的菌株鉴定方法可鉴定出有差异的菌株,这9个类群又归为9个大类群,其同源性分析结果见表2。各类群(代表菌株)编号分别为A(A1、A2)、B(B1、B2)、C、D、E、F、G、H(H1、H2)、I。
从表2可以看出,19株分离菌株大部分与已报道的菌株具有99 %以上的相似度,表明这些已分离菌株都已经在NCBI中找到相似度非常高的菌株。不仅如此,B1菌株与米曲霉(Aspergillus oryzae)的相似度达到了100%,G1菌株与单孢根霉菌(Rhizopus azygosporus)的相似度达到了100 %,说明菌株B1和菌株G1已经鉴定到了种。
2.4 包包曲中霉菌物种的系统发育树分析
这9个类群中每一类群代表菌株的18S rRNA序列和用BLAST检索到的与之有高度同源性菌株的18S rRNA序列,通过Clustal X软件和MEGA5.0软件构建N-J系统发育树,结果见图3。可通过系统发育树的建立对包包曲中分离出的不同类型的霉菌的种间亲缘关系进行了直观界定。
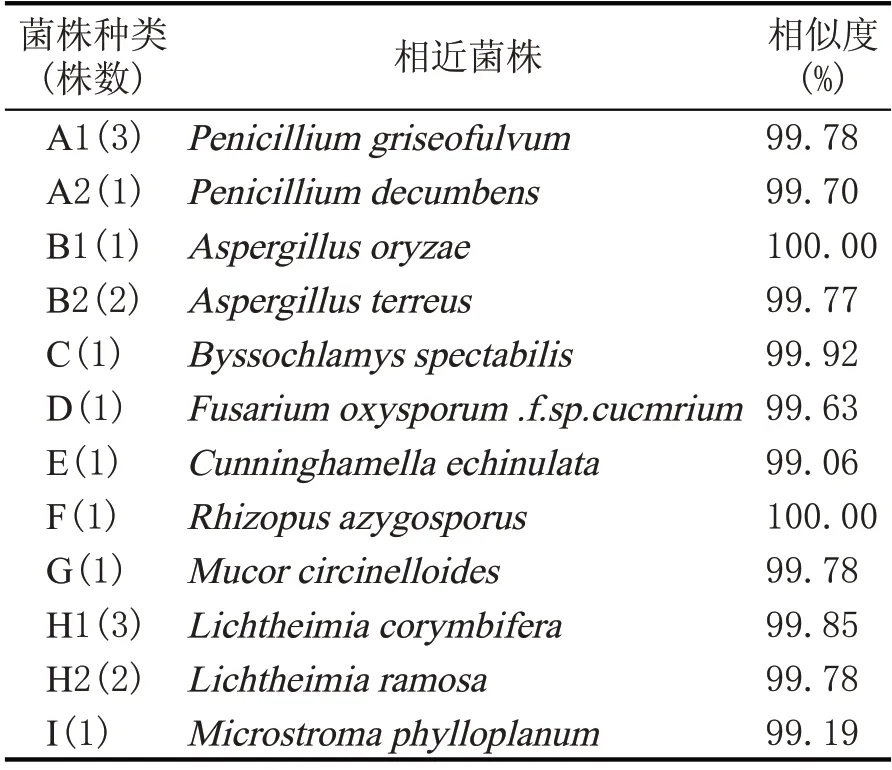
表2 各类群代表菌株18S rRNA的同源性分析结果
在图3的系统发育树中,包包曲分离得到的霉菌菌株的类别较为丰富,分别为青霉属(Penicillium)、曲霉属(Aspergillus)、丝衣霉菌属(Byssochlamys)、横梗霉属(Lichtheimia)、毛霉属(Mucor)、尖镰孢菌属(Fusarium oxysporum)、刺孢小克银汉霉(Cunninghamella echinulata)、根霉属(Rhizopus)和Microstroma等9个已知霉菌属,它们相互之间的亲缘关系较远,表明包包曲中的霉菌有着很高的遗传多样性和种属多样性。
其中A1、A2等4株菌株聚为一支,且与灰黄青霉(Penicillium griseofulvum)、斜卧青霉(Penicillium decumbens)遗传关系较近。B1、B2等3株菌株聚为一支,且分别与溜曲霉(Aspergillus tamarii)、米曲霉(Aspergillus oryzae)、土曲霉(Aspergillus terreus)聚在一起。H1、H2等5株菌株聚为一支,分别与伞状横梗霉(Lichtheimia corymbifera)、分枝横梗霉(Lichtheimia ramosa)遗传关系相近。菌株C、D、E、F、G、I分别与丝衣霉属(Byssochlamy.sp)、尖镰孢菌(Fusarium oxysporum .f.sp.cucmrium)、白地霉(Galactomyces candidum)、刺孢小克银汉霉(Cunninghamella echinulata)、小单孢根霉菌(Rhizopus microsporus)、卷枝毛霉(Mucor circinelloides)和Microstroma phylloplanum各单独聚为一支。
基于以上结果说明,基于可培养的方法在目前微生物群落研究中仍然发挥着不可替代的作用。
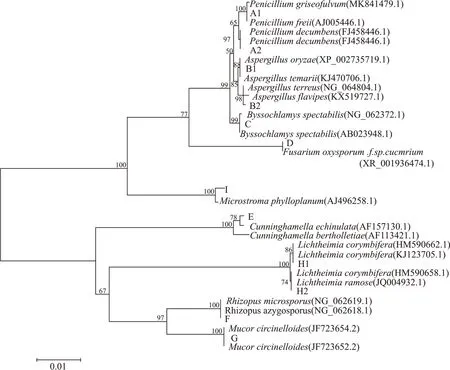
图3 基于18S rRNA全序列为基础的包包曲中霉菌的系统发育树
3 结论
五粮液和泸州老窖作为浓香型白酒的典型代表,酿造生产均是大曲。五粮液酿造生产用曲为包包曲,属于中温偏高温曲,是以纯小麦为原料,生料制曲,自然接种,皮薄心厚,浓香纯正,发酵周期短,顶温中温偏高温,最高温可达63 ℃;而泸州老窖酿造生产用曲为中高温大曲,是以纯小麦和高粱为原料,制曲最高温达到65 ℃。原料与温度等不同造就大曲中微生物种类存在较大差异[12]。研究者们针对不同区域的中高温大曲的微生物群落结构研究表明[13],霉菌尤其是根霉是曲块侧面和曲包表层的优势类群,曲心的优势菌群主要是芽孢杆菌,曲块底面主要是青霉和犁头霉,而黄曲霉、红曲霉在曲块各部位均存在。王彩虹等[14]采用ITS基因文库法分析得到泸州老窖中高温大曲的优势霉菌群落为扫帚状曲霉、米根霉、微小根毛霉等曲霉属和根霉属。姚万春等[13]从泸州老窖国窖曲中分离的霉菌有根霉、毛霉、梨头霉、黄曲霉、青霉和红曲霉等6类霉菌。本次研究的包包曲分离鉴定出刺孢小克银汉霉、尖镰孢菌属、丝衣霉菌属和Microstroma属等种类,极大地丰富了中高温大曲中霉菌属种类。
大曲中糖化酶和液化酶活力的高低与大曲中微生物尤其是霉菌的生长繁殖有关[15],而糖化力和酯液化力是衡量大曲质量好坏的重要指标。赵东等[16]揭示了五粮液包包曲发酵过程中微生物区系的变化与其理化因子在演变过程中的关系,为提高包包曲质量提供理论依据。故系统全面研究大曲中优势霉菌种类有助于提高大曲质量,进而提高出酒率。
本研究中,采用了PDA培养基、CDA培养基、孟加拉红培养基3种培养基对五粮液包包曲中的霉菌微生物进行稀释分离,并对获得的纯培养菌种进行了分子生物学鉴定与系统发育学分析。研究结果表明,浓香型包包曲内存在大量青霉属、曲霉属、毛霉属、根霉属、横梗霉属、刺孢小克银汉霉、尖镰孢菌属、丝衣霉菌属等主要霉菌类群,极大的丰富了对浓香型包包曲中霉菌菌株的认识。此外采用18S rRNA全序列进行霉菌的分子鉴定可将大多数的霉菌鉴定到属。

