饲养方式对苏尼特羊肉挥发性风味成分和脂肪酸组成的影响
李文博,罗玉龙,刘 畅,窦 露,赵丽华,苏 琳,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
苏尼特羊身体结构均匀,肉层厚实紧凑,具有良好的营养特性和食用品质[1]。香味是较为重要的品质,由各种有机小分子挥发性物质共同形成,主要包括醛、醇、酮、酯、酸、烃、吡嗪、呋喃、萜、含氮和硫类化合物等[2]。针对苏尼特羊的风味品质,罗玉龙等[3]分析了不同部位肌肉中的挥发性风味物质,确定背最长肌具有良好风味,代表性风味物质有己醛、壬醛、1-辛烯-3-醇和2,3-辛二酮等。目前国家禁牧政策的施行,苏尼特羊由传统的放牧饲养方半放牧甚至圈养转变。研究表明,饲养方式对羊肉的风味有较大影响,王朕朕[4]研究了限时放牧对滩羊风味沉积的影响,发现放牧羊肌肉中的风味前体物质多不饱和脂肪酸含量较高,使风味物质的沉积更加多元化,有更好的风味品质。钱文熙[5]对比了不同饲养方式下滩羊风味前体物质的差异,实验结果表明放牧羊的膻味比舍饲羊重,原因是放牧羊中脂肪酸含量较高;但针对饲养方式对苏尼特羊风味影响的研究还相对较少。本研究选择气相色谱-质谱联用技术检测不同饲养方式的苏尼特羊挥发性风味物质和脂肪酸组成,对比不同饲养方式下苏尼特羊肉风味物质的差异,分析脂肪酸组成对风味特性的影响,确定饲养方式对羊肉风味的影响及原因,为今后肉品风味研究和优化提供理论依据。
1 材料与方法
1.1 材料与试剂
从内蒙古乌拉特中旗苏尼特羊育种园区随机选择放牧和圈养2 种饲养条件下发育正常,健康无病,公、母各占一半的12 月龄苏尼特羊各12 只。放牧组主要以乌拉特中旗荒漠化草原的牧草为食(芨芨草、蒙古葱、沙生冰草和碱韭等),舍饲组则以农区草料为主食(玉米秸秆、葵盘粉等,并补充玉米精饲料和育肥料)。24 只苏尼特羊经宰前停饲24 h,致晕后屠宰,取背最长肌肉约50 g,置于-20 ℃冰箱冷藏待用。
三氯甲烷、氯化钠、氢氧化钠、三氟化硼-乙醚络合物、无水硫酸钠(均为分析纯),甲醇、正己烷(均为色谱纯),37 种脂肪酸甲酯混合标准品 美国Sigma公司;RNAiso Plus、6×loading buffer、Marker DL 2000、Premix Taq®Version 2.0、Preme ScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM大连宝生物工程有限公司。
1.2 仪器与设备
气相色谱-质谱联用仪、手动式固相微萃取手柄美国赛默飞世尔科技公司;固相微萃取头 美国Supelco公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;5810R台式低温冷冻离心机 德国Eppendorf公司;BG-power5000稳压稳流电泳仪 北京百晶生物科技有限公司;水平电泳槽、凝胶成像分析仪、CFX96TM实时聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司。
1.3 方法
1.3.1 挥发性风味物质的测定
1.3.1.1 挥发性物质的萃取
取解冻后的肉样,切除筋膜,剁成肉糜,准确称取5 g置于20 mL样品瓶中,拧紧瓶盖,放入60 ℃水浴锅中,插入老化后的萃取头,吸附40 min后取出,直接插入气相色谱-质谱联用仪进样口,在250 ℃条件下解吸3 min。
1.3.1.2 气相色谱-质谱测定条件
气相色谱条件:DB-5色谱柱(30 m×0.25 mm,0.25 μm);载气为氦气,流速1.0 mL/min;进样口与接口温度为250 ℃;不分流进样。程序升温条件:起始温度为40 ℃,以4 ℃/min的速率升温至150 ℃,持续3 min;以5 ℃/min的速率升温至200 ℃,保持1 min;以20 ℃/min的速率升温到230 ℃,时间5 min。
质谱条件:电子电离源;电离电压70 eV;离子源温度250 ℃;传输线温度250 ℃;质量扫描范围m/z 30~400;溶剂延迟时间1 min。
1.3.1.3 定性与定量分析
将总离子流色谱图中的每个峰与NIST、Wiley和Menalib数据库中已知物质的质谱数据进行检索定性,以匹配度大于800为鉴定依据。物质的定量用峰面积代替,并除以样品质量,单位为AU/g。
1.3.2 脂肪酸成分的测定
1.3.2.1 脂肪酸成分的提取
参考Folch等[6]的方法并进行适当调整。取解冻的肉样,切除筋膜后剁碎,称取5 g置于三角瓶中,加入CH3OH-CHCl3混合溶液(1∶2,V/V),加热搅拌2 h,过夜后经G3漏斗过滤,滤液与5 mL 2% NaCl溶液充分混合,待静置分层,取底层液体加入适量Na2SO4溶液,浓缩蒸发得到粗脂肪,并进行脂肪皂化(粗脂肪加入5 mL 2% CH3OH-NaOH溶液,70 ℃水浴5 min)和甲酯化(皂化后的样品加入3 mL BF3-C4H10O溶液,70 ℃水浴2 min),随后与2 mL正己烷溶液混合,70 ℃水浴1 min,再滴加5 mL饱和NaCl溶液,静置10 min,最后加入适量Na2SO4溶液,经有机系滤膜过滤后置于样品瓶中,上机测定。
1.3.2.2 气相色谱-质谱测定条件
气相色谱条件:Rt-2560石英毛细管柱色谱柱(100 m×0.25 mm,0.20 μm);程序升温条件:以30 ℃/min的速度从60 ℃升至120 ℃,稳定5 min;再以5 ℃/min的速率升至250 ℃,稳定25 min。
氦气载气流速1.1 mL/min,分流比为20∶1,进样口和检测器温度分别为250 ℃和280 ℃,进样量1 μL。
质谱条件:电子电离源;电离能量70 eV;离子源温度280 ℃;传输线温度250 ℃;质量扫描范围m/z30~500;溶剂延迟时间4 min。
1.3.2.3 定性与定量分析
将色谱图中的每个峰与NIST、Wiley和Menalib数据库中已知物质进行对比检索,同时结合脂肪酸标准品的出峰时间与含量进一步筛选定性。脂肪酸定量同风味物质定量方法。
1.3.3 基因表达量的测定
1.3.3.1 引物与探针设计
脂肪氧合酶基因(lipoxygenase,LOX)、过氧化物酶体增殖物激活受体γ基因(peroxisome proliferatoractivated receptorγ,PPARγ)、乙酰辅酶A羧化酶基因(acetyl-CoA carboxylase,ACC)、18S rRNA引物序列由上海生工生物工程有限公司设计与合成,序列见表1,管家基因为18S rRNA。
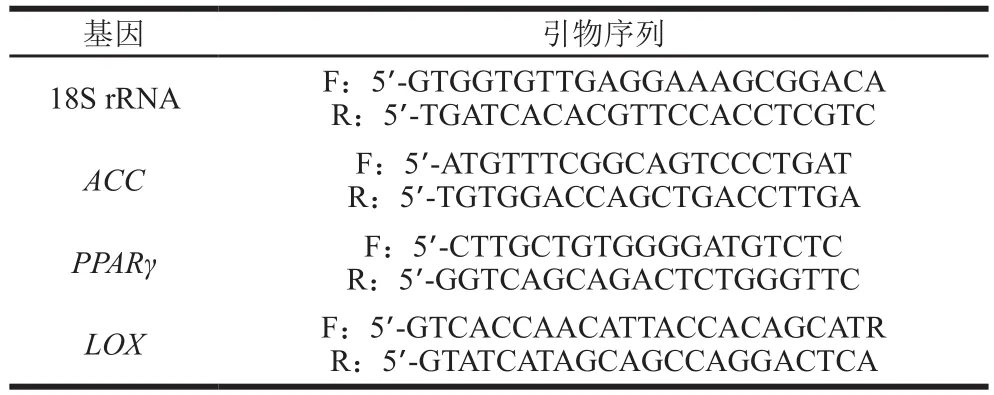
表1 实时荧光定量引物Table 1 Primers used for quantitative real-time PCR
1.3.3.2 总RNA的提取与反转录
参照王乐[7]的方法提取后,分别在260、280 nm波长处测定吸光度和浓度,而后用1%琼脂糖凝胶电泳检测RNA的质量,随后将其稀释至500 ng/μL,再按照试剂盒(Preme ScriptTMRT reagent Kit with gDNA Eraser)的方法将提取的RNA反转录为cDNA,并存放于-20 ℃冰箱,待用。
1.3.3.3 实时荧光定量PCR
PCR定量方法使用CFX96TMReal-Time PCR Detection System的二步法,选择cDNA作为模板,SYBR为荧光定量染料[8]。25.0 μL反应体系为:SYBR®Premix ExTaqTMII (TLi RNaseH Plus)12.5 μL,F引物1.0 μL,R引物1.0 μL,cDNA 2.0 μL,无酶水(RNase Free dH2O)8.5 μL。反应条件为:95 ℃、30 s预变性;95 ℃、5 s变性;60 ℃、30 s退火;72 ℃、30 s延伸,此过程循环35 次;72 ℃、10 min延伸。
1.4 数据处理
采用SPSS 22.0软件方差分析,采用Excel软件进行图表绘制。
2 结果与分析
2.1 饲养方式对苏尼特羊肉风味成分的影响
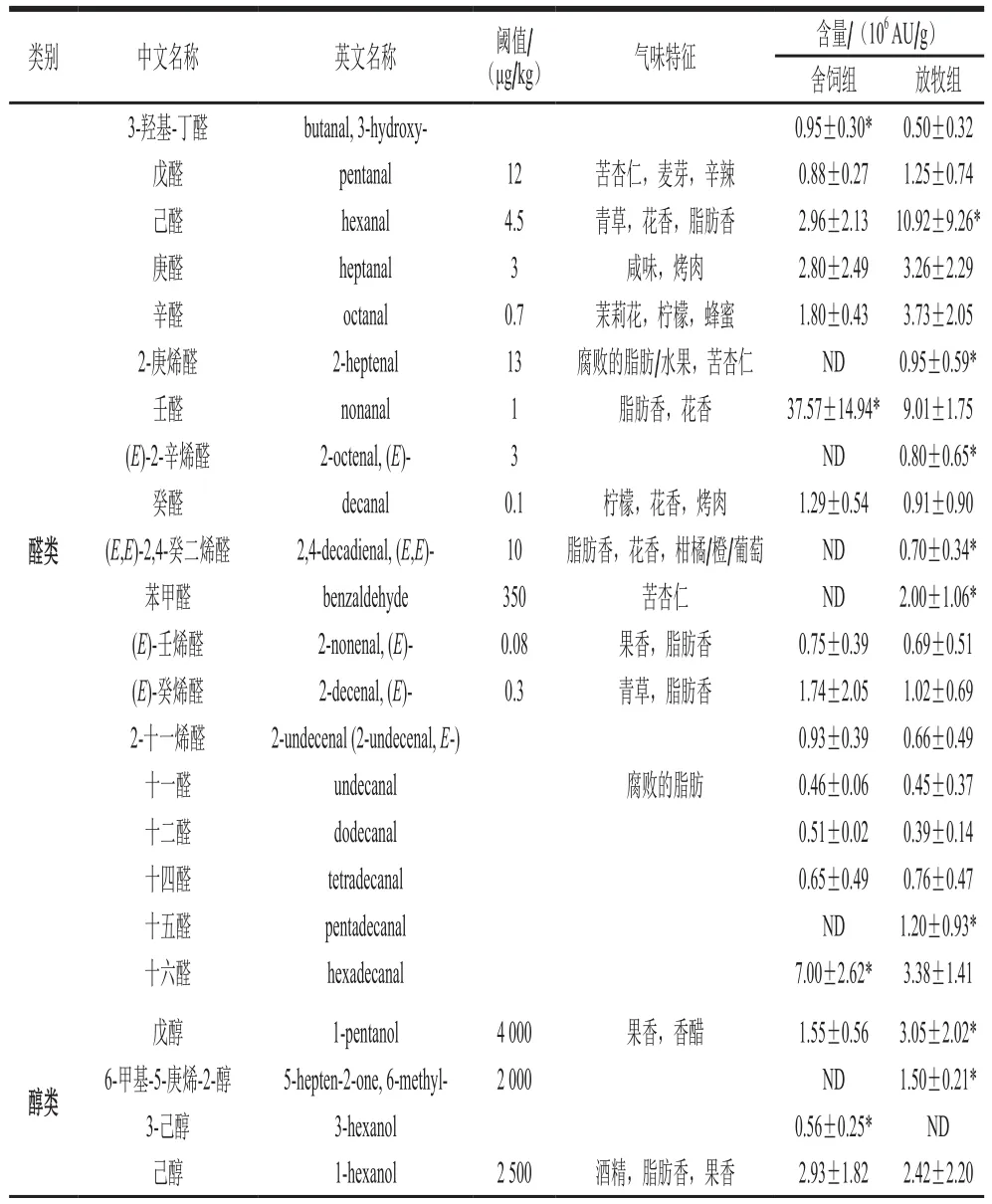
表2 饲养方式对苏尼特羊肉中挥发性成分的影响(n=12)Table 2 Effects of different feeding methods on volatile components in Sunit sheep meat (n= 12)

续表2
由表2可知,放牧和舍饲羊分别检测出42 种和29 种挥发性成分,其中放牧羊中检测出醛类物质19 种、醇类物质11 种、酮类物质4 种、酸类物质2 种、烃类物质4 种以及其他类物质2 种;舍饲条件下的苏尼特羊中,检测出醛类14 种、醇类8 种、酮类1 种、酸类2 种、烃类2 种以及其他类物质2 种。
醛类物质是挥发性风味成分中最主要的物质,大部分来自脂肪的氧化水解,极少部分来自糖类的美拉德反应[9]。由表2可知,不同饲养方式的苏尼特羊中检测到的醛类物质种类和含量最高,舍饲组检测到14 种化合物,而放牧组中则检测到了19 种,醛类化合物的丰富性造成了放牧与舍饲羊肉风味的差异,赋予了放牧羊肉较好的风味特性;对比2 组羊肉醛类物质的总含量,发现舍饲羊肉高于放牧羊肉,这可能与脂肪氧化有关,有研究表明,舍饲苏尼特羊的脂质氧化程度高于放牧羊[10],而脂肪氧化过多会导致肉发生劣变,对品质有消极影响[11]。羊肉的风味是通过挥发性物质协同产生的,实验中检测到的饱和醛占醛类物质较大比重,大部分饱和醛在放牧苏尼特羊肉中的含量均高于在舍饲羊肉中的含量,其中,放牧条件下的苏尼特羊肉中己醛含量显著高于舍饲羊肉(P<0.05),十五醛含量显著高于舍饲羊肉(P<0.05);而舍饲羊肉中的壬醛和十六醛含量均显著高于放牧羊肉(P<0.05)。不饱和醛中,3-羟基-丁醛在舍饲羊肉中的含量显著高于放牧羊肉(P<0.05);而放牧羊肉中2-庚烯醛含量显著高于舍饲羊肉(P<0.05),(E,E)-2,4-癸二烯醛和(E)-2-辛烯醛含量显著高于舍饲条件下的羊肉(P<0.05)。苯甲醛是实验中检测到的芳香醛,具有苦杏仁味,对风味有消极影响,其在放牧羊肉中的含量显著高于舍饲羊(P<0.05)。醛类物质阈值较低,大多具有脂肪香味,对羊肉风味有较大影响[12]。壬醛和己醛含量较高并且阈值较低,在本实验中被认为是较为主要的挥发性风味成分,其中己醛还可以作为反映脂肪氧化程度的指标,浓度较低时,可以赋予肉品青草香和花香,当浓度过高时,则会让肉品有腐臭的味道[13-14]。总体来说,放牧组羊肉的醛类挥发性化合物含量低于舍饲羊肉,可能与运动和牧草中的抗氧化物有关,使得放牧羊肉中醛类物质对风味带来的消极影响较低。
醇类主要由肌肉中的共轭亚油酸被脂肪氧合酶和氢过氧化酶降解产生[15]。实验中检测到的己醇、1-辛烯-3-醇、庚醇和辛醇含量较高,对羊肉风味有累积加成作用。饱和醇中,舍饲羊肉中的庚醇含量显著高于放牧羊(P<0.05),辛醇和己醇的含量也都高于放牧羊(P>0.05)。不饱和醇中,低阈值的1-辛烯-3-醇在放牧羊中的含量显著高于舍饲羊(P<0.05),除此之外,放牧羊肉中还检测到2-癸烯-1-醇、2-辛烯-3-醇、6-甲基-5-庚烯-2-醇和2-辛烯醇,不饱和醇的阈值较低,并且具有蘑菇香味,对风味有较大贡献作用[16]。醇类物质在放牧羊肉中的种类较多且含量较高,赋予了放牧羊肉较好的风味特性。
酮类是脂质氧化和水解的另一产物,大多具有奶油香或水果香味,对肉品风味有积极作用[17]。在舍饲苏尼特羊肉中检测到1 种酮类物质,放牧羊中检测到4 种,其中2,3-辛二酮含量较高,有研究表明,喂食牧草的反刍动物肌肉中会存在较多该物质,这与本实验的结果一致[18]。
短链脂肪酸中的直链羧酸主要来自不饱和脂肪酸的水解,带有支链的羧酸大多由相应的醛衍生而成[19]。短链脂肪酸在羊肉中的含量较低,但对羊肉特征风味(膻味)的影响较大[20]。实验中检测到3 种酸类,6-壬烯酸和3-羟基月桂酸在舍饲羊中的含量比放牧羊高;壬酸含量较低,只在放牧羊中被检测到。总体看,舍饲羊肉中的酸类物质含量比放牧羊肉中的高,可能会造成舍饲羊肉的膻味较重。
烃类物质是由脂肪酸的烷氧基均裂形成的,具有较高阈值,被认为对肉品风味的直接作用较低,但对整体风味有修饰作用[21]。由表2可知,实验中共检测出4 种烃类化合物,其中,放牧羊肉中的壬烷和甲苯含量显著高于舍饲羊肉(P<0.05);庚烷和对二甲苯的含量则无显著差异(P>0.05)。
经过含量与阈值的对比筛选,己醛、壬醛、1-辛烯-3-醇和2,3-辛二酮是苏尼特羊肉中主要的挥发性风味物质,这与本课题组之前的研究结果相近[3]。整体上,放牧羊肉的挥发性风味成分优于舍饲羊肉,可以说明放牧组的风味品质更好,分析原因是放牧羊有较大的运动量和摄入了富含脂肪酸、矿物质和抗氧化物的天然牧草,使得放牧羊有合理的脂肪酸分布和风味物质的沉积[22-23]。
2.2 饲养方式对苏尼特羊肉脂肪酸组成的影响

表3 饲养方式对苏尼特羊肉中脂肪酸含量的影响(n=12)Table 3 Effects of different feeding methods on fatty acid contents of Sunite sheep meat (n= 12)
如表3所示,放牧羊肉和舍饲羊肉中分别检测出23 种和22 种脂肪酸,其中放牧组检测出8 种饱和脂肪酸,6 种单不饱和脂肪酸,9 种多不饱和脂肪酸;舍饲组检测出7 种饱和脂肪酸,6 种单不饱和脂肪酸,9 种多不饱和脂肪酸。
由表3可知,饱和脂肪酸中,棕榈酸和硬脂酸占比较大,其中,放牧羊肉中硬脂酸的含量显著高于舍饲羊肉(P<0.05);棕榈酸含量在2 组中无显著差异。饱和脂肪酸因分子内不存在双键而比较稳定,不易被氧化,但不饱和脂肪酸因双键的存在容易受热氧化产生醛、酯、酮及烃类等具有风味特性的化合物,对肉品风味有较大影响[11]。在检测到的单不饱和脂肪酸中,油酸含量较高,在2 组中无显著差异;反式油酸在放牧羊肉中的含量显著高于舍饲羊肉(P<0.05),油酸和反式油酸可以有效降低人体血液中的胆固醇浓度,对人体健康有益[4]。多不饱和脂肪酸中,反式亚油酸在放牧羊肉中的含量高于舍饲羊肉(P<0.05),其有利于提高人体免疫力,对动脉粥硬化、心血管疾病等有抑制作用[24];花生三烯酸作为n-6必需脂肪酸,在放牧羊肉中的含量显著高于舍饲羊肉(P<0.05);二十二碳六烯酸是n-3多不饱和脂肪酸,凝血作用较好[25],其在放牧羊肉中的含量显著高于舍饲羊肉(P<0.05)。对比发现,饱和脂肪酸在苏尼特羊肉中占比较大,原因是反刍动物瘤胃中微生物多样性高,存在较多可以将不饱和脂肪酸转化为饱和脂肪酸的微生物[26]。综上所述,放牧羊中16 个碳原子以下不利于人体健康的脂肪酸含量较少,对人体有益的脂肪酸成分含量较高,脂肪酸组成优于舍饲羊,原因可能是长期摄入的牧草中富含不饱和脂肪酸,这些不饱和脂肪酸逐渐沉积到羊肉中,使羊肉有更高的营养价值[27]。
2.3 饲养方式对苏尼特羊肉脂肪代谢相关调控基因的影响
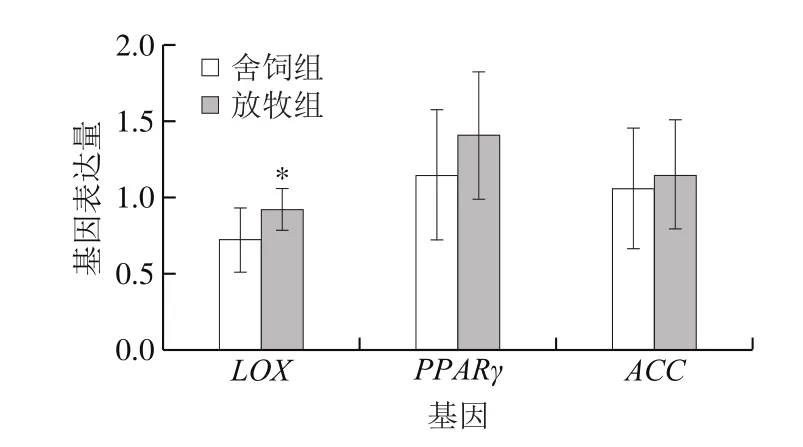
图1 饲养方式对苏尼特羊肉中脂肪代谢调控基因表达量的影响(n=12)Fig. 1 Effects of different feeding methods on the expression levels of lipid metabolism-related genes in Sunit sheep meat (n = 12)
大多数挥发性风味化合物都是通过脂质氧化和水解产生的,而脂肪氧化和水解受到多种酶和基因的调控。LOX可以催化不饱和脂肪酸氧化,进而生成一些醛酮类的小分子挥发性物质,影响肉品的风味[28]。由图1可知,LOX基因表达量在放牧羊肉中显著高于舍饲羊(P<0.05),原因可能是亚麻酸、亚油酸和花生四烯酸作为LOX参与脂肪氧化反应的主要底物[29],在放牧羊肉中的含量均高于舍饲羊肉,激活了LOX基因的表达。PPARγ基因在脂肪代谢中作为“调控者”,其通过激活脂肪酸氧化酶体系的表达,进而达到促进脂类代谢的作用[30],在放牧羊和舍饲羊中的表达量无显著差异,这与本课题组之前的研究结果相符[31]。2 组羊肉中的ACC基因表达量无显著差异,该基因主要参与脂肪酸合成,对脂肪酸合成的第1步反应起到限速作用,在脂肪组织中的表达量较高[32]。整体上,苏尼特羊肉中肌内脂肪较少,不足以造成PPARγ和ACC基因表达量的显著性差异,但是放牧羊中LOX基因的高表达,催化了羊肉中更多的脂肪酸发生氧化,生成较多风味物质,使其风味组成成分更加多样,赋予放牧羊肉较为丰富的风味,这与Yang Yang等[33]的研究结果一致。
2.4 脂肪酸与特征挥发性风味物质的相关性分析

表4 不同饲养方式下苏尼特羊肉中主要脂肪酸与特征挥发性风味物质相关性分析Table 4 Analysis of correlation between main fatty acids and characteristic volatile fl avor compounds of Sunit sheep meat in different feeding patterns
由表4可知,放牧苏尼特羊中己醛与花生四烯酸呈显著正相关(P<0.05),与反式亚油酸呈正相关性(0.804),舍饲组己醛与这2 种脂肪酸也均呈正相关,这与Elmore等[34]研究结果相符,即己醛主要是由共轭亚油酸和花生四烯酸氧化产成的。壬醛也是一种主要醛类物质,而不饱和脂肪酸的氧化可生成壬醛[12],在相关性分析中,放牧和舍饲组中的壬醛与不饱和脂肪酸均呈正相关,这与Song Shiqing等[35]的研究结果一致。主要醇类物质1-辛烯-3-醇在放牧羊中与花生四烯酸呈显著正相关(P<0.05),与反式亚油酸呈正相关(0.804),与舍饲羊肉呈现一致性,这说明1-辛烯-3-醇的产生主要由花生四烯酸和反式亚油酸的氧化水解引起,进一步验证了Elmore等[36]的研究。2,3-辛二酮被认为是动物饮食牧草的指示剂,它能由绿叶植物中特殊的脂氧合酶直接生成[37],饮食因素对其影响较大,这在一定程度上解释了舍饲羊中没有检测到2,3-辛二酮。
整体上,相关性分析结果验证了当脂肪酸含量升高时,肉中挥发性风味物质含量也随之增加,这反映了脂肪酸与挥发性风味物质关系密切,其中,不饱和脂肪酸含量也成为影响风味物质产生的主要因素。
3 结 论
放牧羊与舍饲羊中分别检测出42 种和29 种挥发性成分,以醛、醇、酮、酸和烃类化合物为主。己醛、壬醛、1-辛烯-3-醇和2,3-辛二酮是较为主要的风味物质,其中舍饲羊肉中的壬醛显著高于放牧羊肉,1-辛烯-3-醇和2,3-辛二酮含量显著低于放牧羊肉,总体来说,放牧羊肉的挥发性风味化合物种类较多并且有利成分含量较高,这可能赋予了其较好的风味品质。
在脂肪酸成分测定中,放牧组和舍饲组分别检测到23 种和22 种,并且放牧羊肉中硬脂酸、反式油酸、反式亚油酸和二十二碳六烯酸含量均显著高于舍饲羊肉,说明放牧羊肉的脂肪酸组成丰富,有益脂肪酸含量高,有更高的营养价值。
放牧羊中PPARγ和ACC基因表达量高于舍饲羊,说明放牧羊肉中肌内脂肪含量较高,解释了脂肪酸含量较高的实验结果;LOX基因表达量显著高于舍饲羊,同时结合脂肪酸与风味物质的相关性分析结果,即脂肪酸与风味成分均呈正相关,说明放牧羊肉经LOX基因的催化,使得较多的脂肪酸被氧化生成了挥发性物质,对羊肉风味品质产生影响。

