不同冬小麦品种拔节期抗冻性差异及相关基因表达分析
姚永伟,韩巧霞,张奥深,雍晓宇,高宏欢,刘素君,宋天启,王晨阳
(河南农业大学农学院,国家小麦工程技术研究中心,河南郑州 450002)
黄淮海小麦优势产区是我国最大的冬小麦产区,对确保我国的粮食安全具有重大的意义[1]。拔节期是小麦冬后生长的高峰期,生长发育迅速,对于水肥要求较高,是决定产量的一个重要阶段[2]。黄淮海地区时常出现低温灾害天气,主要分为冬、春季冻害。在春季,小麦进入幼穗分化的关键期,对温度的变化十分敏感,若此时突然发生大幅度的降温,将严重影响小麦产量,一般减产10%~30%,严重时减产幅度达到50%[3]。几乎每年的3-4月份,黄淮麦区都会出现2~5 d的大幅度降温天气,降温达6~10 ℃左右,有时甚至低于0 ℃,严重影响了小麦幼穗的正常发育,因此对小麦抗低温的特性研究十分重要[4-5]。
在同样发生倒春寒的地块,不同品种间受害程度差异显著。而对于引起这种差异的原因,主要有两种观点:第一种观点认为不同的品种发育进程不一致,生产上所谓的耐倒春寒,很可能是该类品种发育迟缓、拔节晚而避开了倒春寒发生时期,其本身并不具备耐倒春寒机制;第二种观点认为品种间抵御倒春寒的能力在遗传基础上存在差异,有些小麦品种在遭受倒春寒的危害后自我恢复能力很强,小麦的抗冻性在冬季和春季并不是显著相关,冬季抗冻力强的小麦品种在春季的抗冻性并不一定强[6]。低温逆境会使细胞发生一系列生理生化变化,如抗氧化物质增加、可溶性糖积累、组织含水量下降、膜流动性改变、新蛋白质的诱导合成、多种代谢酶的增加等[7]。本研究选取在河南推广面积较大且在前期田间调查中发现其在春季拔节期抗冻性存在明显差异的两个冬小麦品种百农207和郑麦366,盆栽种植至拔节期,通过人工气候室模拟低温处理,测定其生理指标,并通过荧光定量PCR(qRT-PCR)测定几个抗逆基因的表达量,分析两个小麦品种的抗冻性差异机理,以期为冬小麦倒春寒抗性鉴定及品种选择提供参考。
1 材料与方法
1.1 试验材料与设计
供试小麦材料为河南省推广面积较大的半冬性小麦品种百农207和郑麦366。试验在河南农业大学科教园区采用盆栽(26 cm×28 cm)方式进行。盆栽用土为大田0~30 cm 耕层壤质潮土,有机质含量17.8 g·kg-1,全氮含量0.99 g·kg-1,碱解氮含量57.9 mg·kg-1,速效磷含量67.5 mg·kg-1,速效钾含量204.8 mg·kg-1,pH值为7.94。测得田间持水量为 25.91%。每盆装过筛土7.5 kg,之后埋于大田,盆内土壤表面与盆外大田保持齐平。3叶期定苗,每盆15株,浇水量根据土壤墒情决定,每个盆栽保持一致。
小麦植株发育至拔节期(药隔形成初期)时在人工气候室内-5 ℃低温连续处理24 h,在低温处理0 h、6 h和24 h时取主茎最上部全展叶用于生理指标测定及基因表达分析。
1.2 仪器与试剂
定量仪器为QuantStudio 5 Real-Time PCR System, Thermo Fisher Scientific,RNA提取试剂盒RNAiso Plus、反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)和荧光定量试剂盒SYBR Premix Ex TaqⅡ均购自宝生物有限公司。
1.3 生理指标的测定
小麦叶片中MDA含量的测定采用硫代巴比妥酸法,脯氨酸含量测定采用茚三酮显色法,均设置3次生物学重复[8]。
1.4 基因表达分析
1.4.1 小麦叶片总RNA提取与cDNA第一链的合成
取小麦叶片0.1 g,用RNA提取试剂盒提取总RNA,用反转录试剂盒合成cDNA第一链。反转录体系和条件:第一步,总RNA 2.0 μL ,Oligo dT Primer(50 μM) 1 μL,DEPC 9.5 μL,反应条件42 ℃,2 min;第二步,第一步反应混合液 12.5 μL,5×PrimeScript II Buffer 4.0 μL,dNTP Mixture 2.0 μL,PrimeScript II RTase 1.0 μL,RNase Inhibitor 0.5 μL,反应条件37 ℃,15 min,85 ℃,5 s获得cDNA。
1.4.2 实时荧光定量PCR
以小麦Actin基因作为内参基因,通过NCBI(https://www.ncbi.nlm.nih.gov)搜索逆境相关基因序列,用Primer 5.0设计引物,由河南尚亚生物技术有限公司合成(表1)。定量PCR体系:SYBR Premix Ex TaqⅡ 12.5 μL,上游引物 0.75 μL,下游引物 0.75 μL,cDNA 2 μL,ddH2O补足20 μL。qRT-PCR反应条件:预变性95 ℃ for 30 s,变性95 ℃ for 5 s,退火/延伸60 ℃ for 45 s,40个循环。采取2-△△Ct法计算待测基因的相对表达量。
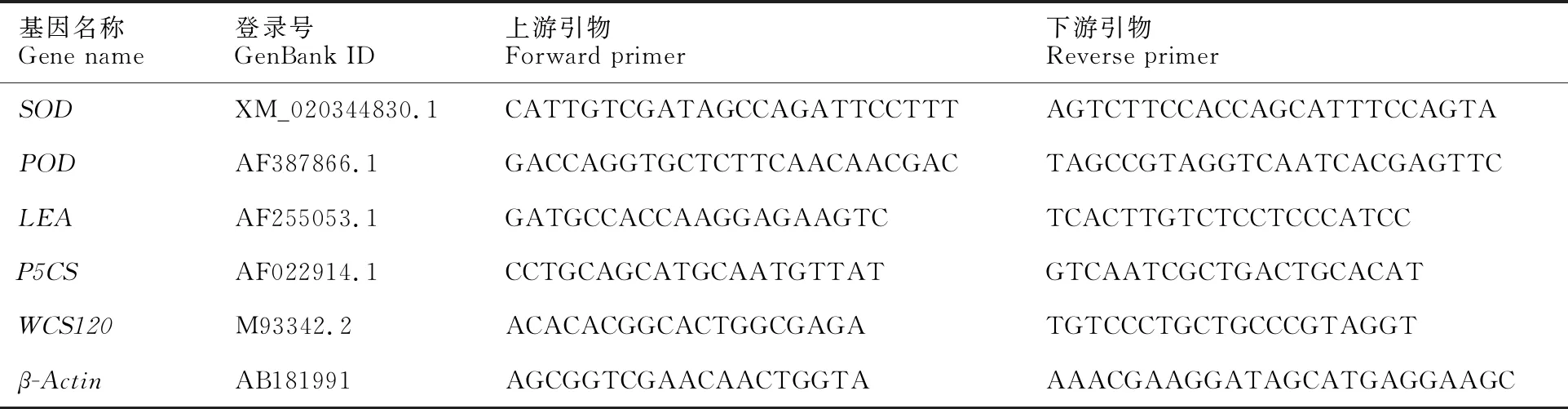
表1 实时荧光定量PCR引物信息
1.5 低温胁迫后幼穗受冻情况调查
低温胁迫处理后,将处理后的盆栽小麦放置在自然条件下自然恢复生长15 d后,调查幼穗的受冻死亡情况,按盆栽数量逐盆多次统计分析,取平均值,计算死亡率。
1.6 数据处理
数据统计分析采用Excel 2007和SPSS 22软件。
2 结果与分析
2.1 拔节期低温胁迫后小麦叶片丙二醛(MDA)含量的变化
由图1可见,低温处理(处理0 h)前两个品种的MDA含量差异不显著;低温处理6 h时百农207的MDA含量较低温处理前略降,郑麦366的MDA含量则显著升高。随着低温胁迫处理时间的延长,低温处理达到24 h时,两个小麦品种的MDA含量均较之前显著下降,且百农207的MDA含量显著低于郑麦366,说明此时百农207膜脂过氧化程度轻于郑麦366。
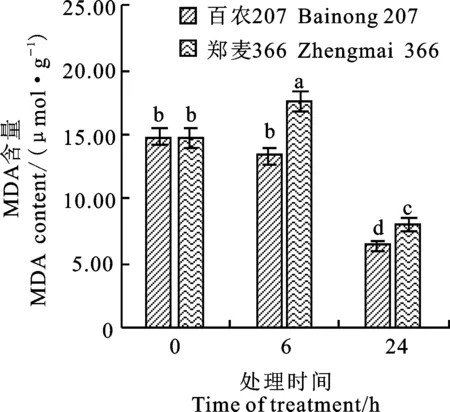
图柱上的字母不同表示处理间差异显著。下图同。
2.2 拔节期低温胁迫后小麦叶片游离脯氨酸(Pro)含量的变化
从图2可以看出,百农207和郑麦366叶片游离Pro含量分别在在低温6和24 h时开始出现下降,整个试验期间两个品种的游离Pro平均含量分别为95.09和66.15 μg·g-1。三个测定时间点百农207叶片的Pro含量均显著高于郑麦366。
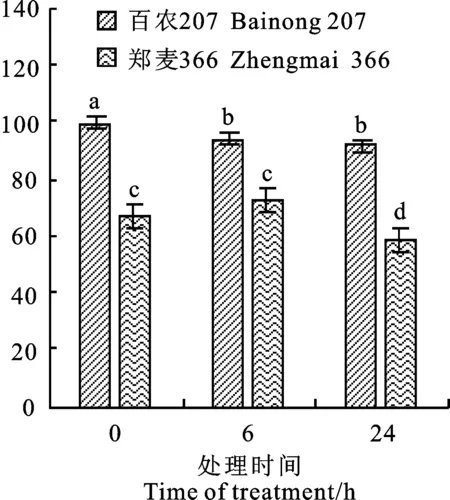
图2 不同时间低温处理下小麦叶片的脯氨酸含量
2.3 拔节期低温胁迫后小麦抗逆相关基因表达的变化
在低温处理过程中,百农207叶片中SOD、POD、WCS120、P5CS、LEA相对表达量(图3A-E)均较低温处理前显著增加;而郑麦366在低温处理6 h时SOD的表达量(图3A)较低温处理前无显著变化,其余基因表达量均显著下降。在低温处理24 h时,百农207的SOD基因表达量较低温处理6 h时显著下降,POD表达量变化不显著(图3B),WCS120、P5CS、LEA表达量(图3C、D、E)都较低温处理6 h时显著升高,在低温处理24 h时这5个基因的表达量都较低温处理前显著升高。郑麦366在低温处理24 h时SOD、P5CS、LEA、POD表达量都较低温处理6 h时显著下降,WCS120无显著变化,5个基因的表达量在低温处理24 h时都较低温处理前均显著下降。百农207的5个基因表达量在低温处理前都显著低于郑麦366。百农207叶片中SOD在低温处理24 h时与郑麦366表达量无显著差异,其余基因均显著高于郑麦366。
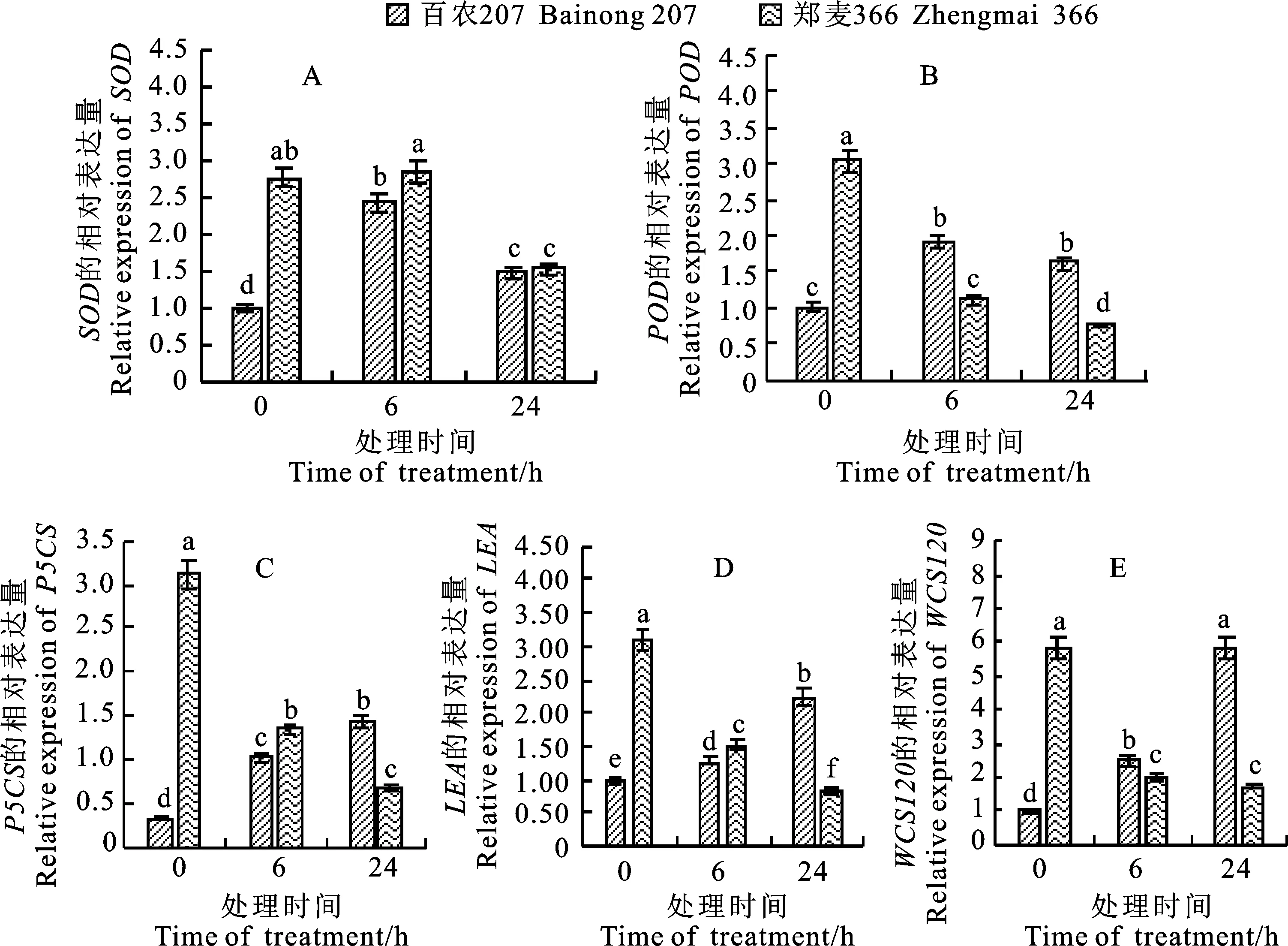
图3 不同时间低温处理下小麦叶片抗逆相关基因的相对表达量
2.4 小麦拔节期低温处理后幼穗受冻情况
调查结果表明,-5 ℃低温胁迫24 h后,百农207和郑麦366的幼穗受冻率分别达到 72.30%和90.62%,说明拔节期百农207的抗冻性强于郑麦366。
3 讨 论
在低温胁迫条件下,植物的膜透性增加,引起内溶物外渗,导致植物代谢的无序紊乱。植株遭受严重冻害时,细胞会渗出更多的内溶物,植物抗寒性越强,细胞膜受到的伤害越小[9]。MDA是膜脂过氧化的最终产物,逆境胁迫下植物中MDA含量越高,说明细胞膜受损越严重[10-11]。刘艳阳等[12]研究认为,冻害程度低的小麦株系中MDA含量较低,膜质过氧化程度小, 抗寒性强;冻害程度高的株系中MDA含量较高, 膜质过氧化程度高, 抗寒性弱。因此,MDA含量可作为小麦抗寒性鉴定的指标。脯氨酸被认为是一种植物渗透调节物质,也是蛋白质稳定剂和羟基自由基清除剂,通过与磷脂相互作用可以稳定细胞膜,并可作为碳和氮的来源[13]。游离脯氨酸也是一种渗透调节物质,可以减轻植物在低温胁迫下造成的机械损伤,增加细胞的保水性[14-15]。低温处理下小麦叶片的脯氨酸含量增加,且小麦抗寒性随脯氨酸含量的增加而增强[16]。不同小麦品种抗冻性的差异与其在遭受低温胁迫后相关生理生化反应差异有关[17]。本研究结果表明,连续低温处理24 h时, 百农207的MDA含量显著低于郑麦366,而Pro含量显著高于郑麦366;低温胁迫后幼穗受冻率与生理指标检测结果一致,反映出两个品种抗冻性存在差异,百农207抗冻性高于郑麦366。
随着分子生物学技术的不断发展,人们对植物抗逆性机制的研究重点从生理水平转向分子水平,并分离出许多抗逆基因,如抗渗透胁迫相关基因、抗氧化酶基因、抗膜脂相改变的基因、冷诱导基因等[18]。在前期研究中,我们分离出了冻胁迫相关免受胁迫伤害的功能蛋白抗逆基因如SOD、POD、LEA、P5CS和WCS,其中SOD、POD基因分别控制超氧化物歧化酶(SOD)、过氧化物酶(POD)的合成。WCS120基因是由低温特异诱导的,编码一种被认为在小麦冷驯化过程中起重要作用的蛋白质[19]。WCS120高表达可以减轻冻害带来的机械损伤,可维持或提高代谢物质的转运,从而提高植物的抗冻性[20]。胚胎发育晚期丰富蛋白(late embryogenesis abundant protein,LEA)[21]氨基酸残基多以无规则卷曲的形式存在, 这种结构有利于与水分子结合, 维持植物体所需的最低含水量。△1-pyrroline-5-carboxylate synthetase(P5CS)参与RNA剪接、脯氨酸生物合成、脱水反应、叶片形态发生和负调控根的生长[22]。P5CS是脯氨酸合成途径中一个关键基因,催化脯氨酸生物合成的最初前两步[23]。P5CS表达与脯氨酸积累密切相关[24-25]。P5CS过表达会使脯氨酸含量增加,提高转基因马铃薯、水稻和小麦的抗逆性[26]。本研究表明,不同小麦品种间叶片中相关抗逆基因的表达模式不同,在低温处理24 h时百农207这5个基因的表达量都较低温处理前显著升高,而郑麦366则显著下降。百农207叶片中除SOD在低温处理24 h时与郑麦366表达量无显著差异外,其余四个基因均显著高于郑麦366,这与百农207的MDA含量显著低于郑麦366的结果相一致,可见低温条件下,百农207清除活性氧的能力显著高于郑麦366,膜质过氧化程度较低, 抗寒性较强。低温处理后百农207叶片中P5CS基因表达量显著增加,在低温处理24 h时显著高于郑麦366,而郑麦366的表达量较处理前显著下降,与其脯氨酸含量表现相一致。据报道,脯氨酸的积累是由脯氨酸的生物合成和降解的基因转录变化所调控的[27]。Verslues和Sharma[28]也提出了在盐胁迫条件下拟南芥脯氨酸积累符合PDH和P5CDH下调、P5CS上调的代谢模型,本研究结果与此相似,由于本研究只分析了P5CS表达量变化,因而低温条件下冬小麦脯氨酸积累是否与其他基因相关有待于进一步探讨。
在低温胁迫后,生理指标和相关抗逆基因表达检测结果与低温胁迫后幼穗受冻率检测结果均表明百农207拔节期抗冻性比郑麦366高。本课题组近三年大田调查亦发现百农207的抗冻性总体高于郑麦366,与本研究结果相一致。因此在大田栽培过程中为避免突然发生的低温胁迫对小麦造成的危害,应选育和种植抗冻性强的品种。我们下一步主要进行相关抗冻基因特性及功能研究,并有望获得冻胁迫基因超表达的小麦植株新品系。

