基于PCR-DGGE技术的古襄阳白酒窖泥微生物多样性分析
向凡舒,王瑞萍,赵慧君,雷敏,崔梦君,李娜,折米娜,郭壮,张振东
(湖北文理学院食品科学技术学院鄂西北传统发酵食品研究所,湖北襄阳441053)
浓香型是中国八大香型白酒之一,主要制作原料是粮谷,经固态发酵、蒸馏、陈酿、勾兑而成,具有以己酸乙酯为主题复合香的白酒,其产量与销量均占我国白酒产量与销量的一半以上[1]。一般而言,浓香型白酒使用泥窖进行固态发酵,在发酵过程中,窖泥的微生物可以进入到粮谷中,因此窖泥中的微生物群落结构对白酒的滋味与风味的形成起到重要作用[2-3]。研究表明,窖泥中的梭菌与乳酸菌的比例是影响白酒品质最主要的因素之一[4-6]。
梭菌是一类细胞形态呈梭状(鼓锤状),厌氧或微需氧,革兰氏阳性,产芽孢的一类细菌。梭菌能够发酵碳水化合物产生小分子脂肪酸,如丁酸梭菌(Clostridium butyricum)能发酵淀粉等糖类产生丁酸、乳酸以及醋酸,其他梭菌也多数能够产生一些小分子的有机酸[7-8],其中最重要的一类梭菌是能够发酵淀粉等糖类产生己酸的微生物。固态发酵过程中,己酸能与产生的乙醇通过酯化反应产生己酸乙酯,是一种影响浓香型白酒品质的主要因素之一。对于能够产生己酸乙酯的梭菌,最早是由巴克尔发现的Clostridium kluyviri 和北原分离出来的Clostridium barkeri[9]。后来随着对国内白酒窖泥中微生物的研究,越来越多的己酸梭菌被发掘出来,甚至应用到窖池的维护及白酒生产。另一类在窖泥中占有较大比例的微生物类群为乳杆菌属(Lactobacillus),研究显示,乳杆菌在多个地区的浓香型白酒窖泥中被检测出来。在对江苏汤沟酒厂的窖泥研究显示,高质量窖泥中的乳杆菌相对含量为6.45%,中等质量窖泥中为7.04%,而在退化窖泥中的相对含量高达91.46%[10]。本研究采集了湖北省襄阳市古襄阳酒业的新窖与老窖的窖泥,使用变性凝胶电泳技术对窖泥中的微生物群落结构进行了解析,这为人为调控窖泥中的微生物群落结构以提高白酒品质提供了理论指导,并为从窖泥中分离与收集特定的微生物菌种资源奠定了基础。
1 材料与方法
1.1 材料与试剂
窖泥样品:采集于湖北省襄阳市古襄阳酒业有限公司,将样品保存在无菌塑料容器内,迅速放置到-70 ℃冰箱备用,新窖下层窖泥样品记为XS,新窖中层的窖泥样品记为XZ,新窖上层的窖泥样品记为XX,老窖下层窖泥样品记为LX,分别选取5 个窖池,每个新窖窖池采集了3 个样品,老窖采集了1 个样品。
丙烯酰胺、甲叉双丙烯酰胺、去离子甲酰胺、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(EDTA·2Na)、尿素(Urea)、过硫酸铵、四甲基乙二胺(N,N,N',N'-tetramethylethylenediamine,TEMED)、氯化钠,均为分析纯:上海国药集团化学试剂有限公司;10×聚合酶链式反应(polymerase chain reaction,PCR)Buffer(含镁离子)、dNTP(2.5 mmol/L)、rTaq DNA 聚合酶(5 U/μL)、pMD19-T 载体试剂盒:宝生物工程(大连)有限公司;大肠杆菌(Escherichia coli)top10:鄂西北传统发酵食品研究所微生物实验室保存;胰蛋白胨、酵母粉:英国OXOID 公司;D5625-02 土壤 DNA 提取试剂盒:美国Omega 公司。引物序列见表1,由天一辉远公司合成。

表1 所用引物与序列Table 1 The premiers and sequences
1.2 仪器与设备
280CB+手提式高压灭菌锅:浙江新丰公司;Veriti PCR 仪:美国ABI 公司;DCode 变性梯度凝胶电泳仪:美国伯乐公司;UVPCDS8000 凝胶成像系统:美国ProteinSimple 公司;CT15E 台式高速离心机:日本日立;BG-160 隔水式培养箱:上海博讯公司;DYCP-31E 琼脂糖凝胶电泳系统:北京六一公司;SW-CJ-2FD 超净工作台:江苏苏净公司;NanoDrop 2000 超微量紫外分光光度计:美国ThermoScientific 公司。
1.3 方法
1.3.1 窖泥微生物总DNA 提取
将窖泥样品取出迅速解冻后,称取1 g,使用土壤DNA 提取试剂盒按照说明书进行窖泥总DNA 的提取,并使用超微量紫外分光光度计测定所提取的DNA质量。
1.3.2 窖泥细菌16S rRNA 的V3 区扩增
以提取到的窖泥总DNA 为模板,使用引物ALLGC-V3F 与 ALL-V3R 扩增窖泥样品的16S rRNA 的V3 区,PCR 程序参照 Pearce 的条件[11],略有修改:94 ℃热启动 5 min;94 ℃ 45 s,58 ℃退火 45 s,72 ℃延伸 30 s,35 个循环;再 72 ℃延伸 10 min。体系为 50 μL:10×PCR buffer,5 μL;dNTP,4 μL;ALL-GC-V3F 与 ALLV3R(10 mmol/L),各 1 μL;DNA 模板,10 ng,加无菌纯水补足50 μL。待PCR 结束后,使用琼脂糖凝胶电泳检车PCR 产物的质量。
1.3.3 窖泥细菌的变形梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)
DGGE 的操作参照黄静的方法[14]进行:下层变性胶浓度梯度从上到下是27%~60%,使用轮式手动灌胶系统灌入下层胶后,加入水将下层胶压平,待下层胶凝固后,除去加入的水,灌入分离胶。分离胶不含变性剂,长度为3 cm 左右。待上层胶凝固后,小心拔出梳子,将胶板固定好,装入电泳槽,加入0.5×TAE 并加热。待电泳液温度升至60 ℃后,在每个泳道加入15 μL 左右的PCR 产物。初始电压设置为120 V,待指示剂快速通过上层胶后,将电压调整为80 V,电泳时间为16 h。
电泳结束后,使用银染法染色,在扫描仪上拍照保存图像,标识出特征条带,并切下来,装入无菌的1.5 mL 离心管中,加入 50 μL 的无菌水,4 ℃过夜,以之为模板,使用引物ALL-V3F 与ALL-V3R 进行PCR扩增,PCR 体系与PCR 程序参照1.3.2 的方法进行,并将PCR 产物进行琼脂糖凝胶电泳检测。
1.3.4 条带序列测定与分析
PCR 产物的TA 克隆步骤参照黄静的方法进行[14],取1.3.3 步骤得到的PCR 产物,进行TA 克隆并测序:首先将 PCR 产物与 pMD19-T 在 16 ℃连接 90 min,连接后转入大肠杆菌感受态细胞,使用M13F(-47)与M13R(-48)以克隆子为模板进行PCR 验证,并进行琼脂糖凝胶电泳检测结果。挑取阳性克隆子送到天一辉远(武汉)生物科技有限公司测序。将获得的序列在NCBI 数据库Blast 比对,挑取相似度最高的模式菌序列,使用MEGA7.0 软件[15]以邻接法构建系统发育树,确定DGGE 特征条带序列的系统分类。
1.3.5 乳酸菌16S rRNA 的V3 区扩增
窖泥乳酸菌的PCR 使用带有GC 夹子的引物Lac-GC-F 与 Lac-R,将退火温度设为 55 ℃[13],PCR 程序的其他条件及PCR 体系参照方法1.3.2。
1.3.6 窖泥乳酸菌的DGGE
窖泥乳酸菌的DGGE 变形梯度设置为30%~60%,其他条件与步骤同1.3.3。
1.3.7 条带序列测定与分析
具体试验方法与步骤参照1.3.4。
2 结果与分析
2.1 新窖与老窖窖泥的乳酸菌群落结构差异分析
窖泥对浓香型白酒的品质具有极大影响,为解析湖北省襄阳市古襄阳浓香型白酒窖泥的细菌群落结构,比较新窖与老窖的细菌群落结构差异,我们采集了新窖与老窖的窖泥样品,并进行了变形梯度凝胶电泳,电泳图谱见图1。
由图1 可知,新窖窖池下层的窖泥与老窖下层窖窖泥的图谱中条带带型具有明显差异,老窖下层的窖泥全菌条带多于新窖,且条带类型更为丰富,而新窖则主要集中在图谱中央的两条亮带。由此可见,老窖窖泥中的细菌多样性可能更为丰富,而新窖则较为单一。为明确DGGE 图谱中的条带所代表的微生物类群,切取特征性条带,编号为A+数字,并对这些条带进行了TA 克隆与测序,获得的序列在NCBI 数据库的比对结果见表2,并根据测序序列与NCBI 最相近的模式种序列建立系统发育树见图2。
由表2 及图2 可知,窖泥中的细菌,通过DGGE法,共检测到了2 个菌门,分别是厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),其中厚壁菌门的细菌较为丰富,可以分为6 个科,分别为:芽胞杆菌科(Bacillaceae)、梭 菌 科(Clostridiaceae)、Gracilibacteraceae、毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)与高温放线菌科(Thermoactinomyc-etaceae),其中条带A9 与A14 的序列所代表的微生物类群尚未建立科的分类单位;它们进一步可以分为6个菌属,为梭菌属(Clostridium)、Gracilibacter、乳杆菌属(Lactobacillus)、Sedimentibacter、Syntrophaceticus、Croceifilum,而条带A13 的序列能与多个属的模式菌相似度超过了99 %,A12 与A16 与已知模式菌的最高相似度均低于91%,因此无法将它们鉴定为个已知菌属。
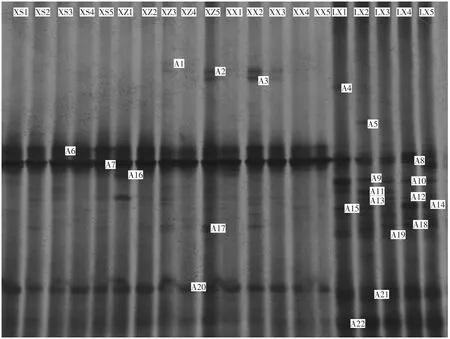
图1 窖泥总细菌DGGE 图谱Fig.1 Bacterial profile of DGGE fingerprints from the pit mud samples

表2 窖泥全菌DGGE 特征条带序列NCBI 数据库Blast 结果Table 2 The Blast results of bacterial bands sequences from pit mud using the NCBI database

图2 基于窖泥全菌特征条带序列的系统发育树Fig.2 Phylogenetic tree based on the bacterial sequence of the DGGE bands of pit mud samples
在这些条带中,能鉴定为乳杆菌属与梭菌属的特征条带数量最多,分别为5 个和4 个,其次是归为Petrimonas sulfuriphila 的特征条带有3 个,但是它们的条带亮度偏暗。由此表明在窖泥中,梭菌与乳酸菌的丰度最高,这与通过高通量测序法对窖泥的研究结果一致,乳杆菌属的相对含量超过了50%以上[16]。代表乳杆菌属的特征条带可以进一步分类为两种,第一类特征条带 A2、A3、A6 与 A20 鉴定为为耐酸乳杆菌(Lactobacillus acetotolerans),条带类型最多,而另一类条带A1,与多个乳杆菌的模式种的序列相似度均较高,无法鉴定为具体的种。而梭菌的4 个特征条带序列则可以进一步分为4 类,其中特征条带A7、A11 和A18 分别与模式种Clostridium cochlearium、Clostridium fallax及Clostridium butyricum 的相似度为100%,可以鉴定为这3 个梭菌种,而条带A22 仅与模式菌Clostridium caenicola 的相似度为95%,可能代表了一个新的细菌类群。
由于新窖窖泥DGGE 图谱(图1)泳道中间位置的A6 与A7 亮度明显高于其他特征条带,而经测序,我们发现基于这两个条带序列比对与系统发育关系分析(图2 与表2),可以分别将他们代表的细菌类群归为梭菌属与乳杆菌属,表明梭菌属与乳杆菌属类群的微生物在新窖窖泥中的丰度较高。另外,代表梭菌与乳酸菌的特征条带数量也是最多的,也证实了这一点。老窖样品的泳道中,A6 相对应的位置出现的条带较浅,另外老窖A20 相对应位置则未出现相应的条带,进一步说明了新窖的窖泥中的乳酸菌类群含量远远高于老窖窖泥中的数量,而这可能是导致新窖出产的白酒品质低于老窖的原因,差异主要可能由耐酸乳杆菌引起。基于DGGE 法对泸州老窖窖泥[17]的研究,同样检测大了耐酸乳杆菌的特征条带,说明在不同地区窖泥中,耐酸乳杆菌可能是窖泥中的共有微生物类群。
窖泥中的梭菌是另一类对白酒品质具有重要影响的细菌类群。DGGE 图谱中,新窖窖泥特征条带A7代表Clostridium cochlearium,对应位置的老窖样品中条带亮度更高,表明新老窖泥中的该类型梭菌均丰度较高,但老窖泥样品中的梭菌含量要高于新窖泥样品。除了A7 之外,老窖窖泥样品A22 代表的细菌也归为了梭菌未知种,而对应位置的新窖未出现特征条带。此外,老窖中特征条带A11 与A18 对应位置,新窖样品也未出现相应条带。可见,新窖与老窖虽然梭菌含量均较多,然而梭菌的组成却显然不同,新窖中的梭菌种类较为单一,老窖泥样品中丰度更高,含量也较多。在泸州老窖及江苏汤沟的窖泥中,同样是梭菌含量在老窖窖泥高于新窖窖泥[18-19]。
另外,对于位于不同位置的新窖样品而言,共有特征条带以A6 与A7 以及A20 为主,且它们的亮度远远高于其他条带,尽在少数样品中出现了一些偏暗的零散条带,但总体上,随着新窖上中下空间位置的变化,主要的细菌类群无明显变化,仍然是以梭菌与耐酸乳杆菌为主。
2.2 新窖与老窖窖泥的乳酸菌群落结构解析
为进一步明确新窖中的乳酸菌类型,我们使用乳酸菌专用引物,对新老窖泥中的乳酸菌进行了PCR,并通过DGGE 进一步明确了乳酸菌在新老窖泥中的分布,得到的DGGE 图谱如图3 所示。
由图3 可知,新窖中的最亮的特征条带仍然集中在图谱泳道的中央,而对应的位置老窖泳道中并未出现对应带型。除此之外,老窖样品泳道中出现的多个特征条带,并未在新窖中并未出现,表明老窖与新窖之间的乳酸菌差异极大,与细菌的DGGE 分析结果一致。
对这些特征性条带的序列进行了测序与系统发育分析,具体见表3 和图4。
尽管在对窖泥中乳酸菌的PCR 时使用了乳酸菌的专用引物[13],由表3 可知,老窖中的特征条带L1、L2与L3 代表的细菌类群并未鉴定为乳酸菌,其他特征条带L4、L9 与L10 鉴定为乳酸菌的2 个属,分别是肠球菌属(Enterococcus)与乳杆菌属,其中肠球菌属未在全菌DGGE 图谱中检测到;新窖中的特征性条带L5、L6、L7、L8 与 L11 均鉴定为乳酸菌,且属于乳酸菌的同一个属,与全菌DGGE 图谱的结果一致。
由表3 及图4 可知,新窖窖泥中的主要特征条带L5、L6、L7、L8 与 L11 代表的乳酸菌均鉴定为了耐酸乳杆菌,表明新窖窖泥中乳酸菌中耐酸乳杆菌占有绝对优势,而根据DGGE 图谱,在相应的位置老窖样品泳道并未出现这些特征条带。于此同时,老窖中的特征条带的序列经测序与分析,可以将它们鉴定为4 个属,分别是Pelospora、Pelotomaculum、肠球菌属与乳杆菌属,而条带L2 的序列与序列相似度最高的模式菌低于97%,因此可能代表了Marinilabiliaceae 科的新属。在老窖样品泳道中出现的代表乳酸菌的特征条带均为在新窖中出现,条带L4 与L10 与多个肠球菌属的多个模式菌相似度均超过了100%,条带L9 与植物乳杆菌等多个模式菌的相似度也超过了100%,无法将这些条带代表的乳酸菌归到已知某个乳酸菌种的分类单元中。因此老窖中的乳酸菌以植物乳杆菌类群与肠球菌为主,而新窖窖泥样品中以耐酸乳杆菌为主。总的来说,从空间排布上来看,来自5 个不同新窖上中下的窖泥中,特征条带的数量与带型并无明显差异,也说明了古襄阳新窖窖泥中的乳酸菌类群差异不大。

图3 窖泥样品乳酸菌DGGE 图谱Fig.3 Lactic acid bacterial profile of DGGE fingerprints from the pit mud samples

表3 窖泥乳酸菌DGGE 特征条带序列NCBI 数据库Blast 结果Table 3 The Blast results of lactic acid bacterial bands sequences from pit mud by NCBI database
3 结论
基于变性梯度凝胶电泳技术对新窖与老窖窖泥的全菌与乳酸菌的研究表明,古襄阳新窖与老窖窖泥中的微生物群落结构具有极大的差异,新窖中的细菌群落结构丰度低于老窖,且主要以乳杆菌属中的耐酸乳杆菌为主,而老窖中的细菌群落多样性更高,且以梭菌为代表的厚壁菌门类群为主,且含有的耐酸乳杆菌低于PCR-DGGE 的检测限。进一步的研究证实,老窖中的乳酸菌以肠球菌属乳酸菌以及植物乳杆菌类群为主,而新窖的窖泥样品均未检测到中这两类的乳酸菌,主要以耐酸乳杆菌为主。

图4 基于16S rRNA V3 区的窖泥乳酸菌系统发育树Fig.4 Phylogenetic tree based on the V3 region of 16S rRNA from pit mud samples

