用蛋白组学技术鉴定肝细胞损伤大鼠血清中的差异蛋白
苗玉发,康慧君,王晓姝,李路路,曲 哲,杨艳伟,张河战,李 波
(中国食品药品检定研究院,北京 100176)
酮康唑(ketoconazole,KTZ)化学名称为1-乙酰基-4{4-[2-(2,4-二氯苯基)-2(1H-咪唑-1-甲基)-1,3-二氧戊环-4-甲氧基]苯基}-哌嗪,是一种合成的咪唑类抗真菌剂,对皮肤真菌、酵母菌、双相真菌和真菌纲具有抑菌和杀菌活性。 作用机制为抑制真菌细胞膜麦角甾醇的生物合成并改变细胞膜脂类化合物的组成,影响细胞膜的通透性,抑制其生长[1]。 KTZ 在胃内溶解后易被吸收,其吸收后在体内可广泛分布到关节液、唾液、胆汁、尿液、乳汁、皮肤软组织和粪便中等。
2011 年8 月31 日,在第40 期《药品不良反应信息通报》中,200 mg KTZ 口服片剂被提示有严重肝毒性,因为临床上KTZ 已经引起患者严重的肝损伤。
四氯化碳(carbon tetrachloride, CCl4)是一种无色的液体,在动物体内能够引起肝细胞变性坏死,可以模拟人肝病变模式,而且个体差异较小,所以在研究中常用作肝细胞损伤模型的造模剂[2]。
目前,临床上预测肝损伤的常用指标是谷丙转氨酶(alanine transaminase, ALT),虽然其具有一定的特异性,但灵敏度存在不足,寻找灵敏度和特异性都较好的生物标志物一直是肝毒性研究的方向。本研究使用KTZ 和CCl4在Wistar 雄性大鼠中构建肝细胞损伤模型,以肝病理改变和ALT 升高两者都具备作为判断建模成功的标准。 对于建模成功的动物,制备外周血清,采用双向电泳技术筛选血清差异蛋白,再采用质谱技术鉴定蛋白质类型,寻找潜在的肝细胞损伤生物标志物。
1 材料和方法
1.1 实验动物
7 周龄Wistar 雄性大鼠96 只,SPF 级,160 ~200 g,从北京维通利华实验动物技术有限公司[SCXK(京) 2016-0006]购买。 在中检院安全评价研究所SPF 级屏障系统[SYXK(京) 2016-0045] 中饲养,每笼3 只。 实验动物使用与管理委员会(IACUC)批准号:IACUC2014026。 实验者在研究过程中遵循"3R"原则,并给予实验动物应有的福利和关怀。
1.2 主要试剂与仪器
200 mg KTZ 片剂(西安杨森制药公司);泡涨液(Bio-Rad 公司);蛋白质Marker(中科院上海生物化学研究所);血清蛋白提取试剂盒(美国Epigentek公司);CCl4(北京化工厂);ALT 检测试剂盒(日本和光株式会社);苏木素-伊红染色液(北京世济合力生物科技有限公司)。 5810R 型离心机(Eppendorf 公司);7180 型全自动生化分析仪(日本日立公司);Tissue-Tek VIP6 日本樱花全封闭组织脱水机(日本樱花精机株式会社);分析天平(岛津公司);等电聚焦电泳仪(Amersham 公司);SDSPAGE 电泳仪(Amersham 公司);凝胶扫描仪(GE healthcare 公司);分光光度计(岛津公司);质谱仪(Bruker 公司)。
1.3 实验方法
1.3.1 药物配制、给药剂量、分组及解剖
将KTZ 片剂溶于水混匀配制成40 mg/mL 的混悬溶液,冷藏备用;CCl4用精制花生油配制成30%的溶液,使用当天配制。 KTZ 给药剂量为225 mg/kg,CCl4(V/V:30%)给药体积为10 mL/kg。 实验设置KTZ 组、CCl4组和对照组。 给药方式为灌胃给药。 KTZ 组每天给药1 次,共给药2 次。 第2 次给药结束后4、24、48 和72 h 分别解剖8 只动物,制备血清,肝做病理切片。 CCl4组给药1 次后4、24、48和72 h 分别解剖8 只动物,制备血清,肝做病理切片。 对照组给予等量生理盐水1 次后4、24、48 和72 h 分别解剖8 只动物,制备血清,肝做病理切片。动物解剖前16 ~18 h 开始禁食,正常饮水。
1.3.2 外周血清和病理切片制作
动物麻醉后,从腹腔大静脉取2 ~3 mL 全血,静置约40 min 后,3000 r/min 条件下离心制备血清。 肝取材后放入10%甲醛固定液中固定24 h,置换新鲜固定液继续固定24 h。 然后将肝组织修块切成1 cm×1 cm×0.2 cm 大小的组织块,装入包埋盒中,经过脱水,透明后包埋成蜡块,并制作切片,进行苏木素-伊红(HE)染色,镜下观察肝组织病理改变[3-4]。
1.3.3 血清蛋白提取
收集对照组血清,以及KTZ 组和CCl4组给药后ALT 显著升高且肝发生病理变化的24 h 时间点的血清,每组动物的血清按组别分别进行混合后,按照试剂盒说明书进行蛋白质提取。
1.3.4 双向凝胶电泳
将KTZ 组、对照组和CCl4组各1.0 mg 蛋白质加入重泡涨液中,使总体积为450 μL,每组设3 个重复样。 用等电聚焦仪进行第一向固相pH 梯度等电聚焦电泳:12 h 重泡涨;250 V,0.5 h;1000 V,0.5 h ;8000 V,9 h。 结束后,胶片经平衡后进行第二向垂直平板SDS-PAGE 电泳[5-7]。
1.3.5 图像分析
将胶块在考马斯亮蓝中染色,然后脱色至背景清晰。 拍摄后用ImageMaster 7.0 软件进行分析,与对照组相比,KTZ 组和CCl4组同时具备大于1.5 倍的差异点作为目的蛋白。
1.3.6 酶解及质谱分析
将目的蛋白质点放入试管中,37℃超纯水中浸泡30 min,在脱色液中震荡脱色30 min,反复2 ~3遍,直至胶块和脱色液变无色;在100% ACN 中浸泡15 min,真空条件下离心干燥5 min;加入15 μL Trypsin 酶液,冷藏45 min,10 h 空气浴,然后将反应液收集试管中;加入50 μL 33% ACN 和0.1% TFA(三氟乙酸),萃取30 min,离心后吸取上清放置试管中。 用含66% ACN 和0.1% TFA,和含100%ACN 和0.1% TFA 的萃取液再萃取一次。 将反应液和3 次萃取液混合,冻干至5 ~6 μL,冷藏备用。 质谱分析时取样品0.5 μL 点靶,烤干,重复2 次,点基质0.3 μL,干燥后在质谱仪上分析[8]。
1.3.7 数据库检索
在NCBInr 数据库中检索蛋白质,参数设置:种类为Mus musculus;酶为胰蛋白酶,允许1 个漏切位点;肽质量容忍差异为0.2;MS/MS 容忍差异为0.3。使用UniProt 提供的数据库查询蛋白质功能。
1.4 统计学分析
2 结果
2.1 ALT 检测结果
KTZ 给药2 次后,给药结束后24 h,与对照组相比,ALT 值升高,差异具有统计学意义(P<0.05)。给药结束后4 h,48 h 和72 h,与对照组相比,ALT 的差异不具有统计学意义。 CCl4给药后4 h,与对照组相比,ALT 值升高,差异具有统计学意义(P <0.05),24 h 时达到峰值,且差异具有统计学意义(P<0.01)。 48 h 开始下降,72 h 显著下降,但仍高于对照组水平,差异具有统计学意义(P<0.01),结果见表1。
2.2 病理检查结果
KTZ 给药结束后24 h,病理结果显示肝轻度肝细胞泡沫样变性,见图1A,箭头所指为泡沫样变性。CCl4给药结束后24 h,肝中央静脉周围中度肝细胞气球样变和肝细胞坏死,见图1C,细箭头所指为气球样变,粗箭头所指为肝细胞坏死。 图1B 显示的对照组动物肝病理图片。
2.3 双向凝胶电泳结果
选取KTZ 组和CCl4组给药结束后24 h 制备的血清,进行双向蛋白电泳。 与对照组相比,KTZ 组和CCl4组共获得4 个相同的蛋白差异点。 含量增加的有点37,见图2;含量减少的有点27、93 和195,见图3(以点195 为代表)。
2.4 质谱鉴定结果
通过查询UniProt 数据库,发现与肝细胞毒性相关的上调蛋白1 个,下调蛋白3 个,结果见表2。
表1 各组ALT 检测结果(±s,n=8,IU/L)Table 1 Results of ALT analysis
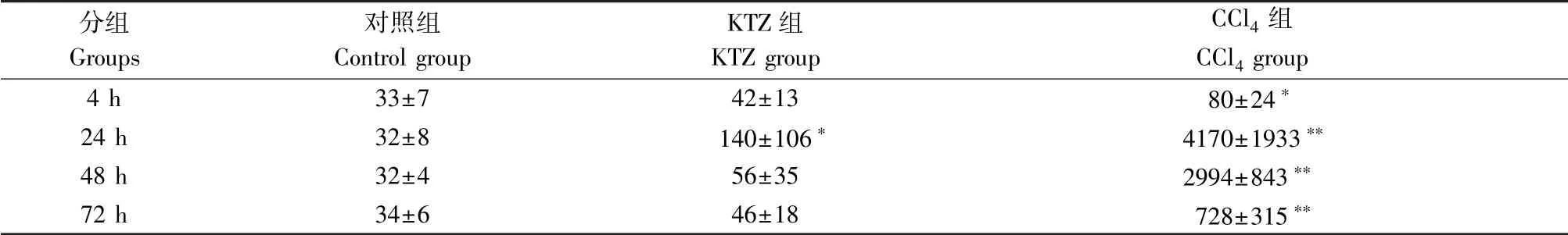
表1 各组ALT 检测结果(±s,n=8,IU/L)Table 1 Results of ALT analysis
注:与对照组比较,∗P<0.05,∗∗P<0.01。Note. Compared with the control group,∗P<0.05,∗∗P<0.01.
分组Groups对照组Control group KTZ 组KTZ group CCl4 组CCl4 group 4 h 33±7 42±13 80±24∗24 h 32±8 140±106∗ 4170±1933∗∗48 h 32±4 56±35 2994±843∗∗72 h 34±6 46±18 728±315∗∗
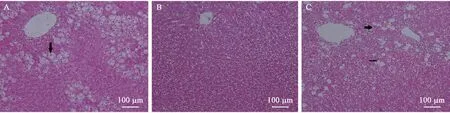
图1 肝组织病理改变的HE 染色图Figure 1 Pathological changes of the rat liver tissues(HE staining)
3 讨论
本研究中采用肝病理改变合并ALT 升高作为判断肝细胞损伤的标准,确保采集到的血清是肝细胞损伤发生时的血清,确保鉴定出的差异蛋白是肝细胞损伤发生时的差异蛋白。 KTZ 导致的肝细胞损伤,在临床中具有非常明显的个体差异,在动物体内也不例外。 前期探索研究中,发现雄性大鼠比雌性大鼠更容易诱导肝损伤模型,因此,本研究中只采用雄性大鼠进行研究,雌性大鼠肝细胞损伤后的差异蛋白可以在以后实验中继续探索研究。 探索实验还发现,225 mg/kg KTZ 给药1 次后,在2 h、4 h、6 h、8 h、24 h、48 h 和72 h 时,ALT 都没有出现升高。 连续给药2 次后4 h,仍只有少数动物的ALT升高,且无统计学意义。 在24 h 时,才出现有统计学意义的显著性升高,这说明此剂量水平的KTZ 对大鼠肝细胞损伤的个体差异较大。 更高剂量的KTZ并没有产生明显的毒性剂量效应,所以本实验中未进行更高剂量的肝毒性研究。 实验中CCl4给药一次后2 h,ALT 未出现统计学意义的显著性升高。 4 h 起,所有时间点ALT 都出现统计学意义的显著性升高,48 h 达到峰值,72 h 开始下降,但仍显著性高于对照组。 说明此剂量CCl4的肝细胞毒性远远大于225 mg/kg 剂量的KTZ,且个体差异较小,是急性肝细胞损伤理想的诱导剂。 本研究中CCl4的剂量约为3 mL/kg,目的是通过高剂量造成肝细胞的急性变性坏死,然后研究肝损伤发生时外周血中的差异蛋白。 高剂量的CCl4还可以避免因动物个体差异导致的造模失败。 KTZ 组和CCl4组24 h 点采集到的发生明显肝损伤时的外周血清分别用于双向电泳,并与对照组血清比较,筛选出共同的差异性蛋白用于质谱鉴定。
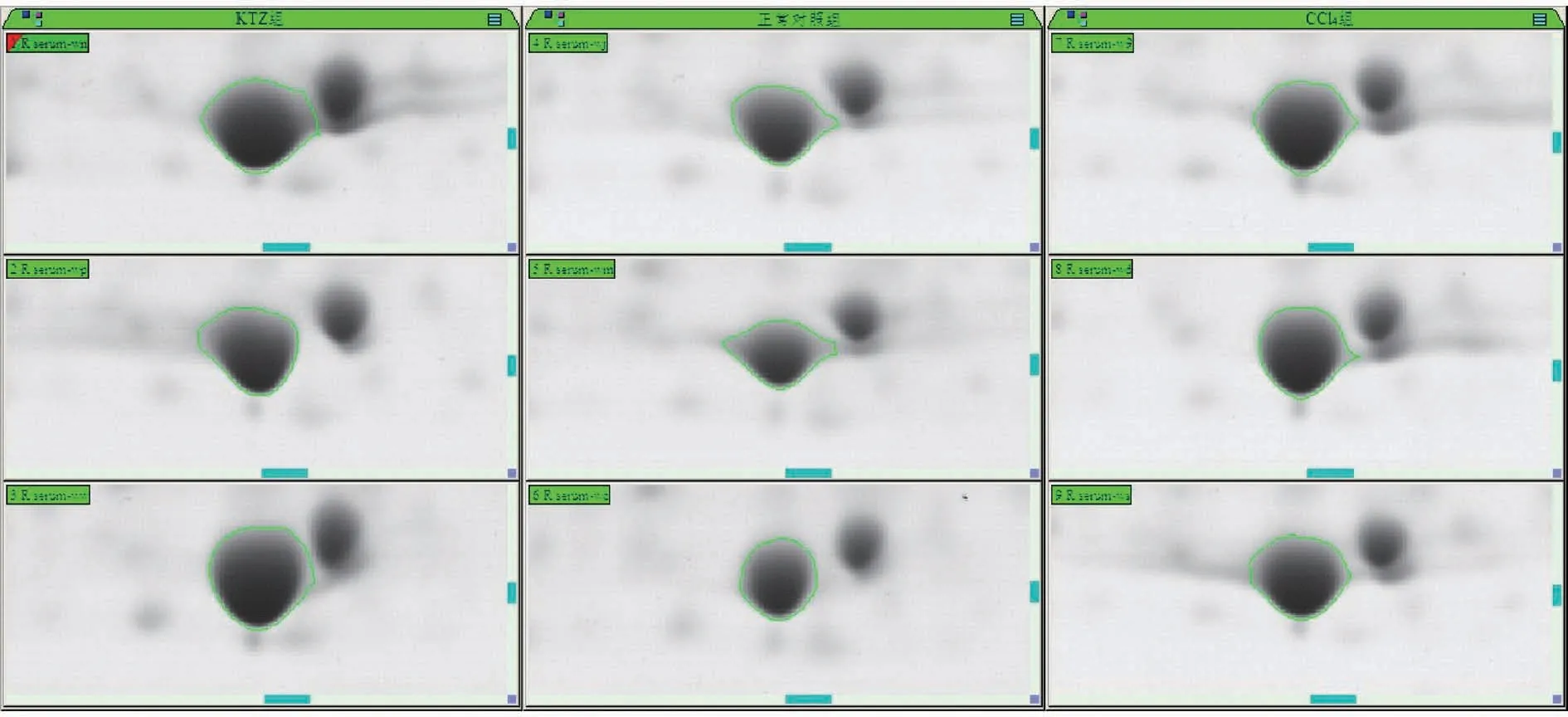
图2 点37 的双向凝胶电泳图Figure 2 Two dimensional gel electrophoresis images of Match ID 37

表2 质谱鉴定的差异蛋白质Table 2 Differential proteins identified by LC MS/MS analysis
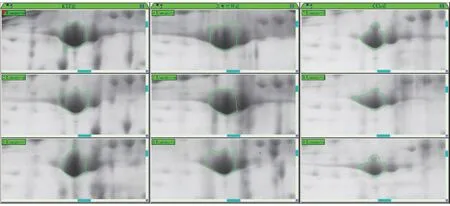
图3 点195 的双向凝胶电泳图Figure 3 Two dimensional gel electrophoresis images of Match ID 195
双向凝胶电泳是一种应用了20 余年的成熟技术,对蛋白质组的分辨率最高、重复性最好。 根据蛋白质的等电点和分子量不同,进行两次电泳将蛋白质分离,一般能分辨到1000 ~3000 个蛋白质点。蛋白分离后需经染色将蛋白显示出来,常用的染色方法有考马斯亮蓝染色和银染。 荧光染色和同位素标记也时常应用。 银染可检测到2~5 ng 的蛋白,考马斯亮蓝染色可检测到8~50 ng 的蛋白,因此,银染较考马斯亮蓝染色敏感。 银染虽然灵敏度高,但之后的质谱鉴定兼容性欠佳。 考马斯亮蓝虽然灵敏度低,但其操作简单且与质谱匹配度好,因而一直被广泛应用[9]。 本研究考虑到凝胶染色的灵敏度和质谱兼容性问题,选择了考马斯亮蓝染色。 这种染色方法的相对低灵敏度会导致一些低含量蛋白漏染,此外,多数糖蛋白不能被考马斯亮蓝染色,因此,大多数差异性的糖蛋白也不能够被识别出来。
ApoAI 是高密度脂蛋白( high - density lipoprotein,HDL)中的主要蛋白质,具有促进胆固醇的代谢以及调节HDL 的代谢作用,临床上HDL 水平的升高有助于推迟或阻止动脉粥样硬化的发生。有研究表明冠心病患者血清中Apo AI 的水平较低,肝硬化患者血清中ApoAI 水平非常显著性降低,肝硬化合并肝性脑病的患者血清中载脂蛋白AI、B 水平以及白蛋白水平也明显降低[10-11]。 Lee 等[12]采用双向电泳技术和质谱技术对羊子宫腔液的蛋白质进行研究,结果显示羊在妊娠时ApoAI 增加明显。
肝细胞急性损伤时肝细胞膜被破坏,细胞内物质被释放入血,包括大量血红蛋白。 游离的血红蛋白具有氧化还原活性,能破坏氧化还原微环境,导致细胞组织毒性。 血红蛋白结合蛋白和结合珠蛋白可以与血红蛋白结合从而起到抗氧化作用。 此外,当血红蛋白结合蛋白和结合珠蛋白耗尽时,游离的ApoAI 也可以作为抗氧化剂与血红蛋白结合,是消除血红蛋白氧化还原活性的又一有效途径[13]。本研究中KTZ 和CCl4能导致大鼠肝细胞急性损伤,血红蛋白释放入血,为清除血红蛋白的氧化还原活性,ApoAI 代偿性增加,这可能是导致24 h 点血清中ApoAI 含量上调的原因,但具体的机制仍不清楚,仍需要进一步研究各个时间点ApoAI 的变化情况。
GSH-Px 是一种重要的过氧化物分解酶,可以保护细胞膜的结构及功能不受干扰和损害[14]。 血浆GSH-Px 构成与胞浆GSH-Px 相同,由4 个相同的22×103 的亚基构成的四聚体,广泛存在于各个组织中。 GSH-Px 活性在妊娠期糖尿病孕妇血清中显著降低,可作为妊娠期糖尿病预测诊断指标之一[15]。有研究显示低水平的硒和GSH-Px 可作为辅助诊断晚发型重度子痫前期的有效生物学指标[16]。 此外,中药肝毒性研究结果表明GSH-Px 含量降低与肝毒性发生相关性比较大,而且指标灵敏性较强[17]。 本研究中肝损伤发生时,血中的GSH-Px 催化血中的过氧化物转化,消耗增加导致含量下调,与临床上肝毒性研究结果也相吻合。
Shore 于1973 年首先发现ApoE,Rall 等于1982年测出ApoE 的蛋白质一级结构。 人ApoE 是由299个氨基酸残基组成,富含精氨酸,主要由肝合成。ApoE 存在于血浆乳糜微粒(chylomicron, CM)、极低密度脂蛋白(very low-density lipoprotein, VLDL)及其残粒中[18]。 ApoE 是低密度脂蛋白(low-density lipoprotein, LDL)受体和CM 残粒受体的配体,它不仅参与脂蛋白代谢,还参与免疫调节和神经组织再生。 有研究表明早期帕金森病患者和晚期帕金森病患者血浆中ApoE 蛋白水平均显著低于对照组[19]。 本研究中ApoE 表达下调,可能与大鼠肝细胞损伤后ApoE 合成减少,以及消耗增加相关。
大鼠VDBP 是主要由肝合成和分泌的单体酸性糖蛋白,分子量大约52×103~54×103,其mRNA 总长为1700 个碱基。 VDBP 能与血液中维生素D 及其代谢产物25(OH)D 特异性结合,对甾醇类物质转运有重要作用。 有研究表明,VDBP 还能与肌动蛋白结合,阻止肌动蛋白的聚合。 此外,还发现VDBP 还能与B 淋巴细胞和T 淋巴细胞表面的某种膜蛋白结合,在免疫反应中发挥作用[20]。 有研究显示,肝纤维化患者和肝癌患者的外周血中VDBP 含量降低,而且疾病越严重,VDBP 降低幅度就越大[21]。 本研究中大鼠血清VDBP 含量在肝细胞损伤发生后减少,可能与肝细胞合成VDBP 减少,维生素D 甾醇类物质转运消耗增加有关。 肝损伤发生后,机体内免疫反应也会发生复杂变化,VDBP 也可能会参与免疫反应,多种累加效应导致检测时间点血中VDBP 减少,但具体机制仍需继续探索。
本研究鉴定出的4 种差异蛋白,可以作为肝细胞损伤的潜在生物标志物,在不同的动物肝细胞损伤模型中进一步进行灵敏度和特异性验证研究。

